Voda
| Voda (oxidan) | |
|---|---|
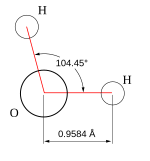 Struktura molekuly vody | |
| Obecné | |
| Systematický název | oxidan |
| Triviální název | voda |
| Anglický název | water, oxidane, dihydrogen oxide, dihydridooxygen[1] |
| Sumární vzorec | H2O |
| Identifikace | |
| Registrační číslo CAS | 7732-18-5 |
| Vlastnosti | |
| Molární hmotnost | 18,01528 g/mol |
| Teplota tání | 0 °C při normálním tlaku |
| Teplota varu | 99,98 °C 100 °C při normálním tlaku |
| Hustota | 0,99997 g/cm3 (kapalina při 3,98 °C) 0,998205 g/cm3 (kapalina při 100 °C) |
| Viskozita | 0,001 Nsm−2 |
| Index lomu | 1,33 |
| Kritická teplota Tk | 374 °C |
| Kritický tlak pk | 22 140 kPa |
| Povrchové napětí | 0,073 N/m (20 °C) |
| Rychlost zvuku | přibližně 1 460 m/s |
| Termodynamické vlastnosti | |
| Měrné teplo | 4 184 J⋅K−1⋅kg−1 (kapalina při 20 °C) |
Některá data mohou pocházet z datové položky. | |
Voda, chemickým vzorcem H2O, systematický název oxidan[2], je chemická sloučenina vodíku a kyslíku. Spolu se vzduchem, resp. zemskou atmosférou, tvoří základní podmínky pro existenci života na Zemi. Za normální teploty a tlaku je to bezbarvá, čirá kapalina bez zápachu, v silnější vrstvě namodralá. V přírodě se vyskytuje ve třech skupenstvích: v pevném – led a sníh, v kapalném – voda a v plynném – vodní pára.

Název
Systematicky se voda nazývá „oxidan“ (od názvosloví IUPAC 93[3]), vycházející z toho, že se jedná o anorganický[4] jednojaderný hydrid[5] (proto končí na příponu „-an“[6]). IUPAC uvádí ve svých názvoslovných doporučeních i anglický systematický název „dihydrogen oxide“[1], obdobný český název „oxid vodný“ se v odborné literatuře nepoužívá. I v odborném jazyce se však používalo a používá triviální označení „voda“.
Fyzikální vlastnosti
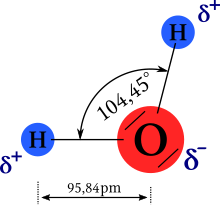

Mimořádné chemické a fyzikální vlastnosti vody jsou důsledkem geometrie její molekuly. Atomy v ní vázané nejsou uspořádány lineárně (v jedné přímce), ale chemické vazby mezi atomy svírají úhel přibližně 105 °. Polaritě vazeb (různé afinitě atomů vodíku a kyslíku) a zmíněné nelinearitě molekuly vděčí molekula vody za svoji polaritu. Vlastnosti molekul způsobují dobrou rozpustnost polárních a iontových látek ve vodě, jsou důvodem vysoké elektrické permitivity vody a díky jejich schopnosti zapojovat se do vodíkových vazeb (zvané též vodíkové můstky) jsou důvodem i významné hustotní anomálie vody.
Izotopické složení
Přirozená voda na Zemi obsahuje nejen izotop lehkého vodíku 1H a kyslíku 16O, ale také těžší stabilní izotopy těchto prvků. Standardní oceánská voda, používaná např. pro bývalou definici kelvinu jako hlavní jednotky SI, obsahuje na 1 mol vodíku 1H 0,15576 mmol deuteria 2H a na 1 mol kyslíku 16O 0,3799 mmol kyslíku 17O a 2,0052 mmol kyslíku 18O.[7] Přirozená voda mimo oceány může mít zastoupení těžkých izotopů nižší, ale ne tak, aby to způsobilo rozdílnost fyzikálních vlastností.
Uměle lze vytvořit izotopicky jednotné formy vody, z nichž některé mají své zvláštní jméno. Podle počtu neutronů v atomu vodíku rozlišujeme izotopology
- lehkou vodu (oba vodíky jsou protia, chemický vzorec je 1H2O),
- polotěžkou vodu (jeden vodík je protium a jeden deuterium, vzorec se dá zapsat jako HDO),
- těžkou vodu (oba vodíky jsou deuteria, vzorec je 2H2O, ale dá se také zapsat jako D2O; voda vyrobená z těžkých atomů vodíku, v přírodě se nachází zcela běžně ve směsi s normální vodou v nízké koncentraci, těžká voda sloužila ke konstrukci prvních atomových reaktorů) a
- tritiovou vodu (zvána též supertěžká voda, kdy jeden nebo oba vodíky jsou radioaktivně nestabilním tritiem (3H, též T).
Vodu lze také obohatit o těžší izotopy kyslíku 17O a 18O.
Jednotlivé izotopicky jednotné formy se vzájemně znatelně liší svými fyzikálními a dokonce i některými chemickými vlastnostmi (protože odlišná hmotnost jádra má částečný vliv i na vazebnou energii elektronů v atomovém obalu). Těžká voda má např. vyšší hustotu, body tání a varu a pH než voda lehká. Hustota vody s kyslíkem 18O je podobná hustotě těžké vody, voda s kyslíkem 17O je hustotou podobná vodě polotěžké.
Následující fyzikální vlastnosti se proto týkají pouze přirozeného izotopické složení (pokud není uvedeno jinak) a nelze je vztahovat na izotopicky čisté formy vody, zejména ne na ty s těžkými izotopy vodíku či kyslíku.

Hustota
Největší hustotu nemá led, ale tekutá voda při 3,95 °C, dalším snižováním teploty se objem jednotkové hmotnosti vody zase zvětšuje. Je to způsobeno polymerizací vodních molekul vodíkovými vazbami a úhlem mezi atomy vodíku – díky tomu může mít molekula v ledu pouze 4 nejbližší sousedy a v krystalové struktuře vznikají prázdné prostory. Tato zvláštnost má např. tyto důsledky:
- Led se tvoří na povrchu vodních ploch a tím nezmrzlou vodu izoluje, voda tolik nepromrzá do hloubky, přičemž voda o teplotě 3,95 °C se hromadí na dně vodních ploch. Tato skutečnost je velmi důležitá pro přežití vodních organismů.
- Tento proces urychluje zvětrávání – voda zvětšující svůj objem „trhá“ horniny a další látky.
- Zvětšování objemu má význam pro rostliny a zemědělství – při mrznutí dochází ke kypření ornice.
Povrchové napětí a viskozita

| teplota °C |
povrchové napětí mN/m |
viskozita mPa·s |
|---|---|---|
| 0 | 75,6 | 1,78 |
| 10 | 74,2 | 1,31 |
| 20 | 72,8 | 1,00 |
| 30 | 71,2 | 0,80 |
| 50 | 67,9 | 0,55 |
| 100 | 58,9 | 0,28 |
Tepelná vodivost
| teplota ve °C | tepelná vodivost ve W/(m.K) |
|---|---|
| −20 | kapalina: 0,523, led: 2,43 |
| 0 | kapalina: 0,564, led: 2,22 |
| 10 | 0,584 |
| 20 | 0,597 |
| 30 | 0,618 |
| 50 | 0,645 |
| 80 | 0,670 |
| 100 | 0,682 |
Termodynamické vlastnosti

Měrná tepelná kapacita (specifické teplo) je u vody zhruba třikrát až desetkrát (desetkrát u železa) větší než u většiny ostatních látek, jako jsou horniny, železo, hliník, atd. Proto má voda svou tepelnou setrvačností velký klimatický vliv a s výhodou se používá k transportu tepla (např. ústřední topení).
Skupenské přeměny charakterizuje fázový diagram vody, který je ve zjednodušené podobě uveden na obrázku. Ve skutečnosti existuje pevné skupenství vody, tedy led, v mnoha různých fázích, lišících se krystalovou strukturou a fyzikálními vlastnostmi.[8]
O fázovém přechodu mezi kapalným a pevným skupenstvím podrobněji pojednává odstavec hustota. Pro zmrznutí vody je podmínkou, aby v kapalině existovala krystalizační centra. Proto je možné, aby čistá a ustálená voda byla podchlazena i pod teplotu tuhnutí nebo aby horká voda zmrzla rychleji než ustálená voda studená (Mpembův jev). K náhlému zmrznutí podchlazené vody stačí i mechanický podnět (zatřesení, vhození tělíska).
Specifická skupenská tepla (tání a varu) – V tomto parametru je voda naprosto neobvyklá. Vysoké výparné teplo umožňuje efektivní ochlazování teplokrevných obratlovců, jako je člověk – bez pocení by nepřežili.
Bod varu – Obecný trend v periodické tabulce prvků je takový, že s rostoucí hmotností se zvyšuje teplota varu. Nicméně vodíkové můstky mají větší vliv na teplotu varu než hmotnost dané látky a že voda a všechny sloučeniny s vodíkem v druhé periodě – B2H6, CH4, NH3 a HF – jsou výjimkou v tomto trendu.
| sloučenina | teplota |
|---|---|
| H2O | 100 °C |
| H2S | −60 °C |
| H2Se | −41 °C |
| H2Te | −2 °C |
| H2Po | 36 °C |
| molární slučovací entalpie | ΔfH0g | −241,83 kJ/mol |
|---|---|---|
| ΔfH0l | −285,83 kJ/mol | |
| ΔfH0s | −291,8 kJ/mol | |
| molární entropie | S0g, 0,1 MPa | 188,84 J/(mol.K) |
| S0l, 0,1 MPa | 69,95 J/(mol.K) | |
| S0s | 41 J/(mol.K) | |
| Dolní indexy: f – slučování; g – plyn; l – kapalina; s – pevná látka; horní index: 0 – standardní | ||
Elektrické vlastnosti
Voda je výjimečná vysokou permitivitou (relativní permitivita je přibližně 80).
Chemicky čistá voda je velmi slabě elektricky vodivá, ale i malé množství rozpustných příměsí výrazně zvyšuje její vodivost, až řádově. Protože se běžně setkáváme spíše s vodou ne úplně destilovanou, lze tvrzení obrátit: s poklesem koncentrace iontů příměsí vodivost vody klesá, s jejich úplným odstraněním dokonce prudce. Čistá voda je ovšem extrémní situace: i proto ji přes její velkou schopnost polarizace do kondenzátorů nepoužíváme.
Nestlačitelnost
Voda je často dávána za příklad nestlačitelné kapaliny. Její skutečná stlačitelnost sice není úplně nulová, nicméně tato hodnota je natolik malá, že se běžně zanedbává.
Chemické vlastnosti

Voda vzniká prudkým až explozivním slučováním vodíku s kyslíkem (hořením bezbarvým plamenem) podle rovnice:
- 2H2 + O2 → 2H2O,
za vývinu velkého množství tepla (exotermní reakce). Kromě toho vzniká jako vedlejší produkt vedle solí při neutralizaci kyselin zásadami, např.
- HCl + NaOH → H2O + NaCl.
Voda je obsažena ve spalných plynech při hoření většiny organických látek, např. methanu
- CH4 + 2O2 → 2H2O + CO2,
nebo oktanu (hlavní složky benzínu)
- 2C8H18 + 25O2 → 18H2O + 16CO2.
Vodné roztoky mohou vykazovat kyselou, neutrální nebo zásaditou reakci. Kyselost (acidita) a zásaditost (bazicita) se vyjadřuje ve stupnici hodnot pH. Rozsah stupnice je od 0 do 14 pH, přičemž hodnotě pH 7 odpovídá roztok neutrální. Hodnoty nižší označují roztok kyselý, hodnoty vyšší zásaditý čili alkalický. Vody kyselé jsou obvykle bez života, protože se v nich nevytváří plankton ani baktérie.
Tvrdost vody
Veličina nejčastěji udávající koncentraci kationtů vápníku a hořčíku ve vodě. Definice tvrdosti vody je však nejednotná, někdy se tak označuje koncentrace dvojmocných kationtů vápníku, hořčíku, stroncia a barya nebo všech kationtů s nábojem větším než jedna. Vzhledem k této nejednotnosti se moderní hydrochemie termínu tvrdost vody snaží vyhýbat. V praxi mnoha oborů, například akvaristiky, se však pojem tvrdost vody stále často užívá.
Voda v přírodě
Rozšířením vody na Zemi a jejím pohybem se zabývá hydrologie, pohyb vody v zemské atmosféře zkoumá též meteorologie. Výskyt vody na naší planetě je mnohem vyšší než na ostatních planetách sluneční soustavy. Při pohledu z vesmíru vypadá Země jako modrobílá planeta: bílá od vodní páry a modrá od vody. A zákonitě všechny formy života (tak, jak ho známe) závisejí na vodě. Část zemského povrchu s obsahem vody v kapalném skupenství nazýváme hydrosféra.
Většinu povrchu Země (71 %) pokrývá slaná voda moří a oceánů, jež tvoří 97 % celého vodstva na naší planetě. Obsahuje průměrně 35 g solí v jednom litru. Z toho 77,8 % chloridu sodného (NaCl), 10,9 % chloridu hořečnatého (MgCl2) a další soli jako síran hořečnatý, síran vápenatý, síran draselný a jiné.
Sladká voda tvoří jen nepatrnou část hydrosféry – 3 %, přičemž 69 % této vody je v ledovcích, které jsou v polárních oblastech. Dalších 30 % je voda podzemní a jen necelé procento tvoří voda povrchová a atmosférická.

| Forma | množství (mil. km³) | procent z celku |
|---|---|---|
| Moře a oceány | 1 370 | 97,25 % |
| Ledovce | 29 | 2,05 % |
| Spodní voda | 0,5 | 0,68 % |
| Jezera | 0,125 | 0,01 % |
| Půdní vlhkost | 0,065 | 0,005% |
| V atmosféře | 0,018 | 0,001% |
| Řeky | 0,0017 | 0,0001 % |
| Biosféra | 0,0006 | 0,000004 % |
| Celkem[9] | 1 409 | 100 % |
Koloběh vody na kontinentech začíná srážkami. Jakmile dopadnou z mraků na povrch, mohou putovat třemi cestami:
- zpravidla víc než 50 % (někdy i 100 %) se znovu vypaří
- méně než 30%, většinou 10 % – 20 %, steče do potoků, řek a nakonec do moře
- 10 % a méně (ale také nic) se může vsáknout.
Množství kyslíku rozpuštěného ve vodě nepřesahuje maximální koncentraci 14 mg kyslíku na litr vody při teplotě 4 °C, s rostoucí teplotou pak množství kyslíku klesá, a tak voda o teplotě například 20 °C obsahuje pouze 9 mg kyslíku na litr.
Výskyt vody ve vesmíru
Voda je druhá nejčastější látka ve vesmíru.[10]
Ve vesmíru se velké množství vody nachází v molekulárních mračnech v mezihvězdném prostoru. Také protoplanetární mlhovina, ze které vzniklo Slunce a celá sluneční soustava, obsahovala velké množství vody, z níž část se zachovala v Oortově oblaku, kde se z ní zřejmě ještě dnes tvoří nové komety. Jádra komet obsahují desítky procent vody. Podle jedné z teorií právě komety zanesly na Zemi většinu vody, která zde v současnosti je.
Také některé měsíce planet, tělesa Kuiperova pásu a transneptunická tělesa jsou převážně tvořena vodou v pevném skupenství. Velký podpovrchový oceán vody se předpokládá na Jupiterově měsíci Europa.
V červenci 2007 bylo oznámeno,[11] že se voda v plynném skupenství nachází i na extrasolární planetě — konkrétně na planetě HD 189733b, nacházející se 63 světelných let od Země v souhvězdí Lištičky.
- plynná (vodní pára)
- kapalná:
- zmrzlá voda (led)
- Mars – výskyt potvrdila na pólech orbitální sonda Mars Express
- Pluto – odhad, že led tvoří asi 30 % Pluta
- Europa (měsíc planety Jupiter) – na povrchu je led
- Merkur – výskyt potvrdila sonda Mariner 10, nachází se v kráterech blízko pólů
- Phoebe (měsíc planety Saturn) – předpoklad podle hustoty
- Enceladus (měsíc planety Saturn) – velmi pravděpodobný předpoklad
- komety – předpoklad
- okraje mlhovin, např. v Oortově oblaku – předpoklad
- není vůbec:
Voda a člověk
„Nepatří mezi živiny, ale je pro lidský organizmus nezbytná. Tvoří prostředí pro životní děje, je rozpouštědlem většiny živin, pomáhá regulovat tělesnou teplotu a umožňuje trávicí procesy. Díky pravidelné výměně vody můžeme z těla vyplavovat škodlivé látky“.[13] Především u minerálních vod však dochází k usazování minerálů v těle.[14] Dospělý člověk by měl denně přijmout 2–3 litry vhodných tekutin (tj. včetně vody obsažené v jídle), při velké fyzické zátěži i více.[13] Nesmí se však přijímat velké množství vody nárazově, aby zatížené ledviny zvládly vyloučit takové množství.[15] Člověk vydrží nejdéle bez vody 7–10 dní. Při dlouhodobém nedostatku vody může dojít k tvorbě ledvinových kamenů a krátkodobý nedostatek se projeví žízní, nevolností, slabostí a křečemi.[16] Dále je důležité dbát na pitný režim u dětí a seniorů, kteří jsou náchylnější k dehydrataci, onemocnění ledvin a močových cest. Výjimkou jsou děti do věku šesti měsíců, u kterých podávání vody není doporučováno. Jejich hydrataci zcela zajistí mateřské či umělé mléko. Nedoporučuje se pít při jídle ani po něm, aby se nesnižovala účinnost trávení.[17] Vodu ztrácíme denně v podobě moči (1,5–2 l), pocením, plícemi (při dýchání se za 24 hodin vyloučí asi 400 ml vody) a stolicí.[18]
Rostliny
Voda má pro rostliny více významů než jako rozpouštědlo živin. Pro mnoho druhů je prostředím, kde žijí. U některých[kdy?] rostlin je voda nebo zvýšení jejího obsahu (například v semenech) důležitou součástí některých procesů.
Voda pomáhá dopravovat látky v rostlinách (transpirační proud a asimilační proud) a je součástí mnoha dalších procesů založených na fyzikálních a chemických principech. Voda je například zdroj H+ při fotosyntéze. Funguje jako termoregulace. Udržuje buněčné napětí (turgor). Voda může někdy nahradit substrát (například hydroponie)
Vodní hospodářství
Vodní hospodářství obecně zajišťuje dodávky pitné vody (vodní zdroj, vodárna, vodojem, vodovod, vodovodní přípojka) pro domácnosti i průmysl a nakládá s odpadními vodami. Provádí odběr, transport (stoková síť neboli kanalizace) a čištění odpadních vod v čistírnách odpadních vod. Předchází znečištění vody.
Pitná voda
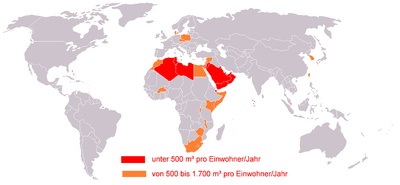
červeně: pod 500 m3 na obyvatele za rok
oranžově: 500–1700 m3 na obyvatele za rok.
Pitná voda se získává úpravou surové vody. Surová voda se získává z podzemních nebo povrchových zdrojů. Z některých zdrojů – zejména podpovrchových – je možné získat pitnou vodu bez úpravy.
- Ke shromažďování povrchové vody slouží vodní nádrž (přehrada), v níž se nachází odběrová věž s několika odběrovými šachtami v různých hloubkách. Odebírá se podle příkazu z úpravny vody, která bývá v blízkosti přehrady. Vhodná teplota pro odběr je méně než 12 °C.
- Výjimečně se využívá umělé filtrace a absorpčními schopnosti půdního sedimentu, protože řasy často ucpávají filtraci. Voda z toku se nechá infiltrovat z umělých nádrží do podzemí a z podzemí se poté čerpá. Příkladem může být vodárna v obci Káraný, která od r. 1911 vyrábí kvalitní pitnou vodu pro přibližně třetinu Prahy a řadu dalších obcí a měst Středočeského kraje.
- Čerpání z podpovrchových zdrojů z podzemních vrtů.
Surová voda se odvádí do úpravny vod. Tam se upravuje (mechanické předčištění, chemické čeření, filtrace přes pískové filtry, odstranění iontů železa a manganu, někdy i částečné odstranění dusičnanů a dusitanů, dezinfekce). Pak směřuje do vodojemů a z nich se vodovody dopravuje k spotřebitelům.
K pitné vodě v současnosti (2006) nemá přístup více než 1 miliarda lidí. Proto je zajištění přístupu k pitné vodě jedním z cílů usnesení OSN Rozvojové cíle tisíciletí. Usiluje o to také česká humanitární organizace Člověk v tísni.
Balená voda

Výroba a prodej balených vod má v Česku dlouhou tradici, kterou můžeme vystopovat až do 16. století. Původně šlo výhradně o vody léčivé (ať už se skutečným nebo domnělým účinkem), stáčené do kameninových džbánků. K nim se později (18. – 19. století) přidaly i vody, které byly pro svou zvláštní chuť považovány za osvěžující nápoj. Jednalo se buď o minerální vody nebo o vody s vysokým obsahem oxidu uhličitého (CO2), ať původu přirozeného (kyselky) nebo uměle připravované, stáčené převážně do skla. Tento stav se v Evropě v podstatě udržel do 60.–70. let minulého století, kdy jednak skleněné obaly začaly být postupně vytlačovány plastovými a jednak došlo ještě k jiné, mnohem revolučnější změně: balené vody začaly být používány též jako zdroj „obyčejné“ pitné vody, nejen jako řešení občasných havarijních situací, ale především jako náhrada za pitnou vodu distribuovanou veřejnými vodovody. Což znamená, že se vedle vybraných druhů minerálních vod začaly stáčet i vody z kvalitních podzemních zdrojů pitné vody, které nevykazovaly ani zvláštní chuť, ani zvláštní farmakologický účinek.[19]
Znečištění vody
Voda má hodnotu nejen ekonomickou, ale i ekologickou. Pětina lidstva nemá přístup k nezávadné vodě. 2,6 miliardy lidí postrádá hygienické zázemí. Ve 20. století zmizelo 50% světových mokřadů. 3 miliony lidí ročně umírají na choroby způsobené kontaminovanou vodou a špatnou hygienou (např. průjmová onemocnění a malárie), 90% z nich jsou děti do pěti let. O to nepříjemnější je skutečnost, že se zásoby sladké vody na Zemi snižují. Podle odhadu Organizace pro výživu a zemědělství (FAO) klesly zásoby vody v Evropě o třetinu, v Asii o tři čtvrtiny a v Africe o dvě třetiny. Rozdíly mezi zásobami vody a její spotřebou se neustále prohlubují a lze přitom předpokládat, že spotřeba vody bude v následujících letech stále stoupat. Značná část znečištění životního prostředí pochází ze zemědělství (pesticidy, hnojiva i zvířecí exkrementy) a zasahuje i vodní zdroje. Pitná voda se stává strategickou surovinou a do intenzivně využívaných zemědělských oblastí se musí přivádět z velkých vzdáleností.
Bezpečnost
Chemické znečištění vody nelze převařením odstranit. Bakteriologické znečištění odstraníme povařením aspoň 5 minut (viry jsou usmrceny až po 30 minutách). Požadavky na jakost vody pro koupání ve volné přírodě upravuje vyhláška Ministerstva zdravotnictví č. 238/2011 Sb.
Spotřeba vody
Celková spotřeba vody (tj. osobní i průmyslová a zemědělská) na osobu je v Indii a Číně zhruba milión litrů na osobu na rok, ale v USA je to přibližně 2,8 miliónu litrů za rok,[20] což je zhruba decilitr za sekundu. Celková spotřeba vody v ČR je 57 000 litrů vody na osobu za rok. Roční spotřeba vody pouze v českých domácnostech (tedy bez průmyslu a zemědělství) činí 32,5 tisíc litrů na osobu, to jest přes 89 litrů denně.[21] Cena vody se v Česku liší podle okresu – pohybuje se mezi 45–160 Kč.[22] V domácnostech se nejvíce vody spotřebuje na hygienu (45 %), dále na splachování WC (23 %), praní a úklid (18 %), zalévání rostlin (2 %) a ostatní (2 %).[23]
Například k produkci 1 kg rýže je třeba 1000 až 3000 litrů vody, na 1 kg hovězího se spotřebuje 13 až 15 tisíc litrů[24] a na 1 kg čokolády až 17 tisíc litrů.[25] Výroba elektřiny ze zemního plynu spotřebuje 38 litrů na MWh, ale z uhlí 530 až 2000 litrů/MWh a z biopaliv dokonce stotisíce litrů.[26]
Historická poznámka
Iónský filosof Thalés z Milétu v 6. století př. n. l. pokládal vodu za základní element své kosmologie. Jeho následovníci až po Aristotela přidali další základní elementy, jako je oheň, země a vzduch, což potom dominovalo islámskému a křesťanskému myšlení. Čtyřprvkový princip přetrval až po Isaaca Newtona (De Natura Acidorum – myšlenka, že všechny látky lze převést na vodu). Až v 19. století přejal roli vody vodík. Přesné stechiometrické výpočty atomových hmotností jiných prvků však později ukázaly, že nemohou být jednoduchými násobky atomové hmotnosti vodíku.
Odkazy
Reference
- ↑ a b International Union of Pure and Applied Chemistry. Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005. Příprava vydání N.G. Connelly, T. Damhus, R.M. Hartshorn, A.T. Hutton. Cambridge: The Royal Society of Chemistry, Thomas Graham House, 2005. PDF. ISBN 0-85404-438-8. Tabulka IX, s. 306. (anglicky)
- ↑ (česky) Novela názvosloví organické chemie – přehled změn – bod 3.2
- ↑ (česky) Názvosloví vycházející z jiných hydridů
- ↑ (česky) Stručné základy názvosloví organických sloučenin Archivováno 16. 10. 2013 na Wayback Machine.
- ↑ (česky) Chemické názvosloví a názvy lékových forem v ČL 2002
- ↑ (česky) Předmluva Archivováno 14. 4. 2010 na Wayback Machine.
- ↑ 23. Generální konference pro váhy a míry (2007): Rezoluce 10. Dostupné online (anglicky)
- ↑ The Phase Diagram of Water
- ↑ M. Kravčík et al., Water for the recovery of the climate. Praha 2008, str. 17.
- ↑ http://phys.org/news/2015-10-universe-miraculous-molecule.html - The universe's most miraculous molecule
- ↑ pressesc.com: 01184180642_water_extrasolar. pressesc.com [online]. [cit. 2007-07-25]. Dostupné v archivu pořízeném dne 2007-07-14.
- ↑ http://www.foxnews.com/science/2015/09/28/mars-has-flowing-liquid-water-nasa-confirms.html Foxnews: Zpráva NASA z 28. září 2015.
- ↑ a b PIŤHA & POLEDNE. Zdravá výživa pro každý den. Havlíčkův Brod: Grada Publishing, 2009.
- ↑ http://www.mojemedunka.cz/clanek.aspx/zdravi/clanek/o-vode-a-soli Archivováno 2. 4. 2015 na Wayback Machine. - O VODĚ A SOLI
- ↑ http://www.scientificamerican.com/article/strange-but-true-drinking-too-much-water-can-kill/ - Strange but True: Drinking Too Much Water Can Kill
- ↑ KUNOVÁ, Václava. Zdravá výživa. Praha: Grada Publishing, 2004.
- ↑ http://sik.vse.cz/ozdravisenioru_radyadoporuceni_detail.php?da=pitnyrezim Archivováno 19. 11. 2015 na Wayback Machine. - Pitný režim ve stáří
- ↑ ROKYTA ET AL.. Fyziologie (2nd ed.). Praha: ISV nakladatelství, 2008.
- ↑ Balená voda, nebo voda z vodovodu – kdo vítězí? | Nazeleno.cz
- ↑ http://journalistsresource.org/studies/environment/sustainability/water-footprint-humanity/# - The water footprint of humanity
- ↑ https://www.czso.cz/csu/czso/cesi-v-domacnostech-denne-spotrebuji-pres-89-litru-pitne-vody ČSÚ
- ↑ CENA KUBÍKU VODY, VODNÉ A STOČNÉ 2020 - 2019 V CENOVÉ MAPĚ. Pravdaovode.cz [online]. Nadační fond Pravda o vodě [cit. 2020-03-02]. Dostupné online.
- ↑ Drahou vodu řeší lidé na řadě míst Česka. Stát pracuje na přísnější regulaci pro vodohospodáře. ČT24 [online]. Česká televize, 2023-05-08 [cit. 2023-05-08]. Dostupné online.
- ↑ http://www.ifad.org/english/water/key.htm Archivováno 14. 2. 2015 na Wayback Machine. - Water facts and figures
- ↑ http://www.waterfootprint.org/?page=files/productgallery Archivováno 30. 7. 2020 na Wayback Machine. - Water footprint - product gallery
- ↑ http://spectrum.ieee.org/energy/environment/how-much-water-does-it-take-to-make-electricity - How Much Water Does It Take to Make Electricity?
Literatura
- CÍLEK, Václav; JUST, Tomáš; SŮVOVÁ, Zdeňka, a kol. Voda a krajina. Kniha o životě s vodou a návratu k přirozené krajině. první. vyd. Praha: Dokořán, 2017. 198 s. ISBN 978-80-7363-837-5.
- M. Kravčík et al., Water for the recovery of the climate. Praha 2008. ISBN 978-80-89089-71-0
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu voda na Wikimedia Commons
Obrázky, zvuky či videa k tématu voda na Wikimedia Commons  Galerie voda na Wikimedia Commons
Galerie voda na Wikimedia Commons Slovníkové heslo voda ve Wikislovníku
Slovníkové heslo voda ve Wikislovníku Téma Voda ve Wikicitátech
Téma Voda ve Wikicitátech- Balená voda versus voda z vodovodu
- Water Structure and Behavior / M. Chaplin. – London South Bank University
- Josef Kučera: Voda má 66 anomálií
