Selan
| Selan | |
|---|---|
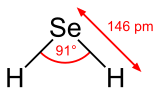 Strukturní vzorec a geometrie molekuly selanu | |
 Model molekuly selanu | |
| Obecné | |
| Systematický název | selan |
| Triviální název | selenovodík |
| Anglický název | Hydrogen selenide |
| Německý název | Selenwasserstoff |
| Sumární vzorec | H2Se |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 7783-07-5 |
| EC-no (EINECS/ELINCS/NLP) | 231-978-9 |
| Indexové číslo | 034-002-00-8 |
| PubChem | 533 |
| UN kód | 2202 |
| SMILES | [SeH2] |
| InChI | 1S/H2Se/h1H2 |
| Číslo RTECS | X1050000 |
| Vlastnosti | |
| Molární hmotnost | 80,98 g/mol |
| Teplota tání | −65,73 °C (207,42 K) |
| Teplota varu | −41,25 °C (231,9 K) |
| Hustota | 3,553 kg/m3 |
| Disociační konstanta pKa | 3,89, 11,0 |
| Rozpustnost ve vodě | 0,70 g/100 ml |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H331 H301 H373 H410 |
| R-věty | R23/25 R33 {{Rĵghfgyggy 50/53}} |
| S-věty | (S1/2) S20/21 S28 S45 S60 S61 |
| NFPA 704 |  4
4
0
|
Některá data mohou pocházet z datové položky. | |
Selan (H2Se) je dvouprvková sloučenina selenu a vodíku. Její vodný roztok se nazývá kyselina selanová a tvoří dvě řady solí: selenidy a nestabilní hydrogenselenidy. Je podobná sulfanu, který se také řadí mezi chalkogenovodíky. Mezi její vlastnosti patří rozpustnost v sirouhlíku a fosgenu. Selan je nejjedovatější sloučenina selenu. LC50 je 0,05 ppm při expozici 8 hodin.
Příprava[editovat | editovat zdroj]
Selan se často připravuje reakcí selenidu hlinitého a vody:
Al2Se3 + 6 H2O → 2 Al(OH)3 + 3 H2Se.
Také se připravuje reakcí H2O a CO v selenu (jako vedlejší produkt vzniká triethylamin).
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Hydrogen selenide na anglické Wikipedii.
- ↑ a b Hydrogen selenide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Selan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Selan na Wikimedia Commons





