Wikipedista:Choutkaj/Pískoviště
Emil Fischer[editovat | editovat zdroj]
| Hermann Emil Fischer | |
|---|---|
 Hermann Emil Fischer (1895) | |
| Narození | 9. října 1852 Euskirchen |
| Úmrtí | 15. července 1919 Berlín |
| Alma mater | Univerzita v Bonnu Univerzita ve Štrasburku |
| Povolání | Chemik |
| Zaměstnavatelé | Mnichovská univerzita (1875–81) Univerzita v Erlangenu (1881–88) Univerzita ve Würzburgu (1888–92) Univerzita v Berlíně (1892–1919) |
Hermann Emil Fischer (9. října 1852, Euskirchen – 15. července 1919) byl německý chemik, nositel Nobelovy ceny za chemii v roce 1902.
Fischer se zabýval zejména organickou syntézou a chemií přírodních látek, během svého života položil základy chemie purinů, sacharidů, proteinů, tříslovin a tuků. Jeho práce přispěla významně k rozvoji stereochemie a stereoselektivní syntézy. Pro jeho přínos v oblasti enzymologie (teorie zámku a klíče) je často označován za zakladatele oboru biochemie. Emil Fischer je považován za jednoho z největších chemiků všech dob.
Život[editovat | editovat zdroj]
Mládí a studium[editovat | editovat zdroj]
Emil Fischer se narodil jako nejmladší z osmi dětí v Euskirchenu, malém městě vzdáleném přibližně 50 km od Kolína nad Rýnem a 30 km od Bonnu. Jeho rodiči byli Laurenz Fischer a Julie Fischer (za svobodna Poensgen). Dva jeho sourozenci zemřeli před jeho narozením a tak vyrůstal spolu s pěti staršími sestrami ve spokojené protestantské rodině.
Jeho otec Laurenz Fischer byl úspěšný obchodník, spolu se svými dvěma bratry vlastnil firmu Gebrüder Fischer (Bratři Fischerové), která vedla pivovar, pilu a výrobu barviv. Emil Fischer tak v mládí rovněž často navštěvoval svého strýce Augusta Fischera, který bydlel s rodinou v těsném sousedství. Jeden z jeho synů, tedy Emilův bratranec Otto Fischer se později stal také chemikem a oba bratranci se podíleli na objasnění struktury rosanilinových barviv.[1] Jedním ze zaměření rodinného obchodu byla výroba anilinových barviv, což přivedlo mladého Emila Fischera k první zkušenosti s chemií, která byla později podpořena, když jeho otec začal provozovat i cementárnu.
Emil Fischer studoval nejprve pod vedením soukromého učitele na soukromé škole založené jeho otcem, a později na místní Höhere Bürgerschule v Euskirchenu. Poté pokračoval ve studiu po dobu dvou let na gymnáziu ve Wetzleru a další dva roky na gymnáziu v Bonnu. Studium ukončil s vyznamenáním v roce 1869.
Emil chtěl dále pokračovat ve studiu, ale jeho otec si přál aby se zapojil do řízení rodinné firmy, a tak studium na čas přerušil a pomáhal otci zejména v chemických problémech ve výrobě barviv a pivovarnictví. V té době si založil v opuštěné místnosti jedné z otcových provozoven laboratoř, pokusy zde prováděné “končily obyčejně zápachem nebo špinavými, popálenými prsty a kvůli riziku požáru nevyhovovaly příliš vlastníku budovy”[2].
Po nějakém čase se Laurenz Fischer myšlenky zapojit syna do rodinné firmy vzdal a Emil se rozhodl přece jen pokračovat v akademické kariéře a tak roku 1871 nastoupil na univerzitu v Bonnu, kde chemii v té době přednášel například August Kekulé. O rok později, v roce 1872, se přesunul spolu se svým bratrancem Otto Fischerem na univerzitu ve Štrasburku, kde začali pracovat v laboratoři Adolfa von Baeyera. Baeyer měl na oba studenty významný vliv a bylo to právě zde, v inspirativním prostředí a dobře vybavené laboratoři, kde se Emil Fischer rozhodl dále se věnovat chemii a opustit studium fyziky, ve kterém nacházel do té doby také zálibu.[2]
Tématem jeho práce byla nejprve redukce melitové (benzenhexakarboxylové) kyseliny z minerálu melitu. Tato práce však skončila neúspěchem, když se pod laborantem nesoucím velkou baňku s produktem a přibližně 25 kg rtuti propadla shnilá dřevěná podlaha a kýžený produkt skončil v propadlé podlaze.[3] Dále tedy pracoval Fischer na strukturní analýze fluoresceinu a jiných ftaleinových barviv. Emil Fischer získal doktorský titul v roce 1874.
Kariéra[editovat | editovat zdroj]

V roce 1874 byl Emil Fischer jmenován asistentem v jedné z laboratoří Adolfa von Baeyera na univerzitě ve Štrasburku. Hned v tomto roce učinil první ze svých objevů, když jako první připravil a popsal fenylhydrazin diazotací anilinu a následnou reakcí s hydrogensiřičitanem draselným.[4][5] V roce 1875 se Baeyer přesunul na univerzitu v Mnichově a Emil Fischer ho následoval. V Mnichově pokračoval u Baeyera v práci na hydrazinech, která vedla k jeho habilitaci v roce 1876.
Poté Fischer absolvoval semestrální studium analytické chemie u Friedericha Roseho ve Štrasburku, kde se věnoval mikroskopii pivních kvasinek. Roku 1879 byl jmenován profesorem a vedoucím analytického ústavu na Mnichovské univerzitě. V té době mezi jeho přátele a kolegy u Baeyera patřili například Wilhelm Koenigs (Koenigs-Knorrova syntéza glykosidů[6]) nebo Siegmund Gabriel (Gabrielova syntéza aminů).
V Mnichově se Fischer věnoval se svým bratrancem Otto Fischerem výzkumu rosanilinových barviv a poté derivátům močoviny a strukturní analýze močové kyseliny, která byla rozpracována dříve Adolfem von Baeyerem a Adolphem Streckerem (Streckerova syntéza aminokyselin).
V roce 1882 se Emil Fischer přesunul na univerzitu v Erlangenu, kde byl jmenován profesorem chemie. Wilhelm Koenigs byl po čas pobytu v Mnichově Fischerovým spolubydlícím a oba spolu často trávili večery nad nejednou sklenkou vína.
| „ | Mé zásoby vína nebyly v té době zrovna malé a vlastnil jsem i některé velmi dobré ročníky. Po mém přesunu do Erlangenu na velikonoce roku 1882 jsem požádal svého hostitele, aby mi mé zásoby zaslal. Vína nedorazila, a po mém dotazu vzešlo na jevo, že Koenigs se svými přáteli všechny mé zásoby vypili. Místo vína mi dorazil velký sud piva Münchner Hofbräu jako náhrada za ztracené víno. Koenigs věděl, že se vtipu budu smát, stejně jako by se ve stejné situaci smál on. | “ |
| — Emil Fischer, Aus meinem Leben | ||

Ve výzkumu na tamnější univerzitě mu pomáhal Lorenz Knorr. Fischer v té době zkoumal dopodrobna chování fenylhydrazinu. Tento výzkum vedl v roce 1883 k popsání Fischerovy indolové syntézy[7][8], která položila základ chemii N-heterocyklů. V té době rovněž Fischer popsal syntézu skatolu[9] a Fischerův student Lorenz Knorr provedl syntézu antipyrinu[10], jednoho z prvních syntetických léčiv.
V dalších letech Fischer dál studoval chování fenylhydrazinu a zkoumal jeho reakce mimo jiné s cukry, čímž objevil vznik hydrazonů a osazonů. Tyto deriváty, které mají vynikající krystalizační vlastnosti sehrály klíčovou roli v jeho další práci na poli sacharidů.
Roku 1883 dostal Fischer pozvání na několik týdnů do Badische Anilin und Soda Fabrik (BASF), kde pracoval na N-methylaci močové kyseliny ve velkém měřítku.[11] Pro provedení těchto pokusů využil několik kilogramů hadího trusu, z kterého byla kyselina močová v těch časech nejčastěji získávána. Během pokusů v BASF Fischer pracoval mimo jiné na syntéze kofeinu.
Fischer následně obdržel nabídku stát se profesorem chemie na prestižní ETH Zürich, ale musel odmítnou ze zdravotních důvodů, protože se zotavoval z infekce dýchacích cest, kterou si přivodil při práci s chloridem fosforečným.

V roce 1885 zamířil Fischer na univerzitu ve Würzburgu, kde pracoval nejdříve na derivátech purinu a poté na jeho monumentálním průkopnickém výzkumu strukturní analýzy a syntézy cukrů (monosacharidů). Ve Würzburgu se rovněž Fischer oženil a jeho ženou se stala Agnes Gerlach, kterou poznal v Erlangenu. Z tohoto manželství vzešly tři synové, bohužel Agnes Fischer zemřela o sedm let později v listopadu roku 1895 v Berlíně na meningitidu.
Po smrti A. W. von Hofmanna v roce 1892 byl Fischer vybrán na jeho místo na univerzitě v Berlíně (mezi další kandidáty patřili August Kekulé nebo Adolf von Baeyer). Fischer nejprve váhal, zda opustit spokojený život a přestěhovat se do velkoměsta, ale po naléhání své manželky a otce nabídku přijal. Jeho obavy také pramenily z faktu, že v Berlíně by musel přednášet před velkým počtem studentů a jeho řečnické schopnosti nebyly zcela vynikající. Fischer při veřejných vystoupeních a přednáškách spoléhal na svou výbornou paměť a své projevy se učil nazpaměť.[12][13]
V berlíně Fischer pokračoval ve výzkumu cukrů a derivátů purinu. Mezi jeho spolupracovníky v této době patřil Lorenz Ach, který s ním přišel z Würzburgu jako osobní asistent. S Achem vypracoval totální syntézu močové kyseliny (Fischerova – Achova syntéza) a kofeinu[14]. Fischer také v tomto období popsal přípravu samotného purinu a rovněž první syntetické narkotikum veronal[15] . Emil Fischer také zřejmě jako první využil v syntéze koncept chránicí skupiny, když derivatizoval různé monosacharidy isopropilidenovou skupinou.[16][17]
Za “syntézy v oblasti purinů a cukrů” byl Emil Fischer v roce 1902 oceněn jako druhý chemik v historii Nobelovou cenou za chemii. Ve svém projevu 19. prosince 1902 před švédskou akademií se systematičností a analytickými schopnostmi sobě vlastními shrnul současné znalosti o purinech a monosacharidech a mimo jiné předpověděl možnosti stereoselektivní syntézy a enzymové specifity:
| „ | Fermenty - v dnešní době nejčastěji označované jako enzymy - jsou tak všudypřítomné, že lze oprávněně říci, že se podílejí na většině chemických přeměn v živých buňkách. Výzkum syntetických glukosidů ukázal, že činnost enzymů je do velké míry závislá na geometrické struktuře přeměňované molekuly, a že obě molekuly do sebe musí zapadnout jako zámek a klíč. S jejich pomocí je následně organismus schopen vykonávat vysoce specifické chemické přeměny, které jsou dnes běžnými činidly naprosto neproveditelné. Abychom se v tomto směru vyrovnali Přírodě, musíme použít stejných prostředků. Předvídám proto den, kdy fyziologická chemie bude nejen do velké míry využívat přírodních enzymů jako činidel, ale rovněž bude schopna připravovat syntetické fermenty pro její vlastní potřeby. | “ |
| — Emil Fischer v projevu před Švédskou akademií, 19. prosince 1902 | ||
[18][19]Dále Fischer využil své výsledky z výzkumu cukrů a purinů a pracoval na poli nukleosidů. Tato práce vedla v roce 1914 k popsání přípravy několika nukleosidů[20]. Ačkoliv Fischer nebyl schopen úspěšně provést fosforylaci získaných nukleosidů na nukleotidy, jeho poznatky o nukleových kyselinách byly na jeho dobu velmi působivé. V Berlíně rovněž Fischer vypracoval oxazolovou syntézu[21] a vylepšil kysele katalyzovanou esterifikaci, která je nyní známa jako Fischerova-Speierova esterifikace[22].
V dalším výzkumu se Fischer zabýval chemií aminokyselin a peptidů. Detailně se zabýval enzymy (formuloval teorii zámku a klíče[23]) a rovněž vysvětlil stereochemické aspekty Waldenova zvratu[24].
První světová válka[editovat | editovat zdroj]

Po obdržení Nobelovy ceny Fischer využíval svoje renomé a angažoval se v chemickém průmyslu a podpoře přírodních věd. Díky jeho skvělým organizačním schopnostem a systematickému přísupu měl velký vliv na vládu, představitele akademické obce a průmyslu.[25]
V roce 1911 se podílel na založení Kaiser Wilhelm Gesellschaft zur Förderung der Wissenschaften, dnes Max Planck Gesellschaft.[26] V říjnu roku 1912 byl za přítomnosti německého císaře Viléma II. v Berlíně otevřen Kaiser Wilhelm Institut für Chemie jako první ústav této nově vzniklé instituce, na jehož stavbu a vznik Fischer od roku 1900 dohlížel.
Na tomto Berlínském ústavu, který od jeho vzniku Emil Fischer vedl, pracovali například Otto Diels (Nobelova cena 1950, Diels-Alderova reakce), Hans Fischer (Nobelova cena 1930, syntéza porfyrinu), Otto Warburg (Nobelova cena 1931, enzymy dýchacího řetězce), Adolf Windaus (Nobelova cena 1928, vitamin D), Karl Landsteiner (Nobelova cena 1930 za medicínu, krevní skupiny) nebo Geza Zemplén (transesterifikace).
Fischer se aktivně zajímal i o ostatní odvětví přírodních věd a rovněž se později podílel na vzniku Institut für Physikalische Chemie und Elektrochemie v Berlíně a Kaiser Wilhelm Institut für Kohlenforschung v Mülheimu.
Jako vedoucí laboratoří na Univerzitě v Berlíně rozpoznal potenciál radioaktivity jako nového perspektivního oboru a založil radiochemickou laboratoř, do které pozval dva mladé radiochemiky Otto Hahna a Lise Meitner, kteří pracovali na štěpení uranu, což vedlo později po Fischerově smrti až k vývoji atomové bomby.

Po vypuknutí 1. světové války Emil Fischer výrazně omezil své výzkumné aktivity a napnul své síly do organizace německého chemického průmyslu. Za války byly suroviny pro chemický průmysl nedostatkovým zbožím a Fischer pomáhal s plánováním chemické výroby. Jeho snahou bylo pomoci své vlasti v časech nouze, navzdory ideologické a politické propasti udržoval i během války přátelství s anglickým chemikem Williamem Ramsaym, který stál “na druhé straně barikády”.[27] Je známo, že Fischer vedl vývoj syntetické cesty k dusičnanu draselnému a kyselině dusičné, které se používali k výrobě výbušnin. Fischer se rovněž podílel na výzkumu a výrobě syntetických hnojiv pro zlepšení válkou ochromené zemědělské produkce. Vedl rovněž výrobu pyritu, který sloužil jako zdroj síry pro výrobu výbušnin a kafru, který se v té době používal ve směsi střelného prachu.
Fischer sám se na sklonku své kariery zabýval poslední třídou přírodních produktů, tedy lipidy[28]. Jeho výzkum byl však problematický kvůli postupující první světové válce. Fischer ztratil ve válce nejmladší dva ze svých tří synů, když Alfred (1894-1917) zahynul na bojišti na tyfus a Walter (1891-1915) spáchal sebevraždu v důsledku povinného vojenského výcviku, což jen zvýšilo Fischerův smutek v těžké době[29]. Trpěl rovněž rakovinou trávicího traktu, která byla pravděpodobně vyvolána chronickou otravou fenylhydrazinem[30], a častými ataky gastritidy, kterou trpěl již od mládí. Hrůzy válečné doby zanechaly na Fischerovi negativní stopy, roku 1917 napsal v dopise příteli:
| „ | Moderní válka je ve všech ohledech tak děsivá, že vědci mohou jen litovat, že čerpá svoji hrozivou sílu z pokroku vědy. Doufám, že probíhající válka naučí lid Evropy trvalou lekci a vynese k moci přátele míru. | “ |
| — Emil Fischer, Hermann Emil Fischer: Life and Achievements | ||
Moderní válka je ve všech ohledech tak děsivá, že vědci mohou jen litovat, že čerpá svoji hrozivou sílu z pokroku vědy. Doufám, že probíhající válka naučí lid Evropy trvalou lekci a vynese k moci přátele míru.Autor, Dílo, Zdroj

Na přelomu let 1917 a 1918 byl Fischer postižen pneumonií a zhoršující se gastritidou[31] a musel podstoupit léčení v Locarnu a Karlových Varech. V průběhu tohoto léčebného pobytu začal pracovat na své autobiografii Aus meinem Leben.
Po zotavení pracoval dále ve svém ústavu v Berlíně. 11. července 1919 postihl Fischera závažný záchvat horeček a bolesti, který byl diagnostikován jako důsledek postupucíjí rakoviny trávicího traktu. Emil Fischer ukončil svůj život vlastním rozhodnutím v noci 15. července 1919 v Berlíně ve věku 66 let.[29][32]
Je pro jeho život typické, že před svou smrtí vše patřičně zaopatřil, když pár dní předtím odeslal své poslední dva články zaobírající se cukry[33][34] a ráno v den smrti sepsal závěť, v které odkazuje podstatnou část svého jmění (750 000 marek) na výzkumné granty pro mladé německé přírodovědce. Fischer byl pochován na hřbitově Wannsee v Berlíně.
Odkaz[editovat | editovat zdroj]

Fischerův nejstarší syn Hermann Otto Laurenz Fischer (1888-1960) navázal na mimořádnou vědeckou dráhu svého otce a stal se profesorem biochemie na University of California v Berkeley. 9. října 1952 věnoval svému otci Knihovnu Emila Fischera, kde jsou dodnes uloženy všechny původní Fischerovy články, rukopis jeho autobiografie a sebraná korespondence.[35]
Po Fischerově smrti roku 1919 zavedla Německá chemická společnost Pamětní medaili Emila Fischera, udělovanou za vynikající přínos na poli organické chemie.
Emil Fischer byl za svého života jmenován členem Pruské Geheimrat a směl být nazýván titulem Excellenz, byl držitelem čestných doktorátů univerzit v Kodani, Cambridge, Manchesteru a Bruselu. V roce 1899 byl zvolen jako zahraniční člen do britské Královské Společnosti.[36] Byl také držitelem Záslužného řádu pruské koruny a Bavorského Maxmiliánova Řádu Vědy a Umění (Bayerischer Maximiliansorden für Wissenschaft und Kunst). V roce 1902 získal Nobelovu cenu za chemii.
V Berlíně na náměstí Rudolfa Kocha má Emil Fischer pomník. V rodném Euskirchenu je po něm pojmenováno gymnázium, které navštěvoval, a ve městech Berlín, Euskirchen, Leverkusen, Erlangen, Würzburg, Leuna, Krefeld, a mnoha dalších je po něm pojmenována ulice.
Dílo[editovat | editovat zdroj]
Objev hydrazinů, 1875[editovat | editovat zdroj]
Emil Fischer učinil svůj první důležitý objev, když radil studentovi s diazotací benzidinu. Reakcí benzidinu s dusičnou kyselinu student pokaždé obdržel pouze směs produktu s nečistotami. Fischer se pokusil o reakci sám a pro potlačení oxidačních účinků dusičné kyseliny přidal do reakce siřičitan sodný, načež si všiml sraženiny, která se tím v reakční směsi vytvořila.(“Emil Fischer. Sein Leben und sein Werk.”: K. Hoesch, Ber. Dtsch. Chem. Ges. 1921, 54, 206. (Special issue.)). Po opakování reakce s anilinem Fischer přes fenyldiazoniovou sůl dospěl reakcí se siřičitanem draselným k fenylhydrazinu.[4] Objevil tím zcela novou skupinu látek, pro kterou navrhl označení hydraziny. Později ve stejném roce Fischer popsal i přípravu 1,1-disubstituovaných hydrazinů.[37]

Objasnění struktury rosanilinových barviv, 1878[editovat | editovat zdroj]
Roku 1872 získal August Wilhelm von Hofmann redukcí p-toluidinu, o-toluidinu a anilinu nitrobenzenem směs barviv, které označil jako rosanilinová barviva a jejich strukturu navrhl jako podobnou azosloučeninám.[38] Emil Fischer spolu se svým bratrancem Otto Fischerem roku 1878 demonstrovali, že tento postulát je chybný a označili rosanilinová barviva za deriváty trifenylmethanu.[1] Toto správné zařazení potvrdili syntézou pararosalinu z trifenylmethanu jeho nitrací a následnou redukcí zinkem v octové kyselině. Jednalo se ve své době o odvážný kousek a oba mladí Fischerové dokázali obhájit správnost svého zařazení na úkor váženého A. W. von Hofmanna, čímž povážlivě zvýšili svou reputaci.

Syntéza indolu, 1883[editovat | editovat zdroj]
Při podrobném zkoumání chování hydrazinů Fischer se svým spolupracovníkem Friedrichem Jourdanem narazili na reakci (p-methylfenyl)hydrazinu s pyrohroznovou kyselinou. Další práce na tomto tématu vedla k popsání první syntézy indolu[39], která položila základ chemie N-heterocyklů.

Průběh reakce nebyl zprvu objasněn. Fischer si pouze povšiml velmi zajímavého chování produktu reakce hydrazinu s pyrohroznovou kyselinou (v hranatých závorkách). Až o rok později Fischer identifikoval meziprodukt reakce jako indol-karboxylovou kyselinu, která po zahřátí dekarboxyluje za vzniku methylindolu.[40] Přesný mechanismus byl popsán až v roce 1965.[41][42] Fischer rovněž zkoumal reakce hydrazinů s různými aldehydy a ketony[43], čímž dospěl k celé řadě purinových derivátů včetně....
Its behavior towards acids is quite remarkable. If the same is warmed in 10 %hydrochloric acid it turns reddish-yellow and goes into solution. On stronger heating the coloration disappears and fine, colorless needles separate... A noticeable amount of ammonia is present in the acid liquid... This process is so remarkable that for the time being we dare not venture an explanation for the reaction.
Objevení osazonů monosacharidů, 1884[editovat | editovat zdroj]
V roce 1884 popsal Emil Fischer reakci fenylhydrazinu s cukry[44], kterou vznikají látky s vynikajícími krystalizačními vlastnostmi - osazony. Fischer nejdříve popsal osazony odvozené od glukosy (tehdy zvaná dextrosa), fruktosy (tehdy zvaná levulosa), galaktosy, maltosy a sorbosy. Důležité bylo jeho zjištění, že glukosa, fruktosa a mannosa poskytují stejné osazony, a liší se tedy pouze konfigurací na prvních dvou uhlíkách řetězce. Toto zjištění započalo Fischerův průlomový výzkum stereochemie cukrů.
Objasnění struktury a konfigurace monosacharidů, 1884-1894[editovat | editovat zdroj]

Při své nejslavnější práci Fischer vyšel z teorie tetrahedrálního uspořádání atomu uhlíku[45] formulované van´t Hoffem[46][47] a Le Belem[48] v letech 1874-77, která umožnila jednoduše popsat isomerii na jednotlivých chirálních centrech. Aldehydická struktura monosacharidů byla již navržena dříve a Fischer potvrdil tuto hypotézu, když izoloval cukerný osazon vzniklý reakcí formaldehydu s vápenou vodou a následnou reakcí vzniklé směsi s fenylhydrazinem.[49] Prvotní syntézy cukrů Fischer prováděl s Juliem Tafelem. Tito dva mezi jiným provedli oxidaci glycerolu bromem, čímž získali směs dihydroxyacetonu a glyceraldehydu, kterou dále ponechali reagovat v přítomnosti 1% roztoku NaOH. Takto byly získány dvě isomerní hexosy, které Fischer izoloval ve formě osazonů a nazval je α a β-akrosa.[50] Ve skutečnosti se jednalo o fruktosu a sorbosu, což brzy Fischer zjistil.
Fischer dále zjistil, že oxidací D-mannosy vzniká lakton kyseliny mannonové, který byl již dříve získán[51] Kilianim reakcí L-arabinosy s HCN (Kilianiho syntéza).
V dalších letech Fischer provedl průlomový výzkum[52][53], ve kterém objasnil stereochemické vztahy mezi známými hexosami a popsal konfiguraci D- a L-mannosy, mannitolu, glucosy a fructosy. Během několika dalších let určil konfiguraci téměř všech hexos a některých pentos (arabinosy a xylosy) (E. Fischer
Ber. Dtsch. Chem. Ges., 1894).
Fischer při tom využíval zejména reakce cukrů s fenylhydrazinem, redukce kovy, oxidace a prodlužování řetězce adicí CN aniontu (Kilianiho-Fischerova syntéza), ale také zavedl nové metody jako například separace enantiomerů ve formě solí strychninu nebo morfinu, nebo enantioselektivní enzymové reakce[54].
Touto prací Emil Fischer zavedl nomenklaturu monosacharidů, když správně usoudil, že směr optické rotace není určující pro zařazení monosacharidů do skupin a zavedl používání konfiguračních symbolů D a L pouze na základě prostorové orientace molekuly. Byl si dobře vědom, že přiřazení symbolu D molekule s hydroxylem na C-5 směřujícím doprava je pravda pouze s 50% pravděpodobností. Jeho náhodné přiřazení bylo naštěstí později potvrzeno jako správné popsáním absolutní konfigurace D-glukosy (Bijvoet, 1951).
Fischer dále představil dělení monosacharidů podle počtu uhlíků a rovněž zavedl způsob zobrazování monosacharidů a jiných centrochirálních molekul, který je používán dodnes pod označením Fischerova projekce[55][56].
citát:
It seems to me that organic synthesis which, thanks to the splendid methods which we inherited from the old masters, has, within the short period of sixty-two years, furnished : urea, the fats, many acids, bases and colors of the vegetable class, finally uric acid and sugars, need not shrink before any product of the living organism."
Emil Fischer, 1890
navazal na Tollense a Kilianiho
Model zámku a klíče, 1894-5[editovat | editovat zdroj]
V roce 1894 si Fischer všiml, že methyl-α-D-glukosidy a methyl-β-D-glukosidy vykazují zajímavé vlastnosti při reakci s enzymy. Některé α-glukosidy jsou štěpeny invertinem izolovaným z kvasinek[57] a například β-glukosid amygdalin je hydrolyzován emulsinem z mandlí[58]. Naopak při záměně enzymů k hydrolýze nedochází. To přivedlo Fischera na myšlenku enzymové specifity, kterou popsal jako zámek, který může být otevřen jen vhodným klíčem. Tato hypotéza, známá jako model zámku a klíče, je dodnes považována za základ popisu substrátové specifity enzymů.
Esterifikace, 1895[editovat | editovat zdroj]
dd[59]
Syntéza peptidů, 1902[editovat | editovat zdroj]
Blbosti[editovat | editovat zdroj]
http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1902/fischer-bio.html http://www.britannica.com/biography/Emil-Fischer http://www.madehow.com/inventorbios/33/Emil-Hermann-Fischer.html http://pdf.oac.cdlib.org/pdf/berkeley/bancroft/m71_95_cubanc.pdf http://www.oac.cdlib.org/findaid/ark:/13030/tf6000053v/ http://www.ias.ac.in/resonance/Volumes/16/07/0606-0618.pdf http://www.chemistryexplained.com/Fe-Ge/Fischer-Emil-Hermann.html https://archive.org/stream/ausmeinemleben00fiscuoft#page/6/mode/2up - Emil Fischer. Aus meinem Leben. Berlin: Julius Springer. 1922. 201pp.
Kurt Hoesch. Emil Fischer: sein Leben und sein Werk (His Life and Work). Berlin: G.m.b.H.. 1921. 480pp.
odkazy 21.7.15:
http://link.springer.com/article/10.1007/s12045-011-0068-2
http://onlinelibrary.wiley.com/doi/10.1002/1521-3773(20021202)41:23%3C4439::AID-ANIE4439%3E3.0.CO;2-6/abstract
http://onlinelibrary.wiley.com/doi/10.1002/ange.19530650202/abstract
http://onlinelibrary.wiley.com/doi/10.1002/1099-0690(200212)2002:24%3C4095::AID-EJOC4095%3E3.0.CO;2-2/abstract
http://onlinelibrary.wiley.com/doi/10.1002/1521-3781(200212)36:6%3C390::AID-CIUZ390%3E3.0.CO;2-N/abstract
http://onlinelibrary.wiley.com/doi/10.1002/anie.199423641/abstract
http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1902/fischer-bio.html
http://pubs.acs.org/action/doSearch?text1=emil+fischer&field1=AllField&type=within&publication=346464552
http://pubs.acs.org/doi/pdf/10.1021/ed005p36
http://pubs.acs.org/doi/pdf/10.1021/ed054p295
http://pubs.acs.org/doi/pdf/10.1021/ed056p107
http://pubs.acs.org/doi/pdf/10.1021/ed066p394
http://pubs.acs.org/doi/pdf/10.1021/ed067p93
http://pubs.acs.org/doi/pdf/10.1021/ed061p504
http://pubs.rsc.org/en/content/articlepdf/1920/ct/ct9201701157
http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1902/fischer-lecture.pdf
dobovy clanky o fischerovy co vysly po jeho smrti:
Berichte der Deutschen Chemischen Gesellschaft (Vol. 54, 1921)
Naturwrssenschaften (Vol. 7, No. 46, November 14, 1919)
L. Knorr, “Über die wissenschaftlichen Arbeiten und die Persönlichkeit Emil Fischers”, Ber. Dtsch. Chem. Ges. 1919, 52, 132−149[editovat | editovat zdroj]
M. O. Forster, “Emil Fischer Memorial Lecture”, J. Chem. Soc. 1920, 117, 1157−1202
Dobry biografie:[editovat | editovat zdroj]
Nagendrappa, G., Hermann Emil Fischer: Life and achievements. Resonance 2011, 16 (7), 606-618.
Emil Fischer–Unequalled Classicist, Master of Organic Chemistry Research, and Inspired Trailblazer of Biological Chemistry
Emil Fischer, His Personality, His Achievements, and His Scientific Progeny
EMIL FISCHER LUDWIG DARMSTAE
http://www.madehow.com/inventorbios/33/Emil-Hermann-Fischer.html
http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1902/fischer-bio.html
citáty:
‘‘You are urgently warned against allowing yourself to be
influenced in any way by theories or by other preconceived
notions in the observation of phenomena, the performance of
analyses, and other determinations.’’
M. Bergmann, “Emil Fischer”, in Das Buch der Großen Chemiker (Ed.: G. Bugge), Verlag Chemie, 1930, vol. 2, pp. 408−420[editovat | editovat zdroj]
I have again taken up experiments on the reduction of
diazo compounds. ... I arrived at a class of well-characterized
bases, for which I propose the name hydrazine compounds.’’
E. Fischer, “Ueber aromatische Hydrazinverbindungen”, Ber. Dtsch. Chem. Ges. 1875, 8, 589−599[editovat | editovat zdroj]
Emil fischer centre: http://www.efc.uni-erlangen.de/index.shtml


Reference[editovat | editovat zdroj]
- ↑ a b Fischer, E.; Fischer, O., Ueber Triphenylmethan und Rosanilin. Justus Liebigs Annalen der Chemie 1878, 194 (2-3), 242-303.
- ↑ a b Emil Fischer. Aus meinem Leben. Berlin: Julius Springer. 1922. 201pp.
- ↑ K. Hoesch Ber. Dtsch. Chem. Ges., 1921
- ↑ a b Fischer, E., Ueber aromatische Hydrazinverbindungen. Berichte der deutschen chemischen Gesellschaft 1875, 8 (1), 589-594.
- ↑ Kauffman, G. B.; Ciula, R. P., Emil Fischer's discovery of phenylhydrazine. J. Chem. Educ. 1977, 54 (5), 295.
- ↑ Koenigs, W.; Knorr, E., Ueber einige Derivate des Traubenzuckers und der Galactose. Berichte der deutschen chemischen Gesellschaft 1901, 34 (1), 957-981.
- ↑ E. Fischer, F. Jourdan Ber. Dtsch. Chem. Ges., 1883
- ↑ Roussel, P. A., The Fischer indole synthesis. J. Chem. Educ. 1953, 30 (3), 122.
- ↑ Fischer, E., Synthese von Indolderivaten. Berichte der deutschen chemischen Gesellschaft 1886, 19 (1), 1563-1570.
- ↑ Knorr, L., Einwirkung von Acetessigester auf Phenylhydrazin. Berichte der deutschen chemischen Gesellschaft 1883, 16 (2), 2597-2599.
- ↑ Fischer, E., Ueber Caffeïn, Theobromin, Xanthin und Guanin. Justus Liebigs Annalen der Chemie 1882, 215 (3), 253-320.
- ↑ Helferich, B., Emil Fischer zum 100. Geburtstag. Angew. Chem. 1953, 65 (2), 45-52.
- ↑ M. O. Forster, “Emil Fischer Memorial Lecture”, J. Chem. Soc. 1920, 117, 1157−1202
- ↑ Fischer, E.; Ach, L., Synthese des Caffeïns. Berichte der deutschen chemischen Gesellschaft 1895, 28 (3), 3135-3143.
- ↑ Fischer, E.; Dilthey, A., Ueber C-Dialkylbarbitursäuren und über die Ureïde der Dialkylessigsäuren. Justus Liebigs Annalen der Chemie 1904, 335 (3), 334-368.
- ↑ Fischer, E., Ueber die Verbindungen der Zucker mit den Alkoholen und Ketonen. Berichte der deutschen chemischen Gesellschaft 1895, 28 (1), 1145-1167.
- ↑ Fischer, E., Verbindungen der mehrwerthigen Alkohole mit den Ketonen. Berichte der deutschen chemischen Gesellschaft 1895, 28 (1), 1167-1170.
- ↑ http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1902/fischer-lecture.pdf
- ↑ Originál: Of the chemical aids in the living organism the ferments - mostly referred to nowadays as enzymes - are so pre-eminent that they may justifiably be claimed to be involved in most of the chemical transformations in the living cell. The examination of the synthetic glucosides has shown that the action of the enzymes depends to a large extent on the geometrical structure of the molecule to be attacked, that the two must match like lock and key. Consequently, with their aid, the organism is capable of performing highly specific chemical transformations which can never be accomplished with the customary agents. To equal Nature here, the same means have to be applied, and I therefore foresee the day when physiological chemistry will not only make extensive use of the natural enzymes as agents, but when it will also prepare synthetic ferments for its purposes.
- ↑ Fischer, E.; Helferich, B., Synthetische Glucoside der Purine. Berichte der deutschen chemischen Gesellschaft 1914, 47 (1), 210-235.
- ↑ Fischer, E., Neue Bildungsweise der Oxazole. Berichte der deutschen chemischen Gesellschaft 1896, 29 (1), 205-214.
- ↑ Fischer, E.; Speier, A., Darstellung der Ester. Berichte der deutschen chemischen Gesellschaft 1895, 28 (3), 3252-3258.
- ↑ Lichtenthaler, F. W., 100 Years “Schlüssel-Schloss-Prinzip”: What Made Emil Fischer Use this Analogy? Angewandte Chemie International Edition in English 1995, 33 (23-24), 2364-2374.
- ↑ Fischer, E.; v. Mechel, L., Bildung aktiver, sekundärer Aminosäuren aus Halogensäuren und primären Aminen. Berichte der deutschen chemischen Gesellschaft 1916, 49 (1), 1355-1366.
- ↑ Kauffman, G. B., Emil Fischer: His role in Wilhelmian German industry, scientific institutions, and government. J. Chem. Educ. 1984, 61 (6), 504.
- ↑ Kauffman, G. B.; Priebe, P. M., Emil Fischer's role in the founding of the Kaiser Wilhelm Society. J. Chem. Educ. 1989, 66 (5), 394.
- ↑ Kauffman, G. B.; Priebe, P. M., The Emil Fischer-William Ramsay friendship: The tragedy of scientists in war. J. Chem. Educ. 1990, 67 (2), 93.
- ↑ Fischer, E.; Rund, C., Teilweise Acylierung der mehrwertigen Alkohole und Zucker. II. Berichte der deutschen chemischen Gesellschaft 1916, 49 (1), 88-105.
- ↑ a b Lichtenthaler, F. W., Emil Fischer, His Personality, His Achievements, and His Scientific Progeny. Eur. J. Org. Chem. 2002, 2002 (24), 4095-4122.
- ↑ L. Lewin, “Eine toxikologische Erinnerung an Emil Fischer”, Naturwissenschaften 1919, 7, 878−884.
- ↑ G. Klemperer, Dopis Carlu Duisbergovi, 28. ledna 1920, Bayer Archiv, Leverkusen
- ↑ Darmstaedter, L., Emil Fischer. J. Chem. Educ. 1928, 5 (1), 36.
- ↑ E. Fischer, “Einfluß der Struktur der β-Glukoside auf die Wirkung des Emulsins”, Hoppe-Seyler’s Z. Physiol. Chem. 1919, 107, 176−202
- ↑ E. Fischer, “Über Allyl-β-glucosid, Hoppe-Seyler’s Z. Physiol. Chem. 1919, 108, 3−8
- ↑ http://www.oac.cdlib.org/findaid/ark:/13030/tf6000053v/
- ↑ https://web.archive.org/web/20150320215814/https://royalsociety.org/about-us/fellowship/foreign-members/ - zkontroluj!!!!
- ↑ Fischer, E., Ueber die Hydrazinverbindungen der Fettreihe. Berichte der deutschen chemischen Gesellschaft 1875, 8 (2), 1587-1590.
- ↑ Hofmann, A. W.; Geyger, A., Ueber einige von den aromatischen Azodiaminen abstammende Farbstoffe. Berichte der deutschen chemischen Gesellschaft 1872, 5 (1), 472-476.
- ↑ Fischer, E.; Jourdan, F., Ueber die Hydrazine der Brenztraubensäure. Berichte der deutschen chemischen Gesellschaft 1883, 16 (2), 2241-2245.
- ↑ Fischer, E.; Hess, O., Synthese von Indolderivaten. Berichte der deutschen chemischen Gesellschaft 1884, 17 (1), 559-568.
- ↑ Hoffmann, R.; Woodward, R. B., Orbital Symmetries and endo-exo Relationships in Concerted Cycloaddition Reactions. J. Am. Chem. Soc. 1965, 87 (19), 4388-4389.
- ↑ Hoffmann, R.; Woodward, R. B., Orbital Symmetries and Orientational Effects in a Sigmatropic Reaction. J. Am. Chem. Soc. 1965, 87 (19), 4389-4390.
- ↑ Fischer, E., Phenylhydrazin als Reagens auf Aldehyde und Ketone. Berichte der deutschen chemischen Gesellschaft 1884, 17 (1), 572-578.
- ↑ Fischer, E., Verbindungen des Phenylhydrazins mit den Zuckerarten. Berichte der deutschen chemischen Gesellschaft 1884, 17 (1), 579-584.
- ↑ H. A. M, S., J. A. Le Bel's Stereochemical Ideas Compared with Those of J. H. van't Hoff (1874). In van't Hoff-Le Bel Centennial, AMERICAN CHEMICAL SOCIETY: 1975; Vol. 12, pp 66-73.
- ↑ Hoff, Jacobus H. van 't: Die Lagerung der Atome im Raume. Übers. v. F. Herrmann. Braunschweig, 1877. Dostupné online. Anglický překlad
- ↑ Meijer, E. W., Jacobus Henricus van 't Hoff; Hundred Years of Impact on Stereochemistry in the Netherlands. Angew. Chem. Int. Ed. 2001, 40 (20), 3783-3789.
- ↑ Joseph Achille LeBel Bull. soc. chim. (November 1874), volume 22, pages 337-347 Dostupné online.
- ↑ E. Fischer, F. Passmore, Ber. Dtsch. Chem. Ges., 1889
- ↑ Fischer, E.; Tafel, J., Synthetische Versuche in der Zuckergruppe. Berichte der deutschen chemischen Gesellschaft 1887, 20 (2), 2566-2575.
- ↑ Kiliani, H., Ueber Arabinose. Berichte der deutschen chemischen Gesellschaft 1886, 19 (2), 3029-3036.
- ↑ Fischer, E., Synthese der Mannose und Lävulose. Berichte der deutschen chemischen Gesellschaft 1890, 23 (1), 370-394.
- ↑ Fischer, E., Synthese des Traubenzuckers. Berichte der deutschen chemischen Gesellschaft 1890, 23 (1), 799-805.
- ↑ Fischer, E.; Lindner, P., Ueber die Enzyme einiger Hefen. Berichte der deutschen chemischen Gesellschaft 1895, 28 (3), 3034-3039.
- ↑ Fischer, E., Ueber die Configuration des Traubenzuckers und seiner Isomeren. Berichte der deutschen chemischen Gesellschaft 1891, 24 (1), 1836-1845.
- ↑ Fischer, E., Ueber die Configuration des Traubenzuckers und seiner Isomeren. II. Berichte der deutschen chemischen Gesellschaft 1891, 24 (2), 2683-2687.
- ↑ Fischer, E., Ueber den Einfluss der Konfiguration auf die Wirkung der Enzyme III. Berichte der deutschen chemischen Gesellschaft 1895, 28 (2), 1429-1438.
- ↑ Fischer, E., Ueber ein neues dem Amygdalin ähnliches Glucosid. Berichte der deutschen chemischen Gesellschaft 1895, 28 (2), 1508-1511.
- ↑ Fischer, E.; Speier, A., Darstellung der Ester. Berichte der deutschen chemischen Gesellschaft 1895, 28 (3), 3252-3258.
Literatura[editovat | editovat zdroj]
- Emil Fischer. Aus meinem Leben. Berlin: Julius Springer. 1922. 201pp.
- Kurt Hoesch. Emil Fischer: sein Leben und sein Werk (His Life and Work). Berlin: G.m.b.H.. 1921. 480pp.
 Obrázky, zvuky či videa k tématu Choutkaj/Pískoviště na Wikimedia Commons
Obrázky, zvuky či videa k tématu Choutkaj/Pískoviště na Wikimedia Commons

Monosacharidy (z řečtiny monos: jednoduchý, sacchar: cukr) jsou základní sacharidy, které již nelze dále dělit na jednodušší. Jsou základní stavební jednotkou všech složitějších sacharidů - oligosacharidů a polysacharidů. Monosacharidy jsou typicky krystalické látky dobře rozpustné ve vodě a v polárních rozpouštědlech. Monosacharidy jsou chirální sloučeniny, to znamená, že jsou opticky aktivní a stáčejí rovinu rovinně polarizovaného světla.
Monosacharidy s aldehydovou skupinou se nazývají aldosy, s ketoskupinou ketosy. Podle počtu uhlíků je dělíme na triosy, tetrosy, pentosy a hexosy. Shoda konfigurace na posledním chirálním uhlíku s konfigurací D- nebo L-glyceraldehydu určuje příslušnost monosacharidu do konfigurační řady D nebo L. Názvosloví monosacharidů se tvoří pomocí konfiguračních přepon, které označují relativní konfiguraci na chirálních centrech molekuly.
V roztoku existují převážně v cyklických formách, přičemž formy s pětičlenným kruhem označujeme jako furanosy. Šestičlenné kruhy nazýváme pyranosy. Při uzavření cyklické formy dochází k vzniku dvou anomerů, které rozlišujeme za pomoci anomerních konfiguračních symbolů α a β. Pyranosy se v roztoku nejčastěji vyskytují v židličkových konformacích, furanosy jsou konformačně flexibilnější a preferují obálkové konformace.
Monosacharidy bývají obecně ne zcela přesně nazývány cukry, jako cukry však označujeme jen sacharidy sladké chuti, tedy i většinu monosacharidů. Monosacharidy hrají důležitou roli v primárním i sekundárním metabolismu, vznikají v zelených rostlinách v procesu fotosyntézy a v organické syntéze slouží jako zásobárna chirálních sloučenin.
O rozvoj chemie monosacharidů se výrazně zasloužil německý chemik Hermann Emil Fischer (1852-1919), který uskutečnil první totální syntézu D-glukosy z formaldehydu[1] a zavedl základní nomenklaturu sacharidů[2]. Z českých chemiků se v chemii sacharidů nejvíce realizoval Emil Votoček[3][4] (1872-1950).
Struktura a názvosloví[editovat | editovat zdroj]
Monosacharidy lze chemicky definovat jako polyhydroxyderiváty karbonylových sloučenin (aldehydů nebo ketonů).[5] To znamená, že v jejich molekule je přítomna karbonylová skupina a zároveň jedna nebo více skupin hydroxylových. Monosacharidy obsahující karbonyl ve formě aldehydové skupiny jsou aldosy, zatímco monosacharidy s ketoskupinou se nazývají ketosy. Podle počtu uhlíků v řetězci dělíme monosacharidy na triosy, tetrosy, pentosy, hexosy a heptosy. Tyto dvě hlediska můžeme uplatnit při tvorbě obecného názvu skupiny monosacharidů, např. aldehydické monosacharidy se 6 atomy uhlíku se nazývají aldohexosy, ketonické monosacharidy se 4 atomy uhlíku jsou ketotetrosy.
| Dělení monosacharidů | |
|---|---|
| podle formy | podle počtu uhlíků |
| aldosy | triosy |
| ketosy | tetrosy |
| pentosy | |
| hexosy | |
| heptosy | |
| oktosy | |
Zařazení do D- a L-řady[editovat | editovat zdroj]
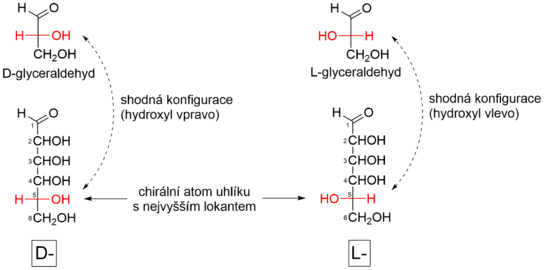
Příslušnost monosacharidů do D- nebo L-řady je určena shodou konfigurace na konfiguračním atomu monosacharidu (chirální atom uhlíku s nejvyšším lokantem) s konfigurací chirálního atomu uhlíku D- nebo L-glyceraldehydu.[5][6] Zařazení do konfigurační řady závisí tedy pouze na konfiguraci na chirálním uhlíku s nejvyšším lokantem a konfigurace na ostatních chirálních centrech je lhostejná. Monosacharidy číslujeme tak, aby u aldos měl uhlík karbonylové skupiny vždy lokant 1, u ketos musí být lokant tohoto uhlíku co možná nejnižší.[7] Například u aldohexos zařadíme monosacharid do D- nebo L-řady tak, že porovnáme konfiguraci na atomu C-5 s konfigurací chirálního atomu uhlíku D- nebo L-glyceraldehydu. Je-li konfigurace na C-5 shodná s konfigurací D-glyceraldehydu (hydroxyl na C-5 směřuje ve Fischerově projekci doprava), jedná se o sacharid řady D (dexter = napravo). Shoduje-li se naopak s konfigurací L-glyceraldehydu (hydroxyl na C-5 směřuje ve Fischerově projekci doleva), zařadíme sacharid do konfigurační řady L (laevo = nalevo). Analogicky postupujeme u jakéhokoliv monosacharidu. Konfigurační symboly D a L píšeme malou kapitálkou.
Postup pro zařazení monosacharidu do konfigurační řady:
- Zakreslení monosacharidu ve Fischerově projekci a správné očíslování.
- Nalezení konfiguračního atomu (chirální atom uhlíku s nejvyšším lokantem).
- Směřuje-li hydroxylová skupina na konfiguračním atomu doprava, jedná se o řadu D. Směřuje-li doleva, jedná se o řadu L.
Konfigurační předpony[editovat | editovat zdroj]
Názvosloví monosacharidů je odvozeno od otevřených (acyklických) forem monosacharidů promítnutých ve Fischerově projekci a jeho základem jsou tzv. konfigurační předpony.[6] Tyto předpony popisují vzájemné postavení (relativní konfiguraci) dvou a více hydroxylových skupin v molekule. Spolu s konfiguračním symbolem D nebo L lze pak definovat absolutní konfiguraci daného monosacharidu. Konfigurační předpony aldos jsou odvozeny od glyceraldehydu postupným přidáváním dalšího asymetrického uhlíku. Každým dalším přidaným "patrem" vzniká řada monosacharidů o jeden uhlík delší, přičemž z každého monosacharidu vznikají vždy dvě prodloužené aldosy lišící se konfigurací na nově přidaném chirálním centru. Tímto způsobem lze dospět až k osmi aldohexosám v jedné konfigurační řadě, název delších monosacharidů (7 atomů uhlíku a více) je tvořen složením dvou konfiguračních předpon.[6] Na uvedeném schématu je znázorněno odvození aldos řady D až po šestičlenné monosacharidy. Řada L je odvozena analogicky, přičemž L-monosacharid lze získat z příslušného D-monosacharidu obrácením konfigurace na všech chirálních centrech. Dva monosacharidy se stejným názvem lišící se pouze konfiguračním symbolem D a L jsou navzájem enantiomery. Konfigurační předpony uvádíme kurzívou a oddělujeme spojovníkem. Systematický název monosacharidu tvoříme tedy například takto: D-gluko-hexosa, z praktických důvodů se často používají triviální názvy, např. D-glukosa, kde už kurzívu nepoužíváme.

Cyklické formy[editovat | editovat zdroj]
Ve skutečnosti se však monosacharidy málokdy vyskytují v lineárních formách. V roztoku existují převážně v cyklických formách a v krystalickém stavu se v těchto formách nacházejí zcela výlučně.[8][9] Cyklická forma monosacharidu vzniká intramolekulární reakcí jedné z hydroxylových skupin s karbonylem za tvorby hemiacetalového (v případě aldos) nebo hemiketalového (v případě ketos) uskupení. Tato reakce je zcela analogická klasické tvorbě hemiacetalu rovnovážnou reakcí alkoholu s karbonylovou sloučeninou, avšak v případě cyklizace monosacharidu reakce probíhá spontánně i bez kyselé katalýzy.[7] Při tvorbě cyklických forem monosacharidů dochází nejčastěji ke vzniku pětičlenného (tetrahydrofuranového) nebo šestičlenného (tetrahydropyranového) kruhu. Tyto struktury proto nazýváme furanosy resp. pyranosy. Jednotlivé formy monosacharidu (lineární a cyklické formy) mezi sebou mohou v roztoku přecházet procesem zvaným mutarotace.[10]

Uzavřením kruhu vzniká na uhlíku, který původně nesl karbonylovou skupinu, nové chirální centrum, které nazýváme anomerní centrum (uplatňuje se zde anomerní efekt). Dva isomery, které mohou na anomerním centru vzniknout se označují jako anomery a liší se orientací hemiacetalové (anomerní) hydroxylové skupiny.
Pro vymezení konfigurace na anomerním centru používáme anomerních konfiguračních symbolů α a β. Tyto symboly udávají relativní konfiguraci vůči anomernímu referenčnímu atomu, který je pro monosacharidy o maximálně šesti atomech uhlíku totožný s konfiguračním atomem, tedy je to chirální atom uhlíku s nejvyšším lokantem. Pro monosacharidy delší než 6 atomů uhlíku (jejich název je tvořen více než jednou konfigurační předponou) je nomenklatura složitější. Anomer α nese na anomerním centru shodnou konfiguraci jako na konfiguračním atomu, anomer β opačnou.[5][6]
Odvození Haworthova vzorce cyklické formy monosacharidu z Fischerovy projekce lineární formy se provádí pomyslným otočením Fischerovy projekce o 90 ° po směru hodinových ručiček v rovině nákresny a následným ohnutím koncových atomů řetězce za nákresnu.[11] Atom uhlíku nesoucí hydroxylovou skupinu, která atakuje karbonyl, je poté zapotřebí před uzavřením kruhu vhodně pootočit, přičemž acyklickická část se tím zorientuje pod nebo nad rovinu kruhu v závislosti na konfiguraci na tomto atomu uhlíku (nezáleží na tom, jestli se jedná o sacharid řady D nebo L). Výsledkem je, že hydroxylové skupiny, které byly ve Fischerově projekci na pravé straně řetězce jsou v cyklické formě orientovány pod rovinu kruhu a hydroxylové skupiny které byly na levé straně směřují nad rovinu kruhu. Orientace acyklické části monosacharidu v cyklické formě závisí na orientaci hydroxylu, přes který dochází k cyklizaci. Lze říci, že směřuje-li tento hydroxyl ve Fischerově projekci doprava, potom acyklická část bude směřovat v cyklické formě nad rovinu kruhu. Obsahuje-li acyklická část monosacharidu chirální centrum, pak se tato část většinou znázorňuje ve Fischerově projekci.[12] Cyklická forma monosacharidu lze znázornit v Tollensově vzorci, kde lze rozlišit způsob cyklizace a konfiguraci na anomerním centru.

Rozlišení α nebo β anomeru lze nejsnáze provést z Tollensova vzorce, kde je patrná konfigurace na anomerním centru (jedná se v podstatě o Fischerovu projekci cyklické formy). Je-li hydroxyl na anomerním centru na stejné straně řetězce jako atom kyslíku vázaný na konfigurační atom (cis uspořádání), jedná se o anomer α, jsou-li tyto skupiny uspořádány trans, označíme tento anomer jako β.[5]
Obecný postup pro rozlišení α/β anomerů pro monosacharidy do šesti uhlíků[pozn. 1]:
- Zakreslení monosacharidu do Tollensova vzorce. Hydroxylové skupiny směřující pod kruh budou vpravo a hydroxyly směřující nad kruh budou vlevo.
- Nalezení konfiguračního atomu (chirální atom uhlíku s nejvyšším lokantem). Tento atom může, ale nemusí být součástí kruhu.
- Porovnání konfigurace na konfiguračním atomu s konfigurací na anomerním centru. Je-li uspořádání cis, jedná se o α-anomer. Je-li uspořádání trans, jedná se o β-anomer.

Optická aktivita[editovat | editovat zdroj]
Kromě dihydroxyacetonu jsou monosacharidy opticky aktivní sloučeniny, obsahují alespoň jedno chirální centrum. Stáčí tedy rovinu polarizovaného světla o určitý úhel doleva (levotočivé, značíme (-)) nebo doprava (pravotočivé, (+)). Čím delší je uhlíkatý řetězec sacharidu, tím více obsahuje chirálních center. Molekula s n chirálními centry se může vyskytovat v počtu 2n optických izomerů.[6] Přitom stejné fyzikální a chemické vlastnosti mají jen ty dvojice molekul, které jsou navzájem svými zrcadlovými obrazy, tzv. enantiomery či antipody (liší se konfigurací na všech atomech uhlíku).
| Řada | D-glyceraldehyd | L-glyceraldehyd |
|---|---|---|
| Fischerova projekce | 
|

|
| Prostorové uspořádání | 
|
|
| Optická aktivita | pravotočivý (+) | levotočivý (-) |
Po vzoru glyceraldehydu dělíme všechny monosacharidy do zmíněných dvou řad. Ve Fischerově projekci se u D-řady hydroxyl na posledním chirálním centru zakresluje vždy vpravo, u L-řady pak vlevo. Většina běžně se vyskytujících přírodních monosacharidů patří do D-řady. Ačkoliv konfigurace D a L nesouvisí se skutečným směrem otáčení roviny polarizovaného světla, je většina D-monosacharidů pravotočivá (+).[13]
Dvěma enantiomerům přiřazujeme stejný triviální název, lišící se jen předponou D- či L-. Tak například existují čtyři (22) aldotetrosy, a to D-erythrosa, L-erythrosa, D-threosa, L-threosa. Aldopentos již existuje osm (23), aldohexos šestnáct (24). Ketos je obecně méně, protože mají méně chirálních center. Nejjednodušší ketosa je dihydroxyaceton, který neobsahuje dokonce vůbec žádné chirální centrum. Ketotetrosy jsou dvě, ketopentosy čtyři, ketohexos máme osm.
Dělení podle biochemické funkce[editovat | editovat zdroj]
Primární monosacharidy[editovat | editovat zdroj]
Mezi primární monosacharidy, tj. sacharidy, které jsou produkty primárního metabolismu ve valné většině organismů, patří kupodivu jen poměrně malý počet monosacharidů. Jsou to jednak triosy D-glyceraldehyd a dihydroxyaceton, které jsou součástí životně nezbytné glykolýzy.[14]
Z tetros se v organismech běžně vyskytuje pouze D-erythrosa, která je ve formě fosfátu meziproduktem neméně důležitého pentosového cyklu a u rostlin navíc Calvinova cyklu, který je součástí temnostní fáze fotosyntézy.
Pentosy jsou pro primární metabolismus důležité tři, a to jednak D-ribosa, složka kyseliny ribonukleové, a 2-deoxy-D-ribosa, složka kyseliny deoxyribonukleové. Kromě těchto dvou je dále důležitá D-ribulosa, jejíž deriváty jsou důležité při přeměnách sacharidů a při fotosyntéze.
A konečně - z hexos jsou důležité D-glukosa (hroznový cukr, dextrosa), hojně se vyskytující v plodech, a D-fruktosa (ovocný cukr, levulosa), k jejíž izolaci se užívá nejčastěji polysacharidu inulinu.[15] Tyto nejznámější hexosy tvoří součást glykolýzy a jsou často základní stavební jednotkou mnohých oligosacharidů, polysacharidů a glykosidů.
Sekundární monosacharidy[editovat | editovat zdroj]
Sekundární monosacharidy jsou látky, které nejsou ve většině organismů součástí základního metabolismu a jejich přítomnost tedy není pro buňku nezbytně nutná. Jsou součástí sekundárního metabolismu.[16] Význam těchto monosacharidů je velice rozmanitý - mohou tvořit součást některých polysacharidů, glykosidů či glykolipidů, aminosacharidy jsou součástí buněčné stěny bakterií, sacharidy s větveným řetězcem mohou být součástí antibiotik.[17]
Sekundární monosacharidy tvoří velice širokou skupinu látek. Řadíme sem především:
- Monosacharidy s netypickou konfigurací
Do této skupiny řadíme několik základních monosacharidů, které nejsou součástí základních metabolických drah. Patří sem i monosacharidy neobvyklé L-řady. Je to zejména L-arabinosa, D-xylosa, D-mannosa, D-galaktosa a D-gulosa.
Tyto sacharidy jsou v organismu syntetizovány zvláštní reakcí zvanou epimerizace, která je katalyzována ji enzymy ze skupiny epimeras.[18] Při epimerizaci dochází ke změně konfigurace na jediném chirálním centru, vznikají epimery (isomery lišící se konfigurací na jednom chirálním centru). Příkladem mohou být epimerizace na uhlíku C-2 a C-4 glukosy, při kterých vzniká D-mannosa a D-galaktosa.
- Deoxymonosacharidy, monosacharidy s methoxyskupinou nebo acetylovou skupinou
Deoxymonosacharidy jsou deriváty monosacharidů v kterých je hydroxylová skupina nahrazena atomem vodíku.[19] Poměrně často tyto deriváty obsahují zároveň i methoxy nebo acetylovou skupinu, tyto skupiny látek se tedy mohou prolínat. Nejrozšířenějším zástupcem je 2-deoxy-D-ribosa, která je stavebním blokem deoxyribonukleové kyseliny.
Patří sem však i další deoxymonosacharidy, jako například L-rhamnosa, L-fukosa, D-digitoxosa a 2-deoxy-D-glukosa, nebo deoxysacharid s methoxyskupinou D-cymarosa. Dalším zástupcem je acetylovaný monosacharid 3-acetyl-D-digitoxosa.
V bakteriích se vyskytují i dideoxy deriváty, které postrádají dvě hydroxylové skupiny, například paratosa, abekvosa, askarylosa, tyvelosa, nebo amicetosa.[6]
- Aminosacharidy
Aminosacharidy jsou monosacharidy nesoucí místo některé z hydroxylových skupin aminoskupinu. Patří sem např. D-mannosamin, D-glukosamin, nebo D-galaktosamin, který je obsažen v chondroitinsulfátu.[6]
Aminosacharidy jsou bazické látky a vyskytují se často ve formě N-acetylderivátů, které jsou v přírodě hojně zastoupeny v polysacharidech nebo některých antibioticích. Například N-acetyl-D-glukosamin je stavební jednotkou polysacharidu chitinu, ze kterého jsou tvořeny krovky hmyzu. Aminosacharidy jsou rovněž složkou mnohých glykolipidů a glykoproteinů.[20]
- Větvené monosacharidy
Některé méně typické cukry nemají základní řetězec lineární, ale mají jej větvený. Např. D-apiosa z petržele, D-hamamelosa z kůry habru nebo L-streptosa, D-kladinosa a L-mykarosa, které jsou součástí některých antibiotik. Tyto sacharidy vznikají v přírodě buď C-methylací nebo přestavbou uhlíkatého řetězce.
Význam[editovat | editovat zdroj]
Monosacharidy často mívají sladkou chuť. Za chemickou podstatou vnímání sladké chuti je možno považovat seskupení -O-CH-CH2-OH[21], které se kromě případu mnohých monosacharidů vyskytuje například i u alkoholu glycerolu, což je zřejmě příčinou jeho sladké chuti.
Rostliny často využívají monosacharidů, často i sekundárních, k lákání zvířat - např. pro zisk opylovačů nebo roznos semen. Sekundární monosacharidy jsou prekurzory karboxylových kyselin, cukerných alkoholů a glykosidů.
Monosacharidy jsou přímé produkty fotosyntézy a je v nich nahromaděna energie slunečního záření. D-glukosa je tedy pro většinu organismů primárním zdrojem energie.[14]
Metabolismus[editovat | editovat zdroj]
Z metabolického hlediska je nejdůležitějším monosacharidem D-glukosa, která slouží ve většině organismů jako zdroj energie.[14]
Hlavní metabolickou drahou rozkladu glukosy je glykolýza, ve které je glukosa oxidačně štěpena na dvě molekuly pyruvátu. Pyruvát je dále zužitkován v Krebsově cyklu a dýchacím řetězci pro tvorbu ATP. Vedlejším produktem jednoho cyklu glykolýzy jsou rovněž dvě molekuly ATP, které jsou přímo využity jako zdroj energie. Za anaerobních podmínek je glukosa metabolizována na laktát, v některých mikroorganismech (např. kvasinkách) na ethanol. Tyto anaerobní procesy se nazývají fermentace.[22]
Opačným procesem je glukoneogeneze, která slouží k biosyntéze glukosy z tříuhlíkatých sloučenin, jako například pyruvátu, laktátu, a některých aminokyselin. Ostatní monosacharidy jsou v buňce syntetizovány ve většině případů z glukosy nebo z některých meziproduktů glukoneogeneze.
Přebytečná glukosa se ukládá v organismech ve formě svých polymerů - polysacharidů. V rostlinách je hlavním zásobním polysacharidem škrob, živočichové ukládají glukosu nejčastěji ve formě glykogenu. Zelené rostliny využívají fotosyntézu k fixaci vzdušného oxidu uhličitého do molekuly glukosy pomocí enzymu RUBISCO.[23]
Další důležitou metabolickou drahou monosacharidů je pentosový cyklus, ve kterém je glukosa přeměňována na pětiuhlíkaté monosacharidy (pentosy). Nejdůležitějším produktem pentosového cyklu je ribosa, která je dále využita pro výstavbu nukleových kyselin. Vedlejším produktem je NADPH, který slouží například k syntéze mastných kyselin.
Prostorové uspořádání[editovat | editovat zdroj]

Přesné prostorové uspořádání molekuly monosacharidu se označuje jako konformace. Konformace molekuly je výsledkem sterických a elektronických interakcí, u monosacharidu je určena zejména pnutím uvnitř cukerného kruhu a orientací hydroxylových skupin. Jednotlivé konformace mohou mezi sebou přecházet pseudorotací kolem jednoduchých vazeb cukerného kruhu a v roztoku jsou vždy zastoupeny poměrně v závislosti na své stabilitě.[24]
Jednotlivé konformace značíme obvykle velkým začátečním písmenem anglického názvu psaným kurzívou a čísly nebo symboly atomů které se nacházejí pod nebo nad rovinou vymezenou zbývajícími atomy. Číslo atomu nacházející se nad touto rovinou píšeme horním indexem před symbol konformace, číslo atomu nacházející se pod touto rovinou píšeme dolním indexem za symbol konformace. Například 4C1.
Konformace pyranos[editovat | editovat zdroj]
Nejstálejší a nejčastěji se vyskytující konformací pyranosových kruhů je židličková konformace (C - chair)[25][6] u které rozlišujeme dvě formy 4C1 a 1C4. U konformace 4C1 je uhlík C-4 orientován nad rovinou určenou atomy C-2, C-3, C-5, O a uhlík C-1 se nachází pod touto rovinou. U konformace 1C4, která je méně častá, je tomu právě naopak. Preferována bude vždy ta forma židličky, ve které je co nejvíce objemných substituentů vázáno ekvatoriálně. Lze tedy říci, že například židličková konformace 4C1 je ze všech aldohexos nejvýhodnější pro D-glukosu, která má v této konformaci všechny hydroxylové skupiny vázány ekvatoriálně. Naopak jedním z mála monosacharidů, který za normálních podmínek preferuje konformaci 1C4 je D-idopyranosa. Poněkud odlišná je situace na anomerním centru, kde ekvatoriální pozice nemusí být vždy energeticky nejvýhodnější, může se zde totiž uplatňovat repulze volných elektronových párů anomerního hydroxylu a cyklického atomu kyslíku, kterou označujeme jako anomerní efekt.[26]

Pyranosové kruhy se mohou taktéž vyskytovat ve vaničkové konformaci (B - boat). Tato konformace však není za normálních podmínek příliš stabilní a vyskytuje se zřídka. Vaničková konformace spíše slouží k přechodu mezi jinými konformacemi nebo se vytváří přechodně v tranzitních stavech některých reakcí. Hlavní příčinou nestability vaničky bývá sterická repulze substituentů na protilehlých atomech uhlíku kruhu. Mezi důležité vaničkové konformace patří 1,4B, O,3B a BO,3.

Konformace furanos[editovat | editovat zdroj]
Furanosové kruhy jsou konformačně flexibilnější nežli kruhy pyranosové, což je dáno malým rozdílem v energiích jednotlivých konformací. Jednotlivé konformery tedy mohou mezi sebou snadno přecházet a v roztoku se tak i děje. Nejčastější konformací pětičlenných kruhů jsou obálkové konformace (E - envelope).[25][6] Podle atomu, který vybočuje z roviny určené ostatními atomy a směru kterým vybočuje rozlišujeme nejčastěji 2E, E2, 3E a E3 obálkové konformace, které mezi sebou mohou v roztoku snadno přecházet. Zastoupení jednotlivých konformací se pro různé monosacharidy může lišit a je závislé zejména na substituci furanosového kruhu.

Reaktivita[editovat | editovat zdroj]
Reakce na karbonylové skupině[editovat | editovat zdroj]
Redukce[editovat | editovat zdroj]
Redukcí monosacharidů vznikají tzv. cukerné alkoholy neboli alditoly.[27] Funkční karbonylová skupina (ketoskupina nebo skupina aldehydová) se redukuje na hydroxyl. Redukcí aldos vzniká 1 alditol, redukcí ketos vznikají 2 alditoly, protože přibývá jedno chirální centrum. Z některých aldos vznikají achirální cukerné alkoholy (mají rovinu symetrie). V jiných případech vzniká z více monosacharidů D- i L-řady redukcí identický alditol, a celkový počet možných alditolů je proto menší než celkový počet výchozích monosacharidů. Rozlišujeme 3 tetritoly, 4 pentitoly a pouze 10 hexitolů.

Oxidace[editovat | editovat zdroj]
Oxidací monosacharidů vznikají cukerné kyseliny.[7] Podle atomu uhlíku, který je oxidován rozlišujeme 3 základní typy cukerných kyselin:
- Aldonové kyseliny
Vznikají oxidací aldehydové skupiny v aldosach na karboxylovou funkci. Tato oxidace se využívá mimo jiné pro určení redukujících sacharidů (sacharid se oxiduje pomocí Fehlingova činidla na aldonovou kyselinu a působí tedy jako redukční činidlo). Ketosy v tomto smyslu nereagují, neboť ketoskupina nemůže být dále oxidována. Aldonové kyseliny tvoří v roztoku snadno pětičlenné nebo šestičlenné laktony intramolekulární reakcí karboxylu s jednou z hydroxylových skupin.

- Aldarové kyseliny
Aldarové kyseliny jsou dikarboxylové kyseliny odvozené od monosacharidů (aldos) oxidací aldehydové skupiny i koncové CH2OH skupiny.

- Uronové kyseliny
Uronové kyseliny vznikají dvoustupňovou oxidací koncové CH2OH skupiny na karboxyl, přičemž karbonylová skupina je zachována.

Hydrazony, osazony, oximy[editovat | editovat zdroj]
Monosacharidy (aldosy i ketosy) reagují s arylhydraziny za vzniku hydrazonů, při použití přebytku arylhydrazinu reakce pokračuje dále na osazon.[28][29] Nejčastěji používaným činidlem je fenylhydrazin. Při vzniku osazonu zaniká u aldos centrum chirality na C-2, a proto například D-glukosa, D-fruktosa a D-mannosa poskytují identický osazon. Osazony v minulosti sloužily díky jejich dobrým krystalizačním vlastnostem pro identifikaci monosacharidů. Například Emil Fischer využíval osazony k důkazu některých monosacharidů.[30]

Aldosy reagují rovněž s hydroxylaminem za vzniku oximů.[9]
Kilianiho-Fischerova syntéza[editovat | editovat zdroj]
Adicí kyanidového aniontu na karbonylovou skupinu aldos dochází k prodloužení řetězce o jeden uhlík.[31] Z karbonylového uhlíku se stane C-2 a připojí se nový uhlík nitrilové skupiny, z kterého se stane C-1. Vzniká dvojice epimerních kyanhydrinů, které mohou být následně převedeny na dvojici odpovídajících aldos lišíčích se konfigurací na C-2. Tímto způsobem lze z glyceraldehydu syntetizovat postupně všechny aldosy, kdy například z D-arabinosy vznikají D-glukosa a D-mannosa. Tato syntéza byla původně vypracována německými chemiky Heinrichem Kilianim a Hermannem Emilem Fischerem. K rozkladu vznikajících kyanhydrinů byla původně využívána hydrolýza za zvýšené teploty a následná redukce vzniklých laktonů sodným amalgámem. Moderně se využívá spíše katalytická hydrogenace na Pd/BaSO4 nebo Lindlarově katalyzátoru.

Reakce anomerní hydroxylové skupiny[editovat | editovat zdroj]
Glykosidy[editovat | editovat zdroj]
Reakcí anomerní hydroxylové skupiny s alkoholem v kyselém prostředí vznikají glykosidy.[32][9] Tato reakce je analogická tvorbě acetalu z poloacetalu, glykosidy tedy můžeme označit za acetaly monosacharidů. Formálně je v glykosidech nahrazen vodík anomerní hydroxylové skupiny alkyl- nebo arylskupinou. Tuto necukernou část glykosidu nazýváme aglykon. Glykosidace je jedna z nejdůležitějších reakcí monosacharidů a glykosidy jsou v přírodě hojně rozšířeny zejména v rostlinách. Název glykosidu tvoříme tak, že název aglykonu zařadíme před název daného monosacharidu a oddělíme spojovníkem, koncovku -osa (popř. -óza) nahradíme koncovkou -osid. Mezi další používané metody syntézy glykosidů patří Koenigsova-Knorrova syntéza[33] (reakce glykosylhalogenidů s alkoholy) nebo alkylace v bazickém prostředí.

Odkazy[editovat | editovat zdroj]
Poznámky[editovat | editovat zdroj]
- ↑ Tento postup není platný pro monosacharidy s počtem uhlíků 7 a více, kde anomerní referenční atom nemusí být totožný s konfiguračním atomem. Zde se za anomerní referenční atom označuje chirální atom uhlíku s nejvyšším lokantem, který je ještě součástí cukerného kruhu.
Reference[editovat | editovat zdroj]
- ↑ Fischer, E., Syntheses in the sugar group. J. Am. Chem. Soc. 1890, 12 (9), 461-71.
- ↑ Fischer, E., Synthesen in der Zuckergruppe. Berichte der deutschen chemischen Gesellschaft 1890, 23 (2), 2114-2141.
- ↑ Votocek, E.; Kucerenko, V., Fucose (l-galactomethylose) and epifucose (l-talomethylose) series. Collect. Czech. Chem. Commun. 1930, 2, 47-53.
- ↑ Votocek, E.; Valentin, F., The glucosylalkylamines (and other aldose alkylamines). Collect. Czech. Chem. Commun. 1934, 6, 77-96.
- ↑ a b c d McNaught, A. D., Nomenclature of carbohydrates (IUPAC Recommendations 1996). J. Carbohydr. Chem. 1997, 16 (8), 1191-1280. web, pdf
- ↑ a b c d e f g h i Černý, M.; Trnka, T.; Buděšínský, M. Sacharidy. 1. vyd. Praha: Česká společnost chemická, 2010, 178 s. ISBN 978-80-86238-81-4.
- ↑ a b c McMurry, J. Organická chemie, 1. vydání; VŠCHT Praha: Praha, 2007. ISBN 978-80-7080-637-1.
- ↑ Angyal, S. J., The Composition of Reducing Sugars in Solution: Current Aspects. In Adv. Carbohydr. Chem. Biochem., Derek, H., Ed. Academic Press: 1991; Vol. Volume 49, pp 19-35.
- ↑ a b c Capon, B., Mechanism in carbohydrate chemistry. Chem. Rev. 1969, 69 (4), 407-498.
- ↑ Pigman, W.; Isbell, H. S., Mutarotation of sugars in solution. I. History, basic kinetics, and composition of sugar solutions. Advan. Carbohyd. Chem. 1968, 23, 11-57.
- ↑ Moreno, L. F., Understanding Fischer Projection and Angular Line Representation Conversion. J. Chem. Educ. 2012, 89 (1), 175-176.
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). doi:10.1351/goldbook.H02749. Dostupné online.
- ↑ The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 15th Edition Edited by M.J.O'Neil, Royal Society of Chemistry, Cambridge, 2013 ISBN 978-1-84973-670-1; 2708 pages. Dostupné online
- ↑ a b c VODRÁŽKA, Zdeněk. Biochemie. Praha : Academia, 2007. ISBN 978-80-200-0600-4.
- ↑ Ricca, E.; Calabrò, V.; Curcio, S.; Iorio, G., The State of the Art in the Production of Fructose from Inulin Enzymatic Hydrolysis. Crit. Rev. Biotechnol. 2007, 27 (3), 129-145.
- ↑ Biochemie sekundárních metabolitů – sylabus k předmětu, VŠCHT Praha. Dostupné online
- ↑ Umezawa, S., Structures and syntheses of aminoglycoside antibiotics Advances in Carbohydrate Chemistry and Biochemistry. 1974, 30, 111-82
- ↑ Allard, S. T.; Giraud, M. F.; Naismith, J. H., Epimerases: structure, function and mechanism. Cellular and molecular life sciences 2001, 58 (11), 1650-65.
- ↑ de Lederkremer, R. M.; Marino, C., Deoxy sugars: occurrence and synthesis. Adv. Carbohydr. Chem. Biochem. 2007, 61, 143-216.
- ↑ Taylor, M.; Drickamer, K., Introduction to Glycobiology. Oxford University Press: 2003; p 160 pp.
- ↑ Kier, L. B., A molecular theory of sweet taste. J. Pharm. Sci. 1972, 61 (9), 1394-1397.
- ↑ NELSON, David L.; COX, Michael M. Lehninger Principles of Biochemistry. 5. vyd. [s.l.]: W. H. Freeman, 2008. 1100 s. ISBN 978-0716771081.
- ↑ PDB Molekula měsíce - RUBISCO, doi: 10.2210/rcsb_pdb/mom_2000_11, Dostupné online
- ↑ Angyal, S. J., The Composition and Conformation of Sugars in Solution. Angewandte Chemie International Edition in English 1969, 8 (3), 157-166.
- ↑ a b Durette, P. L.; Horton, D., Conformational Analysis of Sugars and Their Derivatives*. In Adv. Carbohydr. Chem. Biochem., Tipson, R. S.; Derek, H., Eds. Academic Press: 1971; Vol. Volume 26, pp 49-125.
- ↑ Tvaroŝka, I.; Bleha, T., Anomeric and Exo-Anomeric Effects in Carbohydrate Chemistry. In Adv. Carbohydr. Chem. Biochem., Tipson, R. S.; Derek, H., Eds. Academic Press: 1989; Vol. Volume 47, pp 45-123.
- ↑ Stoss, P.; Hemmer, R., 1,4:3,6-Dianhydrohexitols. Adv. Carbohydr. Chem. Biochem. 1992, 49, 93-173.
- ↑ Mester, L.; El Khadem, H.; Horton, D., Structure of saccharide osazones. Journal of the Chemical Society C: Organic 1970, (18), 2567-2569.
- ↑ El Khadem, H. S.; Fatiadi, A. J., Hydrazine derivatives of carbohydrates and related compounds. Adv. Carbohydr. Chem. Biochem. 2000, 55, 175-263.
- ↑ Fischer, E., Ueber einige Osazone und Hydrazone der Zuckergruppe. Berichte der deutschen chemischen Gesellschaft 1894, 27 (2), 2486-2492.
- ↑ Wang, Z., Kiliani-Fischer Cyanohydrin Synthesis. Comprehensive Organic Name Reactions and Reagents, John Wiley & Sons, Inc.: 2010.
- ↑ Brito-Arias, Marco. Synthesis and Characterization of Glycosides. Springer, 2007. ISBN 978-0-387-26251-2.
- ↑ Wang, Z., Koenigs-Knorr Reaction. In Comprehensive Organic Name Reactions and Reagents, John Wiley & Sons, Inc.: 2010.
Literatura[editovat | editovat zdroj]
- McMurry, J. Organická chemie, 1. vydání; VŠCHT Praha: Praha, 2007. ISBN 978-80-7080-637-1.
- Wade Jr., L. G. Organic Chemistry (8th Edition), 8th ed.; Pearson, 2012. ISBN 978-0321768414.
- Černý, M.; Trnka, T.; Buděšínský, M. Sacharidy. 1. vyd. Praha: Česká společnost chemická, 2010. ISBN 978-80-86238-81-4.
- VODRÁŽKA, Zdeněk. Biochemie. Praha : Academia, 2007. ISBN 978-80-200-0600-4.
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
