Aldehydy
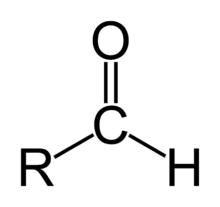
Aldehydy jsou organické sloučeniny, které obsahují aldehydickou funkční skupinu (-CHO) (pozor na záměnu s alkoholy -OH) na konci uhlovodíkového řetězce. Řadí se mezi karbonylové sloučeniny (spolu s ketony, které obsahují karbonylovou skupinu C=O uvnitř řetězce). Jak aldehydy tak ketony jsou v přírodě velmi běžné. Jde o vonné součásti rostlinných silic a také intermediáty biochemických reakcí například glykolýzy. Využívají se v průmyslovém měřítku pro organické syntézy uhlíkatých skeletů.
Názvosloví
[editovat | editovat zdroj]Systematické názvy aldehydů se tvoří z kmene názvu uhlovodíku, od něhož jsou odvozeny přidáním koncovky -al. Pokud karbonylová skupina není součástí hlavního řetězce, označuje se koncovkou -karbaldehyd. V případě, že se v molekule popisované látky vyskytne funkční skupina s vyšší prioritou (např. skupina karboxylová), přítomnost aldehydické skupiny se označí předponou formyl- (pokud karbonylová skupina není součástí hlavního řetězce) nebo oxo- (jestli karbonylová skupina je součástí hlavního řetězce).
Vlastnosti
[editovat | editovat zdroj]Fyzikální vlastnosti
[editovat | editovat zdroj]Fyzikální vlastnosti aldehydů závisí především na počtu atomů uhlíku, jinak též řečeno na jejich molární hmotnosti. Nejnižší aldehydy jsou kapaliny s výjimkou plynného formaldehydu, ty vyšší a nejvyšší pak pevné látky. Mají vyšší body varu než příslušné alkany a cykloalkany, avšak nižší než teploty varu příslušných alkoholů. V molekule aldehydů totiž existují, díky polární vazbě mezi uhlíkem a kyslíkem v karbonylové skupině, přitažlivé síly mezi dipóly. Rozpustnost ve vodě závisí na počtu atomů uhlíku obsažených v molekule aldehydu. S rostoucím počtem těchto atomů rozpustnost značně klesá. Tyto sloučeniny se také dobře rozpouštějí v ethanolu a diethyletheru.
Chemické vlastnosti
[editovat | editovat zdroj]Reaktivita aldehydů je značně vysoká. Způsobuje ji přítomnost karbonylové skupiny, v níž jsou π elektrony posunuty k atomu kyslíku, který má oproti uhlíku vyšší elektronegativitu, díky tomu na atomu uhlíku dochází k tvorbě kladného parciálního náboje. Reaktivita aldehydů postupně klesá s rostoucím počtem atomů uhlíku, tj. nejreaktivnější je formaldehyd.
Většina aldehydů je zdraví škodlivá.
Příprava a výroba
[editovat | editovat zdroj]Aldehydy můžeme získat několika způsoby, základním procesem je oxidace nebo dehydrogenace primárních alkoholů, přičemž dehydrogenace se stala základem průmyslové výroby těchto sloučenin:
- CH3CH2CH2OH → CH3CH2CHO
Aby vůbec k takovéto reakci došlo musí se používat katalyzátory, většinou se používá jemně rozptýlené stříbro či měď. Takto se vyrábí formaldehyd a acetaldehyd, který lze připravit také adiční reakcí acetylenu s vodou v kyselém prostředí (kyselina sírová) a za použití rtuťných solí jako katalyzátorů, přičemž meziproduktem reakce je vinylalkohol, který se tautomeruje na konečný produkt reakce, tedy acetaldehyd.
Některé velice významné aldehydy lze také připravit adicí alkenu vodíkem a oxidem uhelnatým, tato reakce se označuje jako hydroformylace alkenů. Další možností je příprava aldehydů hydrolýzou monotopických dihalogenderivátů, tj. takových halogenderivátů, u nichž se oba atomy jakéhokoliv halogenu vážou na stejný atom uhlíku.
Aldehydy, u nichž se karbonylová skupina váže přímo na aromatické jádro lze získat oxidací arenů, které mají na své aromatické jádro přímo vázán alkyl.
Reakce
[editovat | editovat zdroj]Rozlišení od ketonů
[editovat | editovat zdroj]Aldehydy se od ketonů odlišují Fehlingovým činidlem (roztok síranu měďnatého CuSO4 v prostředí vinanu sodno-draselného a hydroxidu sodného NaOH) nebo Tollensovým činidlem (dusičnan stříbrný AgNO3 v prostředí amoniaku):
Dále se dají odlišit pomocí reakce s dimedonem (5,5-dihydrodimethylresorcinem), s nímž ketony nereagují.
Adice
[editovat | editovat zdroj]Adice u aldehydů probíhá nukleofilním mechanizmem, lze ji rozdělit do dvou fází. Nejdříve se nukleofilní částice připojí na uhlík vázáný s kyslíkem v karbonylové skupině, čímž dojde k zániku dvojné vazby, výsledkem je anion. Ten následně reaguje s elektrofilní částicí v kyselém prostředí, protože touto částicí je nejčastěji proton.
Oxidace
[editovat | editovat zdroj]oxidace, tj. reakce s kyslíkem, probíhá u aldehydů velmi lehce, produktem je pak příslušná karboxylová kyselina. Obecně (R=alkyl):
RCHO → RCOOH
Reakce s alkoholy
[editovat | editovat zdroj]Reakci aldehydu s alkoholem je nutné katalyzovat malým množstvím chlorovodíku. V průběhu reakce dochází ke vzniku poloacetalu. Poloacetal je sloučenina, která obsahuje jednu hydroxylovou skupinu, která může reagovat s protonem za vzniku acetalu.
Reakce s amoniakem a aminy
[editovat | editovat zdroj]S karbonylovou skupinou aldehydů (ale i ketonů) reaguje též amoniak a primární i sekundární aminy. Primárními produkty adice jsou nestálé aminohydroxysloučeniny, které se stabilizují podle druhu použité zásady.
R-CHO + NH3 → R-CH(OH)NH2
Z aromatických aledehydů a alifatických nebo aromatických primárních aminů vznikají tzv. Schiffovy zásady.
R1-NH2 + R2-CHO → R1-N=CH-R2 + H2O
Nejvýznamnější aldehydy
[editovat | editovat zdroj]- acetaldehyd (ethanal)
- benzaldehyd (benzenkarbaldehyd)
- formaldehyd (methanal)
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu aldehydy na Wikimedia Commons
Obrázky, zvuky či videa k tématu aldehydy na Wikimedia Commons  Slovníkové heslo aldehyd ve Wikislovníku
Slovníkové heslo aldehyd ve Wikislovníku
