Diethylether
| Diethylether | |
|---|---|
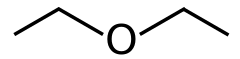 Strukturní vzorec | |
| Obecné | |
| Systematický název | ethoxyethan diethylether |
| Funkční vzorec | (CH3CH2)2O Et2O |
| Sumární vzorec | C4H10O |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 60-29-7 |
| SMILES | CCOCC |
| Číslo RTECS | KI5775000 |
| Vlastnosti | |
| Molární hmotnost | 74,12 g/mol |
| Teplota tání | −116,3 °C |
| Teplota varu | 34,6 °C |
| Hustota | 0,714 g/cm3 |
| Viskozita | 0,224 cP (25 °C) |
| Rozpustnost ve vodě | 6,9 g/100 g (20 °C) |
| Součinitel objemové roztažnosti | 1,62 K−1 |
| Termodynamické vlastnosti | |
| Entalpie tání ΔHt | 102 J/g |
| Entalpie varu ΔHv | 351 J/g |
| Izobarické měrné teplo cp | 2,340 J K−1 g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H224 EUH019 H302 H336 EUH066 |
| P-věty | P210 P241 P261 P303+361+353 P405 P501 |
| R-věty | R12 R19 R22 R66 R67 |
| S-věty | (S2) S9 S16 S29 S33 |
| NFPA 704 |  4
1
1
|
| Teplota vzplanutí | −45 °C |
| Teplota vznícení | 160–170 °C |
| Meze výbušnosti | 1,7–48 % |
Některá data mohou pocházet z datové položky. | |
Diethylether (též ether, éter nebo ethoxyethan) je ether ethanolu. Za běžných podmínek se jedná o čirou, bezbarvou a extrémně hořlavou kapalinu s nízkým bodem varu a charakteristickou nasládlou vůní. Je nejrozšířenějším členem třídy sloučenin obecně nazývaných ethery. Je izomerem butanolu. Diethylether má funkční vzorec CH3-CH2-O-CH2-CH3. Je často používaným rozpouštědlem a dříve též celkovým anestetikem. Ve vodě se rozpouští jen omezeně (6,9 g/100 g).[2] Difúzní koeficient diethyletheru ve vzduchu je 0,74×10−6 m2/s (298 K, 101,325 kPa).[3]
Historie[editovat | editovat zdroj]
Alchymista Ramón Llull údajně objevil diethylether v roce 1275, ale v současnosti o tom neexistují žádné důkazy. Látku poprvé syntetizoval Valerius Cordus v roce 1540 a nazval ji „olej sladkého vitriolu“ (oleum dulcis vitrioli) – to proto, že byl diethylether původně získán destilací směsi ethanolu a kyseliny sírové (známé jako „olej vitriolu“), a zaznamenal některé z lékařsky významných vlastností. Přibližně ve stejné době objevil Theophrastus Bombastus von Hohenheim, známý spíše jako Paracelsus, analgetické vlastnosti etheru. Název ether dal látce August Siegmund Frobenius v roce 1730.
Metabolismus[editovat | editovat zdroj]
Předpokládá se, že je diethylether metabolizován enzymem ze skupiny cytochromu P450[4].
Diethylether inhibuje alkoholdehydrogenázu a proto zpomaluje metabolismus ethanolu.[5] Inhibuje také odbourávání jiných látek vyžadujících oxidativní metabolismus např. diazepam [6].
Použití[editovat | editovat zdroj]
Diethylether je běžným laboratorním rozpouštědlem. Má omezenou rozpustnost ve vodě, proto se často používá pro extrakci kapalina-kapalina. Protože má menší hustotu než voda, vrstva diethyletheru je nahoře. Diethylether se využívá také jako rozpouštědlo pro Grignardovu reakci a pro mnoho dalších reakcí využívající organokovová činidla. Zvláštní význam má jako rozpouštědlo při výrobě celulózových plastů, například acetátu celulózy.[7] Diethylether má vysoké cetanové číslo (85–96) a používal se minulosti jako startovací kapalina pro dieselové a benzinové motory,[8] díky jeho vysoké těkavosti a nízké samozápalné teplotě. Jeho příliš vysoká těkavost, cena a nízká hustota z něj činí nevhodné aditivum benzínové a obzvláště dieselové. Ze stejného důvodu byl jednou z mnoha složek palivové směsi pro karburované motory zažehované kompresí (používané v leteckém modelářství) kde se míchal s petrolétherem a ricínovým olejem v poměru 47 % petroleje, 33 % éteru a 20 % ricinového oleje. Tato využití jsou ale v Evropě dávnou historií (před rokem 1990). V dnešní době jsou používány jiné ethery, v ČR konkrétně methyl-t-butyl ether (MTBE) a také alkoholy (ethanol a methanol). Postupně jsou zaváděna aditiva další generace (EMBE, ad.)
Použití jako anestetikum[editovat | editovat zdroj]
William Morton se účastnil první veřejné demonstrace použití etheru k anestezii 16. října 1846 v Ether Dome v Bostonu. Crawford Williamson Long však jeho použití jako celkového anestetika v chirurgii demonstroval soukromě úředníkům v Georgii již 30. března 1842.[9]
Ether se někdy používal namísto chloroformu, protože má vyšší terapeutický index, větší rozdíl mezi doporučeným dávkováním a toxickým předávkováním (~1,5–2,2). Ze stejného důvodu (a také díky nízké ceně) je stále preferovaným anestetikem v některých rozvojových zemích.[10]
Díky asociacím s Bostonem se používání etheru stalo známé jako „Yankee Dodge“.
Dnes se ether používá jen zřídka. Používání hořlavého etheru mizelo s tím, jak se stala dostupná nehořlavá anestetika, například halothan. Navíc má diethylether mnoho nežádoucích vedlejších účinků, například postanestetickou nauseu a zvracení. Moderní anestetika, například methylpropylether (Neothyl) a methoxyfluran (Penthran) mají tyto účinky podstatně menší.[9]
Použití zevně (v medicíně)[editovat | editovat zdroj]
Směs s ethanolem se používala ve zdravotnictví jako desinfekční (a zároveň očišťující) prostředek pod názvem éteralkohol. Diethylether lze také použít k anestezii klíšťat při jejich odstraňování z kůže. Diethylether způsobí uvolnění klíštěte, takže se již hlavičkou nedrží v kůži.
Použití jako rekreační droga[editovat | editovat zdroj]
Anestetické účinky etheru z něj dělají rekreační drogu, byť ne populární. Diethylether není tak jedovatý jako jiná rozpouštědla zneužívaná jako rekreační drogy. Fyzickou závislost nezpůsobuje, návyk ovšem ano.
Ether smíšený s ethanolem se v 19. století, během jednoho ze západních tažení proti konzumaci alkoholu, prodával jako všelék a rekreační droga. Tehdy se považovalo za neslušné, aby dámy požívaly alkoholické nápoje, proto někdy místo nich konzumovaly drogy s obsahem etheru. Jednou z tehdy prodávaných látek byl lék zvaný hofmanské kapky s obsahem etheru i alkoholu.[11] Ether je obtížné požívat samotný, proto se pro rekreační užívání často míchal s jinými drogami, například ethanolem. Lze ho též užívat inhalačně. V oblasti Malé Litvy (na pravém pobřeží dolního toku Němenu a na pobřeží Kurského zálivu, nejvíce v litevských okresech Šilutė a Tauragė) je dosti silně rozšířen zvyk užívat étér (zde jej nazývají Anodia), nejčastěji nakapaný nebo nalitý na cukr. V této oblasti se častěji než jinde vyskytují úmrtí po předávkování takovýmto způsobem užívaného étéru. Zdrojem étéru v této oblasti nejčastěji bylo a dosud je pašeráctví z Kaliningradské oblasti Ruska. Podobným způsobem jako v Malé Litvě byl étér populární také mezi Lemky.
Vzhledem k nemísitelnosti etheru s vodou a ke skutečnosti, že se v něm výborně rozpouštějí nepolární organické sloučeniny, se používal také při výrobě volné kokainové báze a je uveden v Tabulce II Úmluvy OSN proti nedovolenému obchodu s omamnými a psychotropními látkami jakožto prekurzor.[12]
Výroba[editovat | editovat zdroj]


Diethylether se jen zřídka připravuje v laboratořích, protože je to nebezpečné a ether je pro legální laboratoře snadno dostupný. Většina diethyletheru vzniká jako vedlejší produkt hydratace (ve fázi par) ethylenu na ethanol. Tento proces využívá jako katalyzátor kyselinu fosforečnou na pevném nosiči a lze ho upravit tak, aby vznikalo více etheru, je-li to třeba.[7] Dehydratace ethanolu (ve fázi par) na katalyzátoru oxidu hlinitém může poskytnout výtěžnost diethyletheru až 95 %.[13]
Diethylether lze připravovat jak v laboratořích, tak v průmyslovém měřítku kyselou syntézou. Ethanol se smísí se silnou kyselinou, typicky kyselinou sírovou H2SO4. Kyselina disociuje a způsobuje vznik vodíkových iontů H+. Vodíkový iont protonuje elektronegativní atom kyslíku v molekule ethanolu, což dává molekule kladný náboj:
- CH3CH2OH + H+ → CH3CH2OH2+
Nukleofilní atom kyslíku deprotonovaného ethanolu substituuje molekulu vody z protonované (elektrofilní) molekuly ethanolu, čímž vzniká voda, vodíkový iont a diethylether.
- CH3CH2OH2+ + CH3CH2OH → H2O + H+ + CH3CH2OCH2CH3
Reakce musí probíhat při teplotách pod 150 °C, aby bylo zajištěno, že produktem této reakce není eliminační produkt (ethylen). Při vyšších teplotách se ethanol dehydratuje na ethylen. Reakce, při níž vzniká diethylether, je zvratná, takže se nakonec ustaví rovnováha mezi reaktanty a produkty. Pro dobrou výtěžnost je potřeba, aby se ether oddestilovával z reakční směsi dříve, než se převede zpět na ethanol (využití Le Chatelierova principu).
Jinou reakcí, kterou lze použít pro přípravu etherů, je Williamsonova etherová syntéza, kde alkoxid (připravovaný rozpouštěním alkalického kovu v alkoholu) provádí nukleofilní substituci na alkylhalogenidu.
Bezpečnost[editovat | editovat zdroj]
Diethylether je náchylný na tvorbu peroxidů a může tvořit výbušný diethyletherperoxid. Peroxidy mají vyšší teplotu varu a po vyschnutí vybuchují již při pouhém dotyku. Diethylether se proto typicky dodává se stopovými množstvími antioxidantu BHT (2,6-di-terc-butyl-4-methylfenol), který tvorbu peroxidů omezuje.[14] Jako stabilizátor se používá také fenidon v koncentraci 0,001 % (10 ppm).[15] Při uložení etheru na hydroxidu sodném se vznikající peroxidy vysráží. Vodu a peroxidy lze odstranit buď destilací ze sodíku a benzofenonu, anebo průchodem přes sloupec aktivovaného oxidu hlinitého.[16]
Diethylether je extrémně hořlavá látka. Je potřeba se vyhnout styku s otevřenými plameny, ale i s elektricky ohřívanými zařízeními, protože se ether snadno vznítí od plamene nebo jiskry. Teplota samovznícení je pouze 170 °C, takže lze diethylether zapálit i jen horkým povrchem bez plamene či jiskry. Běžnou praxí v chemických laboratořích je použít pro ohřívání nebo destilaci etheru namísto kahanu páru nebo topná hnízda určená do výbušného prostředí.
Ethery jsou známy snadným přechodem deflagrace v detonaci a poměrně širokým rozsahem mezi dolní a horní mezí výbušnosti par, takže exploze par jednoduchých etherů mají mnohem závažnější účinky než exploze jiných rozpouštědel.
Při koncentraci 200 ppm jsou páry diethyletheru zjistitelné čichem jako dráždivé. Do 400 ppm se neprojevují žádné významné účinky. Koncentrace 2 000 ppm již působí lehce narkoticky, koncentrace 35 000 ppm (3,5 %) vyvolává během 30 minut hlubokou narkózu.[17]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Diethyl ether na anglické Wikipedii.
- ↑ a b Ether. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ VOHLÍDAL, Jiří. Chemické tabulky. Vydání první. vyd. Praha: SNTL, 1982. 336 s. S. 88.
- ↑ http://www.gsi-net.com/en/publications/gsi-chemical-database/single/267.html
- ↑ 109. Aspergillus flavus mutant strain 241, blocked in aflatoxin biosynthesis, does not accumulate aflR transcript. Archivováno 17. 9. 2017 na Wayback Machine. Matthew P. Brown and Gary A. Payne, North Carolina State University, Raleigh, NC 27695
- ↑ P. T. Normann, A. Ripel and J. Morland. Diethyl Ether Inhibits Ethanol Metabolism in Vivo by Interaction with Alcohol Dehydrogenase. Alcoholism: Clinical and Experimental Research. 1987, roč. 11, čís. 2, s. 163–166. DOI 10.1111/j.1530-0277.1987.tb01282.x.
- ↑ Larry K. Keefer, William A. Garland, Neil F. Oldfield, James E. Swagzdis, and Bruce A. Mico. Inhibition of N-Nitrosodimethylamine Metabolism in Rats by Ether Anesthesia. Cancer Research. 1985, roč. 45, s. 5457–60. Dostupné online.
- ↑ a b Ethers, by Lawrence Karas and W. J. Piel. [s.l.]: John Wiley & Sons, Inc, 2004.
- ↑ Extra Strength Starting Fluid: How it Works [online]. Valvovine [cit. 2007-09-05]. Dostupné v archivu pořízeném dne 2007-09-27.
- ↑ a b Hill, John W. and Kolb, Doris K. Chemistry for changing times: 10th edition. Page 257. Pearson: Prentice Hall. Upper saddle river, New Jersey. 2004.
- ↑ Calderone, F.A. J. Pharmacology Experimental Therapeutics, 1935, 55(1), 24-39, http://jpet.aspetjournals.org/cgi/reprint/55/1/24.pdf Archivováno 27. 3. 2009 na Wayback Machine.
- ↑ Erowid Ether Vaults : Hoffmann's Drops
- ↑ Microsoft Word - RedListE2007.doc. www.incb.org [online]. [cit. 13-07-2009]. Dostupné v archivu pořízeném dne 27-02-2008.
- ↑ Ethyl Ether, Chem. Economics Handbook. Menlo Park, Calif: SRI International, 1991.
- ↑ Diethyl ether - ACS reagent, anhydrous, ≥99.0%, contains BHT as inhibitor
- ↑ DIETHYLETHER č., stabilizovaný max. 0,001 % fenidonu[nedostupný zdroj]
- ↑ W. L. F. Armarego and C. L. L. Chai. Purification of laboratory chemicals. [s.l.]: Butterworth-Heinemann, 2003. ISBN 978-0750675710.
- ↑ Bezpečnostní list: Diethylether[nedostupný zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu diethylether na Wikimedia Commons
Obrázky, zvuky či videa k tématu diethylether na Wikimedia Commons


