Hydroxylamin
| Hydroxylamin | |
|---|---|
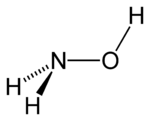 Strukturní vzorec | |
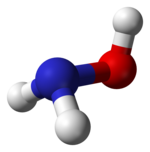 Model molekuly | |
 Prostorový vzorec | |
| Obecné | |
| Systematický název | hydroxylamin |
| Ostatní názvy | aminol, azanol, hydroxyamin, hydroxyazan, hydroxylazan |
| Anglický název | hydroxylamine, aminol, azanol, hydroxyamine, hydroxyazane, hydroxylazane, nitrinous acid |
| Německý název | Hydroxylamin |
| Funkční vzorec | NH2OH |
| Sumární vzorec | NH3O |
| Vzhled | bílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 7803-49-8 |
| PubChem | 787 |
| SMILES | NO |
| InChI | InChI=1S/H3NO/c1-2/h2H,1H2 |
| Vlastnosti | |
| Molární hmotnost | 33,03 g/mol |
| Teplota tání | 33 °C (306 K) |
| Teplota rozkladu | 58 °C (331 K) |
| Hustota | 1,21 g/cm3 (20 °C) |
| Rozpustnost ve vodě | dobře rozpustný |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −39,9 kJ/mol |
| Standardní molární entropie S° | 236,18 kJ/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R2 R21/22 R37/38 R40 R41 R43 R48/22 R50 |
| S-věty | S2 S26 S36/37/39 S61 |
| NFPA 704 |  1
2
3
|
| Teplota vzplanutí | 129 °C |
| Teplota vznícení | 265 °C |
Některá data mohou pocházet z datové položky. | |
Hydroxylamin je chemická sloučenina obsahující aminovou a hydroxylovou funkční skupinu. Jedná se o bílou nestabilní hygroskopickou krystalickou látku.[2] Nejčastěji se používá ve vodném roztoku. Používá se k výrobě oximů a také je meziproduktem nitrifikace.
Historie
[editovat | editovat zdroj]Hydroxylamin poprvé připravil (v podobě hydrochloridu) německý chemik Wilhelm Clemens Lossen reakcí cínu s kyselinou chlorovodíkovou za přítomnosti dusičnanu ethylnatého.[3] V čisté podobě jej poprvé připravil roku 1891 nizozemský chemik Lobry de Bruyn a Francouz Léon Maurice Crismer.[4][5]
Deriváty
[editovat | editovat zdroj]Pokud je substituován vodík hydroxylové skupiny, vznikají O-hydroxylaminové deriváty, při substituci vodíku aminoskupiny jde o N-hydroxylaminy. Podobně jako u obyčejných aminů, i zde existují primární, sekundární a terciární hydroxylaminy.
Ke sloučeninám s hydroxylaminovou skupinou patří například N-terc-butylhydroxylamin a N,O-dimethylhydroxylamin.
Výroba
[editovat | editovat zdroj]NH2OH se vyrábí několika různými způsoby. Nejčastější je Raschigův proces, kde je dusitan amonný ve vodném roztoku redukován oxidem siřičitým za vzniku hydroxylamido-N,N-disulfonátového aniontu:
NH4NO2 + 2 SO2 + NH3 + H2O → 2 NH4+ + N(OH)(OSO2)22−.
Aniont se následně hydrolyzuje, přitom se vytváří (NH3OH)2SO4:
N(OH)(OSO2)22− + H2O → NH(OH)(OSO2)− + HSO4−.
Pevný hydroxylamin se získá reakcí s kapalným amoniakem, síran amonný, vedlejší produkt této reakce, se odstraní filtrací a amoniak se odpaří.
Reakce
[editovat | editovat zdroj]Hydroxylamin reaguje s elektrofily, například s alkylačními činidly: R-X + NH2OH → R-ONH2 + HX R-X + NH2OH → R-NHOH + HX.
Reakcí s aldehydy a ketony vznikají oximy: R2C=O + NH2OH∙HCl, NaOH → R2C=NOH + NaCl + H2O
Použití
[editovat | editovat zdroj]Hydroxylamin a jeho soli se používají jako redukční činidla v mnoha organických a anorganických reakcích. Také mohou fungovat jako antioxidanty mastných kyselin.
Při syntéze polyamidu 6 se cyklohexanon nejprve převádí na oxim, z něhož Beckmannovým přesmykem za přítomnosti kyseliny sírové vznikne kaprolaktam.

Hydroxylamoniumnitrát, dusičnan hydroxylaminu, byl zkoumán jako pohonná hmota pro rakety, jak ve vodném roztoku, tak jako pevná látka.
Bezpečnost
[editovat | editovat zdroj]Hydroxylamin může při zahřívání vybouchnout. Rychlost rozkladu 50% roztoku NH2OH urychlují železnaté a železité soli. Hydroxylamin a jeho deriváty jsou mnohem bezpečnější ve formě solí.
Tato látka dráždí kůži, dýchací cesty a oči. Může být vstřebána kůží, je škodlivá při polknutí a pravděpodobně jde o mutagen.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Hydroxylamine na anglické Wikipedii.
- ↑ a b Hydroxylamine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Greenwood and Earnshaw. Chemistry of the Elements. 2nd Edition. Reed Educational and Professional Publishing Ltd. pp. 431–432. 1997.
- ↑ W. C. Lossen (1865) "Ueber das Hydroxylamine" (On hydroxylamine), Zeitschrift für Chemie, 8 : 551-553. From p. 551: "Ich schlage vor, dieselbe Hydroxylamin oder Oxyammoniak zu nennen." (I propose to call it hydroxylamine or oxyammonia.)
- ↑ C. A. Lobry de Bruyn (1891) "Sur l'hydroxylamine libre" (On free hydroxylamine), Recueil des travaux chimiques des Pays-Bas, 10 : 100-112.
- ↑ L. Crismer (1891) "Préparation de l'hydroxylamine cristallisée" (Preparation of crystalized hydroxylamine), Bulletin de la Société chimique de Paris, series 3, 6 : 793-795.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Hydroxylamin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hydroxylamin na Wikimedia Commons





