Hlístice
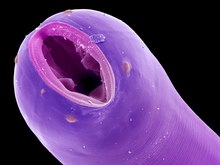
 Háďátko Heterodera glycines s vajíčkem, zvětšeno 1000× | |
| Vědecká klasifikace | |
| Říše | živočichové (Animalia) |
| Podříše | Eumetazoa |
| (nezařazeno) | prvoústí (Protostomia) |
| Nadkmen | Ecdysozoa |
| Kmen | hlístice (Nematoda) Rudolphi, 1808 |
| Sesterská skupina | |
| strunovci (Nematomorpha) | |
| Některá data mohou pocházet z datové položky. | |
Hlístice (Nematoda) jsou kmen prvoústých živočichů ze skupiny Ecdysozoa. Jde o podlouhlé živočichy s červovitým, nečlánkovaným tělem, jejichž velikost se pohybuje od několika desítek mikrometrů až po několik metrů. Tělní dutina hlístic je pseudocoelní, chybí specializovaná oběhová a dýchací soustava. Osvalení těla zajišťuje jedna vrstva podélné svaloviny, jež je rozdělena čtyřmi lištami pokožky – hlístice nedokážou měnit průměr těla, ale pouze sebou „mrskají“. Svrchní část těla hlístic kryje vícevrstevná kutikula. Trávicí soustava je trubicovitá a úplná, pohyb potravy trávicí trubicí zajišťuje válcovitý hltan pracující jako savá pumpa. Vylučovací funkci mají jedna až dvě žláznaté buňky (renety), resp. odvozenější soustava specifických lišt, jež se táhnou podél boční strany těla. Hlavní centrum nervové soustavy představuje nevýrazný obhltanový prstenec, z něhož dopředu a dozadu vybíhají páry podélných nervových provazců. Smyslové orgány se omezují především na mechano- a chemoreceptory; nejvýznamnější z nich jsou tzv. amfidy v přední části těla.
Hlístice bývají gonochoristé a objevuje se i pohlavní dimorfismus. Pohlavní orgány jsou u obou pohlaví trubicovité, v případě samic ústí samostatným vývodem, u samců se objevuje společný vývod rozmnožovací a trávicí soustavy. Specifickými vnějšími pohlavními orgány samců jsou jehlicovité spikuly, pomocí nichž se ukotvují v pohlavním vývodu samic. Vajíčka hlístic jsou značně odolná, chráněná obalem chitinózního a lipoidního charakteru. Vývoj v dospělce probíhá přes čtyři larvální stádia, ačkoli se nejedná o larvy v pravém slova smyslu: stádia odděluje pouze svlékání staré a tvorba nové kutikuly, vývoj samotný je přímý. Pro řadu hlístic je typická tzv. eutelie, tkáně jednotlivých jedinců tedy bývají tvořeny shodným počtem buněk.
Hlístice patří mezi druhově nejbohatší i celkově nejpočetnější živočišné kmeny vůbec. Celkový počet asi 30 000 popsaných druhů představuje jenom zlomek jejich skutečné bohatosti. Rozšířeny jsou jak v suchozemských, tak vodních ekosystémech, řada z nich odolává i extrémním podmínkám. Mnoho linií hlístic se v průběhu evoluce stalo parazity živočichů či rostlin, což vedlo k často komplikovaným životním cyklům: jmenovat lze například somatickou migraci larev v definitivním hostiteli, přítomnost různých mezihostitelů, vektorů a paratenických hostitelů nebo některé příklady parazitární manipulace. Některé hlístice jsou široce rozšířenými parazity člověka (k nejpočetnějším z nich patří roup dětský, škrkavka dětská nebo tenkohlavec lidský), domestikovaných zvířat a řada háďátek se etablovala mezi významné škůdce na plodinách. Obrovské důležitosti však hlístice nabývají i ve vědeckém výzkumu: háďátko obecné se stalo jedním z modelových organismů a jeho výzkum přinesl cenné informace ohledně buněčné a molekulární biologie.
Systematika[editovat | editovat zdroj]

První formální vědecký popis zástupce hlístic pochází od švédského systematika Carla Linného, jenž ve svém 10. vydání díla Systema naturae, které je pokládáno za formální hranici počátků zoologického názvosloví, popisuje rod Ascaris, jenž v Linného pojetí zahrnoval škrkavku dětskou (Ascaris lumbricoides) a roupa dětského (Ascaris vermicularis, v současné nomenklatuře Enterobius vermicularis). Hlístice byly v Linného klasifikaci součástí širšího taxonu Vermes neboli červi.[1] Vermes zahrnovali velké množství vzájemně nepříbuzných bezobratlých, a šlo tedy o nepřirozený, polyfyletický taxon.
Jako autor, který poprvé vědecky popsal skupinu hlístic, bývá uváděn německý přírodovědec Karl Asmund Rudolphi, jenž ve své práci z roku 1808 vytyčil řád Nematoidea. Současnou podobu jména, tj. Nematoda, prvně použil rakouský zoolog Karl Moriz Diesing roku 1861.[2] Teprve americký přírodovědec Nathan Cobb však v první polovině 20. století definoval hlístice v holofyletické podobě a na úrovni zoologického kmenu; z tohoto důvodu může být v některé literatuře preferováno spíše Cobbovo pojmenování Nemata, resp. Nemates.[3][4] Cobb, jenž žil mezi lety 1859 a 1932, je považován za jednoho z koryfejů nematologie, přírodovědného oboru, jenž se zabývá studiem hlístic. Cobb v roce 1914 pojmenování této vědní disciplíny sám navrhl a během svého života popsal více než 1000 druhů hlístic.[5] Samotné pojmenování Nematoda vychází z řeckého nema (vlákno) a odes (podobat se).[6] České označení hlísta je všeslovanské, odvozené z praslovanského *glista / glistъ a nesoucí ekvivalenty mj. v latině (glittus) a řečtině (glítton). Východiskem je indoevropské slovo *gl(e)it-t- ve významu „slizký“ či „lepkavý“, se souvisejícím slovem hlína má stejný jazykový kořen *glei- („mazat“ či „lepit“).[7]
Vnitřní systematika hlístic nicméně zůstává dlouhodobě problematická. Tradiční klasifikace, používaná již od 30. let 20. století, operovala s dvěma hlavními třídami: Aphasmidia (později Adenophorea) a Phasmidia (později Secernentea). Rozlišovacím znakem byla v tomto případě nepřítomnost, resp. přítomnost fasmidů, žláznatých chemoreceptorů po stranách zadního konce těla. Z hlediska ekologického pak spadala většina parazitických druhů do třídy Phasmidia, resp. Secernentea.[8][9] Především v učebních textech může být tento koncept pro své praktické účely stále užíván.[10]
První schéma fylogeneze hlístic založené na kladistických metodách pochází ze začátku 80. let 20. století – od té doby se prakticky všechna nová schémata opírají o molekulární data, či o kombinaci morfologických a molekulárních dat.[8][11] Většina studií podporuje rozdělení hlístic na tři velké klady: Chromadoria (= Chromadorea), Enoplia a Dorylaimia. Jejich vzájemné vztahy jsou však sporné. Skupina Chromadorea zahrnuje bývalou skupinu Secernentea, skupiny Enoplia a Dorylaimia pak bývají řazeny do třídy Enoplea, ačkoli ta nemusí představovat monofyletický taxon.[8][10][12]
Ještě komplikovanější zůstává vytyčení přirozených řádů a ostatních taxonů nižší úrovně. Vnitřní systematika je kontroverzní a nestálá a mezi jednotlivými autory se značně různí. Komplexní studie z roku 2022, založená na kompilaci dat z morfologie, molekulární a vývojové biologie, usilující o odstranění nepřirozených taxonů a o poskytnutí kompletního přehledu a správného zařazení popsaných druhů, představuje revizi stávajících systémů, která dělí hlístice do 3 tříd (třídu Dorylaimea vyčleňuje mimo Enoplea, neboť se prokazatelně jedná o fylogeneticky samostatnou linii, bližší spíše k Chromadorea[13][14]) a 32 řádů (z nichž některé byly kvůli přirozenosti rozděleny, jiné naopak rozšířeny, takže zahrnují některé původní řády na nižších taxonomických úrovních).[3][pozn. 1] Soupis rodů a druhů pak v této studii dochází k celkovému počtu 3030 validních[pozn. 2] rodů a 28 537 druhů hlístic, a to včetně fosilních.[3] Následující přehled představuje tento systém do úrovně řádů (v poznámkách jsou přitom pro úplnost zmíněny i častěji uváděné řády z předchozích systémů, nově ponížené na jinou taxonomickou úroveň), s jejich rodovou početností a českými názvy dle BioLib.cz,[15] u určitých řádů byli vybráni někteří medicínsky či jinak významní zástupci:
Kmen Nematoda Cobb, 1932 – hlístice
- Třída Dorylaimea Hodda, 2007
- Podtřída Dorylaimia Inglis, 1983
- Nadřád Dorylaimica Hodda, 2007
- Řád Dorylaimida Pearse, 1942 – hlístkové (269 rodů)
- Řád Bathyodontida Siddiqi, 1983 (5 rodů)
- Řád Mononchida Jairajpuri, 1969 (47 rodů)
- Řád Mermithida Hyman, 1951 (122 rodů)[pozn. 3]
- Nadřád Dorylaimica Hodda, 2007
- Podtřída Trichocephalia Hodda, 2007
- Nadřád Trichocephalica Hodda, 2007
- Řád Trichocephalida Spasski, 1954 (37 rodů; svalovec stočený [Trichinella spiralis], tenkohlavec lidský [Trichuris trichiura])[pozn. 4]
- Řád Marimermithida Rubtzov, 1980 (5 rodů)
- Řád Dioctophymatida Ryzhikov & Sonin, 1981 (5 rodů)
- Řád Muspiceida Spratt & Nicholas, 2002 (9 rodů)
- Nadřád Trichocephalica Hodda, 2007
- Podtřída Dorylaimia Inglis, 1983
- Třída Enoplea Inglis, 1983
- Podtřída Enoplia Pearse, 1942
- Nadřád Enoplica Hodda, 2007
- Řád Enoplida Filipjev, 1929 (41 rodů)
- Řád Ironida Hodda, 2007 (67 rodů)
- Řád Tripyloidida Hodda, 2007 (9 rodů)
- Řád Alaimida Siddiqi, 1983 (13 rodů)
- Řád Trefusiida Lorenzen, 1981 (13 rodů)
- Nadřád Rhaptothyreica Hodda, 2022
- Řád Rhaptothyreida Tchesunov, 1997 (2 rody)
- Nadřád Enoplica Hodda, 2007
- Podtřída Oncholaimia Hodda, 2007
- Nadřád Oncholaimica Hodda, 2007
- Řád Oncholaimida Siddiqi, 1983 (56 rodů)
- Nadřád Oncholaimica Hodda, 2007
- Podtřída Triplonchia Hodda, 2007
- Nadřád Triplonchica Hodda, 2007
- Řád Triplonchida Cobb, 1920 (10 rodů)
- Řád Tripylida Siddiqi, 1983 (32 rodů)
- Nadřád Triplonchica Hodda, 2007
- Podtřída Enoplia Pearse, 1942
- Třída Chromadorea Inglis, 1983
- Podtřída Chromadoria Adamson, 1987
- Nadřád Chromadorica Hodda, 2007
- Řád Chromadorida Chitwood, 1933 (85 rodů)
- Řád Selachinematida (Hodda, 2007) (19 rodů)
- Řád Desmodorida De-Coninck, 1965 (98 rodů)
- Řád Desmoscolecida Filipjev, 1929 (28 rodů)
- Nadřád Chromadorica Hodda, 2007
- Podtřída Plectia Hodda, 2007
- Nadřád Monhysterica Hodda, 2007
- Řád Monhysterida Filipjev, 1929 (171 rodů)[pozn. 5]
- Nadřád Plectica Hodda, 2007
- Řád Leptolaimida Hodda, 2007 (36 rodů)
- Řád Plectida Malakhov, Ryzhikov & Sonin, 1982 (36 rodů)
- Řád Benthimermithida Tchesunov, 1997 (3 rody)
- Nadřád Teratocephalica Hodda, 2007
- Řád Teratocephalida Goodey, 1963 (2 rody)
- Nadřád Rhabditica Hodda, 2007
- Řád Diplogasterida Inglis, 1983 (71 rodů)
- Řád Rhabditida Chitwood, 1933 – háďata (552 rodů; háďátko obecné [Caenorhabditis elegans])[pozn. 6]
- Řád Spirurida Railliet, 1915 – spirury (764 rodů; roup dětský [Enterobius vermicularis], škrkavka [Ascaris sp.], vlasovci [Wuchereria sp., Onchocerca sp., …])[pozn. 7]
- Řád Rhigonematida Kim et al., 2014 (31 rodů)
- Řád Panagrolaimida Hodda, 2007 (352 rodů; háďátko řepné [Heterodera schachtii], háďátko ovesné [H. avenae], háďátko bramborové [Globodera rostochiensis])[pozn. 8]
- Řád Drilonematida Hodda, 2022 (39 rodů)
- Nadřád Monhysterica Hodda, 2007
- Podtřída Chromadoria Adamson, 1987
Vnější systematika[editovat | editovat zdroj]
Hlístice (Nematoda) představují kmen prvoústých živočichů ze skupiny Ecdysozoa.
Významnou skupinou, jejíž zástupci byli dlouhodobě sdružováni s hlísticemi, byli strunovci (Nematomorpha), kmen kosmopolitně rozšířených červovitých živočichů parazitujících na členovcích. Zástupce obou skupin od sebe poprvé jasně oddělil český přírodovědec František Vejdovský roku 1886[2][16] a v současnosti jsou hlístice a strunovci považováni za dva samostatné kmeny, byť s největší pravděpodobností sesterské. Některé hlístice, konkrétně parazitické strunice ze řádu Mermithida, se svou biologií silně podobají pravým strunovcům, vývoj obou těchto skupin však probíhal konvergentní evolucí a fylogeneticky jsou od sebe dosti vzdálené.[17]
Hlístice společně se strunovci utvářejí monofyletickou skupinu Nematoida v rámci ekdysozoí, ačkoli příbuzenské vztahy s ostatními kmeny nejsou zcela jednoznačné. Klad Nematoida zřejmě představuje sesterskou skupinu vůči celému kladu Panarthropoda, jehož nejvýznamnějšími zástupci jsou členovci (Arthropoda).[18][19] V jiných systémech jsou hlístice + strunovci sdružováni spíše s chobotovci (Scalidophora), kteří zahrnují korzetky (Loricifera), rypečky (Kinorhyncha) a hlavatce (Priapulida), a všechny tyto skupiny mají dohromady utvářet klad Cycloneuralia.[20][21] Nejistá však zůstává i přirozenost samotných panartropodů a chobotovců. V prvém případě problematickou skupinu představují želvušky (Tardigrada), které jsou někdy sdružovány spíše k hlísticím nežli k ostatním panartropodům;[22] ve druhém případě pak korzetky, které jsou naopak pokládány spíše za příbuzné panartropodů.[23]
Kladogram vyobrazený níže demonstruje předpokládanou pozici hlístic na fylogenetickém stromě na základě [18]:
Evoluce[editovat | editovat zdroj]


Evoluční historie hlístic i vztahy mezi jejich jednotlivými hlavními klady nejsou příliš dobře známy. Dá se očekávat, že původ celé skupiny sahá možná již do proterozoika, ačkoli rekonstrukci fylogeneze komplikuje citelná absence fosilních nálezů.[9]
Hlístice byly původně nejspíše mořskými organismy. Výrazná podobnost mezi hlísticemi ze řádu Mermithida a parazitickými strunovci vedla k hypotéze, že společný předek hlístic mohl být parazitický organismus, jenž se svou biologií podobal strunovcům, a volně žijící skupiny tedy u hlístic představují až reverzní stav. Molekulární data však podporují fakt, že řád Mermithida je vnořen v rámci ostatních hlístic, a proto tuto hypotézu zavrhují.[25] Jiné hypotézy vzhled předka hlístic odvozují od blízce příbuzných chobotovců (Scalidophora): korzetek, rypeček a hlavatců. Ti mohou představovat sesterskou skupinu vůči hlísticům + strunovcům (tj. kladu Nematoida) a panartropodům. Společným znakem chobotovců je mj. zatažitelný „chobotek“, tzv. introvert. Podle některých studií mohou hlístice a strunovci vycházet právě z podobných předků s introvertem. Zatažitelná struktura, považovaná za homologickou s introvertem, stále přetrvává u larev strunovců, jež ji mohou využívat k penetraci do tělní dutiny hostitelů, zatímco vysoce modifikovaní dospělci již introvert ztratili.[26] Novější studie však nepokládají chobotovce za monofyletickou skupinu a korzetky považují za kmen spřízněný spíše s panartropody.[23]
Co se týče původu tří hlavních kladů hlístic, za relativně vyjasněnou se považuje situace v rámci kladu Chromadoria, jenž je nejspíše mořský a teprve druhotně se z něj odvodily suchozemské linie. Komplikovanější je evoluční historie kladů Enoplia a Dorylaimia. Například většina zástupců skupiny Enoplia v současnosti představuje volně žijící mořské bezobratlé, ale některé molekulárně-biologické analýzy hodnotí jako sesterskou skupinu vůči zbylým enopliím hlístice ze řádu Triplonchida, jež se vyznačují sladkovodním či suchozemským způsobem života.[25]
V rámci všech tři hlavních kladů lze objevit parazity bezobratlých i obratlovců. Parazitický způsob života se v evoluci hlístic objevil mnohokrát nezávisle na sobě a vykazuje značnou rozmanitost a paralelnost, dokonce i mezi blízce příbuznými taxony. Není výjimkou, že se i v rámci jedné vývojové linie objevují ztráty či zisk mezihostitelů nebo vektorových hostitelů, případně radikální změny hostitelských druhů. Klady zahrnující parazity členovců dokonce mohou být podle některých studií vnořeny v rámci linií zahrnujících jinak výhradně parazity obratlovců (např. hlístice z čeledi Rhigonematidae).[25] Samotná parazitická životní strategie je spojena s nutností rozpoznat, napadnout a přežít v předpokládaném hostitelském druhu. Všechny parazitické hlístice za tímto účelem rozvíjejí specializované infekční larvální stádium. Infekční larvy často vykazují podobnosti s odolným stádiem tzv. dauer larvy u volně žijících hlístic, dauer larva tedy může představovat důležitou preadaptaci k parazitismu.[27]
Zajímavý fenomén představuje také evoluce fytopatogenních háďátek, která se živí obsahem hostitelských buněk. Živočichové obecně nejsou schopni degradovat buněčnou stěnu rostlinných buněk, v tomto ohledu se plně spoléhají na činnost symbiotických mikroorganismů. Fytopatogenní hlístice však produkují celulolytické enzymy, jež jim porušení buněčné stěny umožňují – přičemž je pravděpodobné, že této schopnosti dosáhly vlivem horizontálního přenosu genů právě od bakterií nebo rhizosférických hub.[25][28]
Fosilní záznam hlístic je z velké části omezen na relativně moderní zástupce jejich korunových skupin.[29] Zachování měkkého těla je totiž pouze vzácností. Možné fosilie stop vodních hlístic byly nalezeny ve svrchněprekambrických ložiscích z Austrálie a Evropy, nicméně jejich identifikace je sporná.[30] Nejstarší prokázanou fosilii tak představuje až Palaeonema phyticum ze spodního devonu před asi 400 miliony lety. Tento červ byl navíc objeven v asociaci s průduchy rostliny Aglaophyton major, což značí, že vzájemné úzce provázané vztahy mezi rostlinami a hlísticemi existovaly již ve starším paleozoiku.[31] Velmi dobré mladší nálezy poskytla i ložiska jantaru. Z takto dochovaných hlístic lze jmenovat například druhy Eophasma jurasicum ze spodní jury (před 160 mil. roky), strunice Cretacimermis sp. z křídového období a mnohé další. Podobní parazité hmyzu jsou navíc často nalézáni přímo s jejich hostitelskými členovci, což opět poskytuje alespoň rámcovou představu o starobylosti vztahů parazit-hostitel v rámci konkrétních linií hlístic.[32][33]
Anatomie a fyziologie[editovat | editovat zdroj]

Hlístice představují podlouhlé živočichy s nesegmentovaným tělem. Tělní symetrie je, podobně jako u ostatních trojlistých, z obecného hlediska dvoustranná, avšak přední část těla vykazuje radiální symetrii.[34] Předpokládá se, že jde o důsledek částečně přisedlého způsobu života, kdy je červ ukotven zadní částí těla k substrátu a zaujímá vertikální polohu; toto chování lze pozorovat u mnohých vodních hlístic a pokládá se za plesiomorfii celé skupiny.[35]
Tělo je u většiny zástupců kruhové v průřezu a zaujímá niťovitý, válcovitý nebo vřetenovitý tvar.[36] Směrem k oběma koncům, a zvláště pak v zadní části, se tělo zužuje. Hlístice bývají typicky gonochoristy, a proto se často objevuje i pohlavní dimorfismus co se týče tvaru či celkové délky těla.[37] Samce lze většinou odlišit pomocí jinak tvarované zádi, jež je často zahnutá, spirálovitě stočená či rozšířená.[38]
Některé druhy hlístic v průběhu evoluce nabyly různých excesivních tvarů, vymykajících se obecnému vzhledu; například samice určitých rostlinných parazitů (např. Meloidogyne spp.) během vývoje dorůstají do extrémně zvětšené, jakoby hruškovité podoby. Značně rozmanitá je rovněž celková délka těla, která se pohybuje mezi několika řádovými velikostmi. Obecně platí, že nejmenší bývají volně žijící a fytopatogenní druhy: například mořská hlístice Hapalomus minutus dosahuje velikosti pouze okolo 80 μm, rostlinný parazit Neopsilenchus minor pak svou délkou nepřesahuje 300 μm. Velmi dlouzí naproti tomu mohou být parazité živočichů: vlasovec medinský (Dracunculus medinensis) může měřit 1,2 m, rekordmanem je pak Placentonema gigantissima, parazit vorvaňů, jehož samice mohou měřit až 8,4 m.[37]
Hlístice nemají pravou tělní dutinu (coelom), zůstává u nich pouze prvotní, pseudocoelní tělní dutina. Tu vyplňuje tekutý obsah, jenž se podílí na tvorbě hydrostatického skeletu.[39] Pseudocoelní dutina není příliš prostorná a platí, že u většiny hlístic zůstává prakticky celý vnitřní prostor těla zabrán jednotlivými orgány. Výjimku představují některé větší parazitické druhy, u nichž může být pseudocoel prostornější; naopak menší hlístice jej mohou kompletně potlačit.[40][41] Hlístice postrádají specializovanou oběhovou a dýchací soustavu, jejichž funkce zajišťuje difuze a pohyb tekutin v pseudocoelu. Přenos dýchacích plynů v tělní tekutině může u některých druhů usnadňovat přítomnost hemoglobinu. Řada parazitických hlístic, podobně jako motolice či tasemnice, také může být fakultativně anaerobní, přičemž přechod mezi aerobními a anaerobními metabolickými drahami v takovém případě určuje koncentrace kyslíku v prostředí.[42][43] Tělní dutina hlístic obsahuje i specializované buňky coelomocyty, jejichž význam je však znám pouze částečně. Coelomocyty se mohou podílet např. na obranných, sekrečních či vylučovacích procesech, přičemž jejich schopnosti nemusí být u všech druhů totožné.[36][44][45]
Tělní stěna a pohyb[editovat | editovat zdroj]

Svalová soustava hlístic je poměrně jednoduchá, tvoří ji pouze jedna vrstva podélné svaloviny, jež je uspořádána do čtyř lišt, které oddělují lišty hypodermis (pokožky).[38] Podobně jako u strunovců se nikdy neobjevuje svalstvo okružní.[46] Zvláštností je, že u hlístic nejsou svaly inervovány výběžkem nervu ke svalu, ale naopak výběžkem svalu k nervu. Tyto výběžky, anglicky nazývané muscle arms, však nejsou pro kmen hlístic jedinečné, vyjma nich se objevují například u zástupců kmene břichobrvek.[39] Každá nervová buňka může být tímto způsobem spojena se stovkami svalových výběžků; například dospělci škrkavky dětské (Ascaris lumbricoides) mají okolo 50 000 svalových buněk, které jsou ovládány pouze prostřednictvím asi 250 buněk nervových.[47] Vyjma podpovrchové svaloviny lze u hlístic pozorovat i specifické svalové buňky, jež jsou asociovány s trávicí a rozmnožovací soustavou.[48]
Tělesná stěna je dále tvořena bazální membránou, vrstvou ektodermálních buněk (tj. pokožkou, jež je nazývána také epidermis, či u hlístic častěji hypodermis) a vně vylučovanou kutikulou.[38][49] Pokožka kolem těla nemá stejně silnou tloušťku, ale vytváří několik hlavních podélných lišt (jednu hřbetní, jednu břišní a dvě laterální); ty rozdělují svalstvo těla na již zmiňované čtyři sektory. Zejména v přední části těla se mohou objevovat i další, menší sekundární lišty.[50] Stavba hypodermis se mezi jednotlivými hlísticemi liší. U volně žijících druhů ji mohou tvořit jednotlivé buňky, ale zejména u velkých parazitických hlístic převládá soubuněčná neboli syncitiální hypodermis.[36]
Kutikula představuje složitou variabilní strukturu, jež pokrývá tělo a tvoří také výstelku ektodermálních částí trávicího traktu včetně ústní dutiny, hltanu či řitního otvoru.[36] Kutikula může být jednoduchá a tenká, jako u některých rostlinných parazitů, či naopak vícevrstevná, jako u některých volně žijících mořských zástupců. U samic rodu Fergusobia dokonce došlo k úplné ztrátě kutikuly.[51] Protože kutikula představuje nebuněčnou vrstvu, neroste společně s vyvíjejícím se jedincem. Pokud tedy jedinec dosáhne určité velikosti, musí starou kutikulu svléknout. U většiny druhů dochází ke čtyřem svlekům, podle nichž jsou nazývána i jednotlivá larvální stádia (L1 až L4). Existují však některé specifické případy, například u zástupců rodu Pristionchus se objevují pouze tři svleky, u jiných hlístic se může stará a nová kutikula dokonce vrstvit.[39][49][52]
Nejsvrchnější část kutikuly se nazývá epikutikula a jde o tenkou membránovou vrstvu, jež je jako první vylučována během ontogeneze a také při syntéze nové kutikuly v průběhu svlékání. Z biochemického hlediska je epikutikula tvořena nekolagenními proteiny a lipidy, překrývat ji navíc ještě může glykokalyxový plášť. Ten zřejmě představuje určitou formu lubrikantu a také svého nositele chrání před napadením mikrobiálními organismy. Zbývající vrstvy kutikuly tvoří především proteiny na bázi kolagenu; naopak chitin, převažující v kutikule členovců, až na specifické případy chybí.[49][53] Na kutikule hlístic lze pozorovat četné ornamentální struktury, například různé rýhy (jež mohou budit dokonce dojem segmentace), trny, papily, ale dokonce i větší vystupující útvary, jež jsou nazývány křídla.[36]
Přítomnost pouze podélného svalstva hlísticím znemožňuje měnit průměr těla. K pohybu proto dochází pouze prohýbáním („mrskáním“) těla do stran, což zapříčiňují střídavé kontrakce a relaxace protilehlých svalových sektorů. Hydrostatický skelet i kutikula se podílejí na produkování antagonistických sil vůči svalovým stahům. Hlístice se díky tomu může pohybovat vpřed. K pohybu tito červi většinou vyžadují přítomnost pevného substrátu.[41][54]
Trávicí soustava[editovat | editovat zdroj]

Trávicí soustava hlístic je trubicovitá a úplná.[38] Samotná trávicí trubice se skládá ze tří částí. Střední část, vlastní střevo mezenteron, je entodermálního původu, zatímco přední stomodeum a zadní proktodeum vznikají z ekto- a mezodermálních buněk.[55]
Ústní dutina bývá většinou umístěna na konci, či výjimečně před koncem přední části těla. Začátek ústního otvoru může ohraničovat několik pohyblivých pysků neboli labií. Jejich rozmístění je radiálně symetrické: jeden pysk je obvykle na svrchní (dorzální) a dva na spodní (ventrální) straně úst. Objevují se však i jejich rozličné fúze či modifikace.[56][57] Charakteristiky ústní dutiny se mohou značně lišit v závislosti na přijímané potravě. Druhy lovící mikroorganismy mohou mít pouze nevýraznou, trubicovitou ústní dutinu, zatímco všežraví zástupci vlastní širší, nálevkovitou ústní dutinu. U dravých hlístic lze pozorovat mohutnou ústní dutinu, jež je vyzbrojena strukturami připomínajícími zuby. Výjimkou není ani přeměna na dutou bodcovitou strukturu: stylet neboli stomatostyl. Ten je typický pro fytopatogenní druhy, u nichž slouží k průniku do rostlinných pletiv. Objevuje se nicméně i u parazitů hmyzu, jimž napomáhá k překonání chitinové kutikuly svých hostitelů.[54][57]
Na ústní dutinu navazuje válcovitý hltan (farynx), někdy nesprávně nazývaný jícen (oesophagus).[57] Lumen hltanu má v řezu typický tvar písmene Y.[58] Hltan funguje jako savá pumpa: lumen hltanu se koordinovaně uzavírá před polykanou potravou, a naopak otevírá za polykanou potravou, čímž se vytváří podtlak. Vlny střídavých kontrakcí a relaxací hltanových svalů tímto způsobem posouvají potravu směrem do střev. Hltan se typicky skládá i ze žláznaté části. Produkty hltanových žláz napomáhají trávení, ale mohou mít i další funkce. Například u některých parazitických hlístic, jako je svalovec stočený (Trichinella spiralis), se objevuje žláznatá tkáň stichosom, jejíž výměšky umožňují přetvářet tkáně napadených hostitelů.[57][59][60]
Na hltan navazuje hlavní část střeva – mezenteron, tenkostěnná trubice bez význačnějšího osvalení. Střevo může být různě diferenciované, včetně přítomnosti postranního výběžku na jeho předním či zadním konci (slepé střevo). Proces trávení zpočátku probíhá extracelulárně, následně dochází ke vstřebání živin prostřednictvím mikroklků střevních buněk a k intracelulárnímu trávení. Trávicí trubice ústí v případě samic na konci těla řitním otvorem, u samců se objevuje společný kloakální vývod trávicí a rozmnožovací soustavy.[39][56][61]
Vylučovací soustava[editovat | editovat zdroj]

Vylučovací soustava u hlístic není v rámci jednotlivých skupin strukturálně shodná, ačkoli z obecného hlediska ji lze rozdělit na dva základní typy; na základě morfologie vylučovacích struktur lze přičemž odvodit i pravděpodobné evoluční pořadí jejich vzniku. Za původní je považován vylučovací systém pozorovaný u množství volně žijících, často sladkovodních druhů, jenž se skládá z jedné nebo dvou žláznatých buněk, tzv. renet, které se přímo napojují na vylučovací pór na povrchu kutikuly. Vylučovací pór se často otevírá na spodní straně těla, typicky ve faryngeální nebo přední intestinální oblasti.[42][62]
Pokročilejší typ vylučování zajišťuje soustava specifických lišt, které se táhnou z boční strany těla mezi lištami pokožky a jež zahrnují podélné nitrobuněčné kanálky. Skrze ně je osmoticky přijímána tělní tekutina a následně resorbována voda a potřebné sloučeniny, zatímco zbylý obsah hlístice vylučují do okolního prostředí. Kanálky se běžně spojují v nepárový vývod, jenž se otevírá v první třetině těla. U některých hlístic fungují společně jak lišty, tak renety. Jiné hlístice, považované v tomto ohledu za fylogeneticky nejodvozenější, zachovávají pouze systém lišt.[39] Vylučovací soustava hlístic představuje modelový příklad tubulárních struktur, které jsou tvořeny jenom minimem buněk. Například u háďátka obecného se po celé délce těla táhne systém na konci uzavřených kanálků, jež připomínají tvar písmene H – celá tato komplikovaná struktura přičemž vychází z jediné buňky.[40][63]
Hlavní a původní funkce vylučovací soustavy je nejspíše osmoregulační, jakožto snaha vyrovnat se s hypotonickým prostředím. Přebytečný dusík hlístice vylučují přes stěnu středního střeva v podobě amoniaku nebo močoviny.[42][62]
Nervová soustava a smysly[editovat | editovat zdroj]

Hlavní centrum nervové soustavy hlístic představuje nevýrazný obhltanový prstenec, z něhož dopředu a dozadu vybíhají páry podélných nervových provazců, které jsou umístěny v hypodermálních lištách a jež mohou být spojeny prostřednictvím spojek neboli komisur. Na dvě hlavní nervové větve ve hřbetní a břišní liště se napojují svalové výběžky, čímž je zajištěna inervace většiny podélné svaloviny těla. Nervové větve vybíhající dopředu zajišťují inervaci různých senzorických struktur v přední části těla. Nervová ganglia na zádi inervují řitní otvor a pohlavní orgány.[38][48][64]
Smyslové orgány hlístic jsou omezeny většinou na různé typy mechanoreceptorů a chemoreceptorů. Jejich velikost, tvar, poloha a prostorové uspořádání jsou charakteristické pro jednotlivé druhy nebo vyšší taxony, a mohou být tedy užity jako taxonomický znak. V některých případech se mezi smyslovými orgány objevuje i pohlavní dimorfismus.[65] Většina klíčových mechano- či chemoreceptorů se nachází v přední části těla. Hlavní smyslové struktury představují takzvané amfidy, což jsou jamkovité útvary, které vznikají silným inervováním invaginované kutikuly. U háďátka obecného je každý amfid inervován 12 nervovými buňkami.[64][66] Pro některé hlístice je typická i přítomnost tzv. fazmidů, podobných kutikulárních žlázových struktur, jež jsou umístěny za řitním otvorem a otevírají se na povrch štěrbinou nebo pórem. Fazmidy představují sdílený znak, na základě něhož byla vytyčena třída hlístic Phasmidia (později Secernentea, nyní Chromadorea).[67] Z dalších smyslových struktur hlístic lze zmínit například deiridy (párové papily umístěné bočně v blízkosti nervového prstence), postdeiridy (podobné struktury ve střední části těla) nebo senzorické papily, které vyrůstají poblíž pohlavního ústrojí samců.[48][65]
Převážně u vodních hlístic lze pozorovat i pravděpodobné receptory světla v podobě pigmentových skvrnek, jež mohou být doplněny kutikulárními strukturami s funkcí optické čočky. Ve vzácných případech, jako u hlístic z rodu Diplolaimella, byla objevena „pravá“ čočka tvořená amorfním materiálem.[65][68][69] Alespoň některé druhy hlístic navíc dokáží vnímat barvy, aniž by měly pravé struktury na bázi očí a exprimovaly opsinové proteiny, jež představují bílkovinnou část zrakových pigmentů u většiny známých živočichů. Podobná schopnost byla experimentálně prokázána u modelového háďátka, jež rozeznává jak viditelné, tak ultrafialové složky elektromagnetického spektra.[70][71][72]
Rozmnožovací soustava a rozmnožování[editovat | editovat zdroj]

Vnitřní pohlavní orgány jsou u obou pohlaví trubicovité, poměrně jednoduše stavěné. Samčí varlata (jedno nebo dvě) jsou nitkovitého tvaru, oproti navazujícím strukturám mají relativně silnou stěnu a tenčí odvodný kanálek.[64] Kanálek se postupně zvětšuje do podoby sběrného semenného váčku a prostřednictvím svalnatého ejakulačního kanálku ústí společně s vývodem trávicí trubice do kloaky na zadní části těla. Do ejakulačního kanálku mohou u některých druhů ústit přídatné prostatické žlázy.[73] Samičí gonády jsou tvořeny podobně tenkými vaječníky, typicky opět jedním nebo dvěma, zřídkavěji ale i větším počtem. Každý vaječník se rozšiřuje do podoby vejcovodu a následně prostorné dělohy. Větve dělohy společně ústí do jednoho gonoporu, jenž je oproti samčímu vývodu zřetelně oddělen od řitního otvoru.[52][73] Samičí pohlavní otvor se nachází v přední polovině spodní části těla.[38]
Specifickými vnějšími pohlavními orgány samců jsou tzv. spikuly. Jde o jehlicovité či tyčinkovité kutikulární útvary, které většinou vyrůstají párově. Ke spikulům bývají přidruženy i další struktury, které zajišťují jejich pohyb či správnou orientaci. Jednou z nich je tzv. gubernakulum, kutikulární ztluštěnina spodní části spikulárního váčku.[52] Během kopulace se spikula stávají rigidními a samci se pomocí nich ukotvují v gonoporu samice. Vytvoří se tak kanálek pro snadný přenos ejakulátu. Přidružen navíc může být i specifický ploutvičkovitý orgán, tzv. kopulační burza, která samičí gonopor během kopulace přímo obaluje.[64][74] Některé hlístice mohou mít spikuly různě modifikovány: například u zástupců rodu Rhabditis srůstají, u rodu Myolaimus pak dokonce zcela scházejí.[75]

Hlístice jsou obvykle pohlavní gonochoristé, přičemž u většiny druhů je pohlaví podmíněno geneticky, a sice prostřednictvím pohlavních chromozomů (karyotyp XX pro samice a XY pro samce). U některých parazitů se na determinaci pohlaví podílejí i vlivy prostředí.[76]
Tento obecný vzorec však zahrnuje řadu výjimek. Háďátka rodu Caenorhabditis, včetně modelového háďátka obecného, se například dělí na hermafrodity s karyotypem XX a samce s karyotypem X0. V takovém případě determinace pohlaví není zajišťována přítomností zvláštního pohlavního chromozomu, ale poměrem autozomů vůči pohlavním chromozomům.[76] Pokud jsou hlístice hermafrodity, obvykle jde o hermafrodity tzv. proterandrické, kdy tvorba spermií předchází produkci vajíček. Spermie si takový hermafrodit může uchovat do doby dozrání vajíček a následně praktikovat samooplození.[73] U extremofilních hlístic rodu Auanema ze severoamerického jezera Mono se dokonce objevují všechny tři typy pohlaví: samci, samice i hermafrodité, což těmto červům nejspíš umožňuje lépe kombinovat výhody samooplození i vzájemného pohlavního rozmnožování (amfimixie).[77][78] Některé hlístice se pak rozmnožují i partenogeneticky, přičemž v některých případech spermie pouze stimuluje rýhování vajíčka, ale nikterak nepřispívá do genotypu vznikajícího jedince.[73]
Aby se hlístice mohly spářit, musí se nejprve vzájemně lokalizovat. Toho většinou dosahují prostřednictvím chemických atraktantů neboli feromonů, produkovaných zejména samicemi. Při samotné kopulaci dojde ke spojení samčího pohlavního ústrojí se samičím gonoporem, čemuž napomáhají spikuly a další zmiňované struktury, v některých případech i produkce lepivých sekretů.[73][79] Samci hlístic během kopulace předávají samicím buďto již zralé spermie, anebo spíše sekundární spermatocyty, jež dozrávají teprve v samičím pohlavním ústrojí. Spermie hlístic se různí co do tvaru a velikostí, ale vždy jsou nebičíkaté a obvykle mají měňavkovitý tvar.[73][79] Většina hlístic produkuje četné malé spermie, některé však jen několik velkých spermií. Raritní je pak produkce spermií obou typů v rámci jednoho jedince; tento fenomén se objevuje například u druhu Axonolaimus helgolandicus.[80] Délka kopulace se pohybuje od několika minut po několik dnů.[79] Extrémní případ představuje parazit ptáků srostlice trvalá (Syngamus trachea), u něhož oba dospělci společně svými pohlavními otvory srůstají, a vytvářejí tak strukturu podobnou písmenu Y.[81]
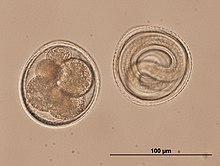
K oplodnění dochází buďto v děloze samice, anebo již ve vejcovodu. V děloze následně dochází ke vzniku vnějších, vícevrstevných vaječných obalů. Zralé vajíčko nakonec chrání mechanicky i chemicky odolný obal chitinózního a lipoidního charakteru. Vajíčko bývá co do tvaru většinou oválné či kulovité, častá je přítomnost různých struktur na povrchu, jako jsou pólové zátky či víčka.[52][64] Vajíčka většiny hlístic jsou si vzhledem velmi podobná; výjimku představují někteří zooparazité, u jejichž skupin lze ve stavbě vajíček pozorovat podstatné rozdíly, což může posloužit i jako diagnostický znak. Například kulovitá vajíčka škrkavek lze poměrně snadno odlišit od soudečkovitých vajíček tenkohlavců, která vynikají výraznými pólovými zátkami. Pozoruhodná vajíčka klade i strunice Mermis nigrescens, v jejímž případě jsou póly vajíček pokryty rozvětvenými vlákny.[82]
Embryonální vývoj hlístic byl probádán do velkých detailů, alespoň co se týče modelového háďátka obecného. Zvláštností hlístic je fakt, že alespoň některé tkáně mnohých druhů bývají tvořeny shodným počtem buněk v každém dospělém jedinci – u hermafroditního háďátka je to 959. Tento fenomén se označuje jako eutelie a je také vysvětlením toho, proč mají takové hlístice, například ve srovnání s ploštěnkami, mizivou schopnost regenerace.[64] Samotné líhnutí vajíček je indukováno vnějšími podmínkami, většinou teplotou. U parazitických druhů může být podobným stimulem pozření ze strany hostitele.[83] Někdy se vajíčka mohou líhnout již přímo v těle samice a v některých extrémních případech zde probíhá i další vývoj nedospělých jedinců, kteří se živí vnitřními orgány matky a získávají od ní živiny. Postupně ji tak zahubí a následně se rozptýlí do prostředí. Příkladem této tzv. matricidní endotokie je hádě ropuší (Rhabdias bufonis).[73][84]

Vývoj hlístic probíhá přes juvenilní stádia, jež jsou nazývána také termínem larva (zkratkou L1 až L4, se stádiem vajíčka a dospělce jde tedy o 6 fází životního cyklu). Nejedná se však o larvu, tj. nepřímý vývoj podobný holometabolnímu hmyzu, v pravém slova smyslu. Jednotlivá juvenilní stádia odděluje pouze svlékání staré a tvorba nové kutikuly, svým vzhledem jsou si ale podobná, až na postupné zvětšování velikosti, proporcionální změny různých orgánů a vývoj gonád a druhotných pohlavních znaků. Růst larev u eutelických druhů navíc probíhá pouze zvětšováním původních buněk, po vylíhnutí z vajíčka již nevznikají žádné buňky nové. Vajíčka většinou opouští L1; ve vzácných případech, jako u strunic, probíhá první svlek ještě ve vajíčku, které tak opouští až L2.[83][85]
Fenomén typický především pro hlístice řádu Rhabditida je tzv. dauer larva. Jde o alternativní larvální stádium, L3, která si zachovává kutikulu ze stádia L2 a dočasně pozastaví svůj vývoj. Dauer larvy vykazují morfologické, fyziologické a behaviorální adaptace nepřítomné u ostatních larválních stádií, díky čemuž jsou schopny odolávat různým stupňům environmentálního stresu. Ochotně také adherují k povrchu těla různých živočichů, zvláště hmyzu, a díky tomu se mohou snáze rozptylovat do okolí. U háďátka obecného je vznik dauer larvy stimulován nedostatkem potravy, vysokou teplotou prostředí a vysokou populační hustotou.[86][52] Z dauer larev se nejspíše evolučně odvozují i infekční stádia u mnohých zooparazitických hlístic ze třídy Chromadorea; ty totiž napadají své hostitele právě ve fázi L3. U zbylých zooparazitických hlístic převažuje stádium L1[52] a u strunic (Mermithida), jež napadají členovce, je infekčním stádiem L2.[87] Zajímavým fenoménem, typickým např. pro některé měchovce či trichostrongylidní hlístice, je pak tzv. hypobióza. Ta označuje situaci, kdy vývoj larev v hostiteli ustrne až do ideálních podmínek pro šíření larválních stádií nové generace: u infekcí savců se například typicky shoduje s porody jejich mláďat.[88][89]
Ekologie[editovat | editovat zdroj]

Celkový počet popsaných hlístic činil k roku 2013 asi 30 000 druhů, toto číslo je nicméně jenom malým zlomkem ve srovnání s předpokládaným počtem skutečně žijících druhů, jenž může činit až 1 milion,[90] či dokonce více než 100 milionů druhů.[6] Vyjma volně žijících druhů je nutno započítávat i obrovské množství předpokládaných parazitů, protože většina druhů suchozemských rostlin a větších živočichů hostí alespoň jednoho parazita z kmene hlístic. Odhady počtu parazitických hlístic se jenom v případě obratlovců odhadují na asi 24 000 druhů, nepočítaje parazitické hlístice ostatních druhově bohatých skupin živočichů, jako je hmyz.[91] Odhady diverzity navíc komplikuje fakt, že velké množství popsaných druhů zůstává tzv. kryptických; takové druhy jsou si sice morfologicky podobné, ale vykazují odlišnosti na genetické úrovni.[92]
Vyjma celkového počtu druhů patří hlístice i mezi nejpočetnější živočichy na Zemi vůbec; podle některých odhadů tvoří asi tři čtvrtiny pozemské fauny[92] a jejich celkový počet je odhadován na 4,4 ± 0,64 × 1020, tedy zhruba 60 miliard na každého člověka na Zemi.[93] Co se týče přirozených stanovišť, hlístice jsou rozšířeny ve sladkých i mořských vodách a v pevninských ekosystémech, od pólů po tropické oblasti a ve všech nadmořských výškách. Pro svůj růst a rozmnožování však vyžadují přítomnost pevného podkladu, proto přirozeně nežijí v otevřeném oceánu (kam však mohou být náhodně zaneseny proudy).[92][6] V řadě ekosystémů mohou hlístice jako taxonomická skupina dominovat. Jde například o nejhojnější a nejbohatší živočišný kmen v mnoha mořských sedimentech, a to včetně abysálu.[91] V některých půdních prostředích mohou žít až 3 miliony hlístic na čtvereční metr.[6] V takových počtech mají významný vliv na formování ekosystémů a biochemické cykly. Například půdní hlístice se podílejí na rozkladu a koloběhu živin a významně přispívají k mineralizaci dusíkatých sloučenin, které jsou tak snadno dostupné pro rostliny. Tato schopnost byla prokázána i prostřednictvím experimentálních studií.[94]
Celá řada hlístic spadá mezi extremofily, k čemuž jim napomáhá jak vlastní odolnost, tak možnost vytvářet odolná stádia, jako jsou cysty, nebo podstupovat anabiózu. Tyto schopnosti z mnohých hlístic dělají jedny z nejhouževnatějších živočichů vůbec. Například hádě octové (Turbatrix aceti) úspěšně toleruje pH v extrémním rozsahu hodnot 2,5–11,5.[95] Jiné druhy zase snášejí extrémně vysoké teploty: háďátko rodu Aphelenchoides žije v horkých pramenech, jejichž teplota překračuje 60 °C, přičemž mezi živočichy je taková schopnost extrémně vzácná.[96] Objevuje se i tolerance vůči některým toxickým látkám. Hlístice například představují dominantní skupinu živočichů v severoamerickém jezeře Mono, jenž se vyznačuje extrémní salinitou a přítomností arsenu, přičemž místní druhy tolerují až 500násobné množství arsenu, než je smrtelná dávka pro člověka.[77] Roku 2011 oběhla svět zpráva o hlístici Halicephalobus mephisto, jež byla objevena ve vodě z podzemních vrtů sahajících do hloubek 0,9–3,6 km, čímž se tento červ stal nejhlouběji žijícím známým mnohobuněčným organismem.[97][98] Hlístice Plectus parvus a Panagrolaimus detritophagus pak byly objeveny ve 30 000–40 000 let starém permafrostu, přičemž i po takto dlouhé době kryobiózy došlo k jejich opětovnému oživení.[99][100][101]
Potrava[editovat | editovat zdroj]

Hlístice se, v závislosti na druhu, živí širokým spektrem potravy. Potravní preference se odrážejí i ve stavbě ústní dutiny a hltanu, který se mezi jednotlivými druhy liší svou komplikovaností, rozčleněním či výstelkou. Mezi volně žijícími hlísticemi převažují bakteriofágní druhy, řada hlístic se živí také mykofágně či detritivorně, případně jsou konzumenty řas či malých živočichů. Výjimkou nejsou ani hlístice představující predátory jiných hlístic. Některé hlístice žijí na tělech či v tělech mrtvých organismů, případně na výkalech; většinou se však neživí přímo touto rozkládající se organickou hmotou, ale právě spíše místními populacemi bakterií či hub. Zajímavý příklad symbiózy poskytují hlístice z podčeledi Stilbonematinae, jež si na své kutikule vydržují kolonie bakterií oxidujících síru. Tímto způsobem si „pěstují“ trvale dostupný zdroj potravy, z něhož jsou schopny v případě potřeby čerpat.[56][95]
Strava zooparazitických hlístic se většinou skládá z krve, hlenu a jiných tělesných tekutin, popřípadě střevního obsahu parazitovaných hostitelů.[74] Patogenní vliv na hostitele se může odvíjet podle úrovně parazitace. Například u vážných infekcí měchovci lidskými (Ancylostoma duodenale), kteří se usazují v tenkém střevě, mohl nakažený člověk vlivem poškození střevní tkáně ztrácet až 300 ml krve/den.[81] Fytopatogenní háďátka se pak živí nabodáváním rostlinných buněk a vysáváním buněčného obsahu. K tomu jim napomáhá ostrý stylet, jejž mohou řízeně vytahovat a zatahovat.[74]
Některé hlístice již v dospělosti nepřijímají potravu vůbec. Řadí se sem například strunice, které žijí výhradně ze zásob nashromážděných během parazitické životní fáze ve členovcích – tuto vlastnost mají mj. shodnou právě se strunovci.[81] Volně žijící hlístice rodů Artomonema a Parastomonema přechovávají ve svých vysoce redukovaných střevech symbiotické chemoautotrofní bakterie, přičemž produkty jejich metabolismu pokrývají hlísticím všechny potřebné živiny.[56]
Životní cykly parazitických hlístic[editovat | editovat zdroj]
Zooparazité[editovat | editovat zdroj]

Velké množství hlístic patří mezi parazity jiných druhů živočichů. Parazitismus si nezávisle na sobě vyvinulo mnoho vývojových linií hlístic, jejich zástupci přičemž napadají široké spektrum živočichů, od bezobratlých po obratlovce. Životní cykly parazitických druhů mohou být značně komplikované. Pokud vyjma definitivního hostitele v cyklu vystupují i mezihostitelé, lze takové hlístice označit jako tzv. biohelminty.[52] Ve vývojových cyklech se navíc často objevují i hostitelé parateničtí, v nichž sice nedochází k vývoji parazita, ale kteří mohou představovat mezičlánky během přenosu jednotlivých stádií mezi různými hostiteli.[102] U některých hlístic navíc dochází ke střídání parazitických a volně žijících generací, přičemž každá z nich může vykazovat jinou reprodukční strategii: volně žijící generace bývá obvykle gonochoristická, zatímco parazitická generace může být spíše hermafroditní či partenogenetická. Příkladem takového způsobu života je hádě střevní (Strongyloides stercoralis).[95] S podobným fenoménem se navíc může pojit i zvláštnost, že vajíčka volně žijících a parazitických forem mohou mít různou velikost: například hlístice Deladenus siricidicola, jež parazitují na pilořitkách, mívají menší vajíčka ve srovnání se svými volně žijícími protějšky. Tato situace kontrastuje s obecným pravidlem, že většina hlístic klade velikostně podobná vajíčka i v případě různě velkých dospělců.[82]
Samotný rozmnožovací potenciál parazitických druhů může být enormní. Například měchovci z rodu Necator kladou až 15 000 vajíček za jediný den, u škrkavek rodu Ascaris jde až o 200 000 vajíček. Vzhledem k obrovskému množství potomků, z nichž se však jen část dožije pohlavní dospělosti, může přirozený výběr probíhat velmi efektivně, s velmi rychlou evolucí adaptivních znaků.[103]
Hlístice infikují své hostitele rozličnými způsoby. Typickou možností je nákaza alimentární cestou. Podobný životní cyklus lze demonstrovat na jednoduchém případu roupa dětského (Enterobius vermicularis), jehož definitivní hostitel – člověk – se nakazí pozřením drobných vajíček. Dospělí roupi se lokalizují v tlustém střevě, samice kladou vajíčka do řas konečníku. Opětovným polknutím vajíček, např. v důsledku kontaminace prostředí či nedostatečné osobní hygieny, se cyklus uzavírá.[104] U řady hlístic je však situace komplikovanější. Například larvy mnohých škrkavek mohou během svého vývoje složitě migrovat napříč orgány svého definitivního hostitele. Než infekční L3 pohlavně dospějí, přesouvají se ze střeva do dýchací soustavy hostitele, následně jsou jím vykašlány, opětovně spolknuty a teprve tehdy se definitivně usadí ve střevech. Podobná somatická migrace byla pokládána za pozůstatek po ztrátě nějakého živočišného mezihostitele u předka škrkavek, podle všeho má však rovněž adaptivní hodnotu a ovlivňuje velikost těla a plodnost dospělců.[25] Larvy některých druhů, jako je škrkavka psí (Toxocara canis), se navíc mohou opouzdřit i ve tkáních, a to jak u rozličných paratenických hostitelů, tak u svých definitivních hostitelů, tedy psů. U březích a kojících fen dochází k aktivaci těchto larev a následné přímé nákaze štěnat transplacentárně či laktogenně.[105]

Další hlístice, jež se spoléhají na čistě alimentární přenos, zahrnují ve svých životních cyklech mezihostitelské druhy, resp. paratenické hostitele. Například vlasovci medinští (Dracunculus medinensis) využívají ke svému přenosu vodní korýše buchanky, jež musí polknout infekční L1. Vypitím vody s buchankami se nakazí člověk, potažmo některý jiný savčí hostitel. Dospělé samice vlasovců se lokalizují v podkožních boulích, odkud v případě, že je hostitel ponoří do vody, vysunou přední část těla a následně vypouští do okolí infekční L1.[106][107] V některých vzácných případech může dojít k dokončení vývoje parazita již v mezihostiteli: hlístice Rhabdochona praecox běžně parazitují na rybách, ačkoli mohou dokončit vývoj a pohlavně se rozmnožovat i ve sladkovodních krabech.[108][109] Zcela výjimečný životní cyklus lze pozorovat u svalovce stočeného (Trichinella spiralis). Svalovci mají široké spektrum savčích hostitelů, přičemž každý z nich vystupuje zároveň jako definitivní hostitel i mezihostitel. Pohlavní rozmnožování parazita probíhá v tenkém střevě, vzniklé larvy následně pronikají do příčně-pruhované svaloviny, kde se opouzdřují v odolných cystách. Další hostitel se nakazí konzumací infikovaného masa. Svalovci tedy nemají žádná volně žijící stádia, a to včetně vajíček.[110]

Některé larvy hlístic mohou do těla hostitele pronikat aktivní cestou. L3 měchovce lidského (Ancylostoma duodenale) typicky invadují pokožku svých hostitelů a přes oběhovou soustavu následně pronikají do plic. Podobně jako u škrkavek dochází k jejich vykašlávání a polknutí, dospělci se pak lokalizují v tenkém střevě.[111][104] Infekční stádia strunic (L2) zase aktivně pronikají do tělních dutin různých bezobratlých, převážně členovců. Zde prodělávají relativně rychlý vývoj a svého hostitele opouštějí ještě jako nedospělé L3. I zde se lze opětovně setkat s fenoménem paratenických hostitelů: strunice rodů Aranimermis a Phomermis napadají nedospělá vývojová stádia vodního hmyzu, přečkají jeho metamorfózu, a prostřednictvím těchto druhů se mohou dostávat do těl různých suchozemských členovců, pokud je takový hostitel uloví a sežere.[109]
Konečně, některé hlístice využívají ke svému šíření i krevsající mezihostitele. Hmyzí vektory se typicky objevují u hlístic ze skupiny spirury, konkrétně u vlasovců. Infekční L3 vlasovců pronikají během sání do krevního řečiště nebo lymfatického systému definitivního hostitele, v jehož těle dospějí a následně se pohlavně rozmnožují. Výsledkem pohlavního procesu jsou tzv. mikrofilárie (L1), jež čekají na opětovné nasátí ze strany mezihostitele. Zajímavostí je, že vyplavování mikrofilárií do periferní krve se může řídit denní aktivitou hmyzích hostitelů. Pokud jsou mezihostiteli komáři, jako u vlasovce mízního (Wuchereria bancrofti), mikrofilárie mají tendenci vyplavovat se v noci; naopak u vlasovce očního (Loa loa), jehož vektory jsou ovádovití, dochází k vyplavování během dne.[112][113]
-
Cyklus roupa dětského
-
Cyklus škrkavky psí
-
Cyklus svalovce stočeného
-
Cyklus vlasovce mízního
Fytopatogeny[editovat | editovat zdroj]
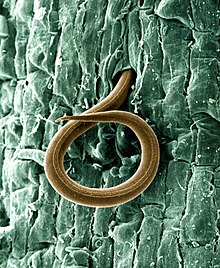
Především mezi zástupci podčeledi Tylenchoidea lze objevit řadu fytopatogeních druhů, které cizopasí na rostlinách, přičemž k průniku do rostlinných buněk a pletiv jim napomáhá bodcovitý stylet. Řada těchto parazitických háďátek žije pouze na povrchu kořenů a živí se sáním rostlinných šťáv, lze je tedy považovat za ektoparazity. Někteří ektoparazité se mohou na jedné buňce či části kořene krmit delší dobu, jiní se po povrchu přesouvají. Řada druhů se pak evolučně vyvinula k pronikání do rostlinných pletiv celým svým tělem. Mezi nimi vynikají tzv. sedentární endoparazité, kteří jsou schopni přetvářet hostitelské kořenové buňky na specializované buňky potravní.[114]
Příklad takového životního cyklu dávají hlístice rodu Meloidogyne. Infekčním stádiem pro rostliny je pohyblivá L2, jež napadá rostoucí kořenové špičky, jejichž infikované buňky se zvětšují a přetvářejí na velké uzlíkovité struktury.[115] V nich dochází k dalším třem svlekům až po stádium dospělce, přičemž osud dospělých hlístic závisí na pohlaví: zatímco samci zůstávají v podobě „červa“ a kořen opouštějí, samice se zde dále krmí a jejich tělo postupně získává hruškovitý tvar. U těchto fytopatogenů se lze setkat i s častou partenogenezí; samců a pohlavního rozmnožování většinou využívají pouze v méně příznivých podmínkách, kdy je z pohledu evoluční biologie obecně výhodnější produkovat geneticky variabilnější potomstvo.[116]
Podobně jako v případě zooparazitů, i některé fytopatogeny mohou ke svému přenosu využívat jiných organismů: například přenos háďátka borového (Bursaphelenchus xylophilus) je úzce spjat s tesaříky rodu Monochamus. U háďátka borového se objevují dva typy životního cyklu: mykofágní, probíhající v tlejícím dřevě, a fytofágní, kdy se hlístice živí buňkami pryskyřičných kanálků v živých stromech, které následně odumírají. Přenos mezi jednotlivými stromy zajišťují právě tesaříci, jejichž životní cyklus je rovněž spojen s tlejícím dřevem.[117][118]
Rozšířený fenotyp a parazitární manipulace[editovat | editovat zdroj]
Podobně jako u jiných parazitických skupin lze i u hlístic pozorovat rozličné metody, pomocí nichž se snaží hostitele co nejvíce využít ve svůj prospěch – tedy různé případy rozšířeného fenotypu.

Mezi jednu z typických schopností parazitických hlístic je zmiňované přetváření napadaných buněk. Sedentární endoparazitická hádátka využívají sekretů vylučovaných hltanovými žlázkami k tomu, že mění povahu buněk napadaných rostlin. Sekrety jsou schopny ovlivňovat fyziologické procesy v buňce a mají vliv jak na její buněčný cyklus, tak genovou expresi v buněčném jádře. Například kořenové buňky napadané zmiňovanými háďátky Meloidogyne sp. se díky tomu modifikují ve velké soubuněčné struktury, přičemž provázanost mezi takto přetvořenými buňkami a háďátky je natolik úzká, že pokud háďátko zahyne, jde i o konec parazitovaných buněk.[114][115] Přetvářet hostitelské buňky však dovede i řada zooparazitů. Larvy svalovců vnikají do vláken příčně-pruhované svaloviny, přičemž invadovaná vlákna následně ztrácejí kontraktilní elementy, jako je aktin a myosin, a zvětšují se do podoby kolagenní cysty, kterou navíc zásobuje nově se tvořící síť vlásečnic.[119]

Mnoho parazitů je schopno účelně manipulovat se svými hostiteli, aby mohli snáze dokončit svůj životní cyklus. Podobně je tomu i u některých hlístic. Například strunice Thaumamermis zealandica takto mění chování svého hostitele, novozélandského korýše Bellorchestia quoyana, jenž systematicky spadá do řádu různonožců. Během dne se tento korýš zahrabává do písku, nicméně studie z roku 2004 zjistila, že nakažení různonožci se vlivem vyšší osmolality hemolymfy zavrtávají hlouběji ve srovnání s různonožci zdravými. Písek ve větších hloubkách bývá totiž zpravidla vlhčí, přičemž právě vlhké prostředí strunice vyžadují ke svému dalšímu vývoji.[120] Hlístice Myrmeconema neotropicum z čeledi Tetradonematidae zase představují parazity stromových mravenců Cephalotes atratus. U napadených mravenčích dělnic dochází ke změně chování i vzhledu: zatímco zdravý mravenec má zadeček černý, u infikovaných mravenců je jasně červený. Vzhledem tak připomíná jedlou bobuli, což zřejmě přitahuje plodožravé ptáky.[121]
V některých případech parazitické hlístice své hostitele cíleně vykastrují; tím, že jim zamezí v rozmnožování, přesměrují jejich energetické zdroje na růst či regeneraci, díky čemuž hostitelé ve výsledku poskytují samotným parazitům lepší zázemí. Zajímavou ukázku takového kastrátora představují samice hlístic z rodu Sphaerularia, které napadají blanokřídlý hmyz. Příkladem je bachorovka čmeláčí (Sphaerularia bombi), jejíž dospělé samice infikují zimující královny čmeláků. Na jaře, kdy se královny probouzejí z hibernace, procházejí bachorovky dramatickým vývojem. Jejich pohlavní ústrojí se zvětšuje natolik, že se stává až 300krát objemnější než dospělý červ. Napadené královny naopak ztrácejí rozmnožovací schopnost a mění se také jejich chování: namísto toho, aby pátraly po místech vhodných k vybudování hnízda, vyhledávají potenciální zimoviště, kde dochází k ukládání larev. Ty zde dokončují svůj vývoj, páří se a čekají na nového hostitele.[122]
Další mezidruhové vazby[editovat | editovat zdroj]

Hlístice se mohou stát kořistí rozličných predátorů, ať už se jedná o jiné dravé hlístice, ploštěnky, korýše či i větší obratlovce (ryby). Pokud hlístice figurují jako vnitřní parazité jiných živočichů, často bývají uloveny společně se svými hostiteli, jako například strunice v parazitovaných členovcích.[123] Volně žijící hlístice jsou též loveny četnými druhy tzv. nematofágních hub; červi jsou jimi nalákáni prostřednictvím chemických atraktantů, polapeni různými typy pastí, jako jsou „stahovací“ kroužky nebo lepivé struktury, a následně napadeni houbovými hyfami. Některé nematofágní houby paralyzují svou kořist namísto mechanických pastí jedy: příkladem je hlíva ústřičná (Pleurotus ostreatus), jež k tomuto účelu využívá 3-oktanon.[90][124]
Hlístice mohou být pochopitelně napadány množstvím různých parazitů, výjimkou přičemž není ani hyperparazitismus, kdy parazitické hlístice hostí jiné druhy parazitů. Například u škrkavek rodu Ascaridia, jež parazitují na domácí drůbeži, byla popsána infekce mikrosporidiemi.[125] V některých případech mohou hlístice vystupovat jako vektory různých onemocnění: např. hlístice rodu Xiphinema mohou přenášet některé rostlinné patogeny, jako je virus kroužkovitosti tabáku.[126]
Další pozoruhodný ekologický fenomén představují svazky mezi parazitickými hlísticemi a některými symbiotickými bakteriemi. Například mnoho vlasovců si v nitru svých buněk pěstuje symbiotické bakterie rodu Wolbachia, jejichž přítomnost je potřebná ke správnému vývoji, životaschopnosti a plodnosti dospělců. Do nové generace jsou tyto bakterie předávány skrze reprodukční systém samic, tedy tzv. transovariálně.[127] Na přítomnost bakteriálních symbiontů spoléhají ve svých životních cyklech také parazitoidní rody hlístic Steinernema a Heterorhabditis. Ty v lumen střeva přechovávají bakterie rodů Xenorhabdus a Photorhabdus, prostřednictvím nichž zabíjejí různé bezobratlé, do jejichž těla v podobě L3 pronikají. V mrtvolkách následně probíhá vícegenerační vývoj parazitoidů.[61]
Jiné hlístice naopak uzavírají mutualistické vztahy s dalšími druhy živočichů. Mnoho druhů hmyzu například sdílí hnízda s mikrobivorními hlísticemi, které zde svou aktivitou omezují růst bakterií a plísní; tyto svazky bývají druhově specifické. Dokonce i některé střevní hlístice mohou představovat spíše mutualisty než parazity, přičemž mají pozitivní vliv na střevní flóru svých hostitelů.[90]
Hlístice a člověk[editovat | editovat zdroj]
Parazité člověka[editovat | editovat zdroj]
Mezi hlísticemi se etabluje množství medicínsky významných parazitů. Vliv těchto druhů na lidský organismus je různý a závisí mj. na úrovni parazitózy: pohybuje se od asymptomatických případů přes vážná znetvoření (elefantiáza) či slepotu (onchocerkóza) až po případné úmrtí. „Kanonické“ parazity člověka shrnuje následující tabulka:

Příslušníci těchto druhů bývají vůči člověku hostitelsky specifičtí, což se týká jak střevních parazitů, tak vlasovců přenášených hmyzem, včetně W. bancrofti.[140][141] Navzdory tomu mohou infikovat i jiné obratlovce: například u roupa dětského či škrkavky dětské, jedněch z nejrozšířenějších střevních helmintů lidí, je možný jejich sporadický přenos především na jiné druhy hominoidů.[142][128][143] Měchovec lidský je schopen parazitovat u primátů, šelem i prasat.[104] Lidské druhy střevních helmintů však nemají potenciál tvořit zoonotické rezervoáry.[140] Problém přenosu na zvířata naopak může potenciálně komplikovat eradikační programy na kontrolu vlasovce medinského.[144]
Podobně jako lidské hlístice mohou infikovat jiné druhy, i člověk se může nakazit hlísticemi, které jsou primárně adaptovány infekci jiných živočichů. V jihovýchodní Asii je například rozšířen měchovec šelem a hlodavců Ancylostoma ceylanicum, jenž v tomto regionu vystupuje i jako významný parazit člověka.[131] Potenciálně velmi vážné následky může mít trichinelóza, onemocnění vyvolávané svalovci, jako je svalovec stočený, kteří představují parazity široké škály savců. Zatímco střevní fázi trichinelózy mohou provázet některé nepříjemné gastrointestinální problémy, u svalové fáze hrozí potenciální vyústění i v život ohrožující projevy, pokud larvy svalovců napadnou životně důležité dýchací svaly.[145] Některé patogenní stavy vyvolávají též hlístice, u nichž člověk nevystupuje jako hostitel definitivní, ale jako hostitel paratenický. Například infekce škrkavkou psí (Toxocara canis), případně škrkavkou kočičí (Toxocara cati) je u člověka spojena s larvální toxokarózou, onemocněním vyvolaném patogenním vlivem migrujících larev škrkavek, které se mohou lokalizovat v oku či vnitřních orgánech.[146] Z roku 2023 je zaznamenán jedinečný případ, při němž byla ženě z mozku vyjmuta 80 mm dlouhá L3 australské hlístice Ophidascaris robertsi, jejíž definitivní hostitele představují krajty.[147]
Veterinární medicína[editovat | editovat zdroj]

Mimo člověka se hlístice podílejí i na infekcích domestikovaných zvířat. Mezi veterinárně významné skupiny lze zařadit například již zmiňované škrkavky, typické především u zástupců šelem. Pro přežvýkavce jsou zase příznačné infekce hlísticemi z čeledi Trichostrongylidae, které se lokalizují v trávicí soustavě. Příkladem je vlasovka slezová (Haemonchus contortus), jež patří mezi významné patogenní hlístice ovcí a koz; z dalších zástupců lze jmenovat například rody Trichostrongylus, Nematodirus či Ostertagia. Početnou parazitickou skupinou savců jsou také tzv. „plicnivky“, sběrná skupina endoparazitů, kteří se při svém přenosu většinou spoléhají na různé mezihostitele, jako jsou plži a žížaly, či paratenické hostitele. Pozřením mezihostitele se nakazí definitivní hostitel, u něhož se dospělí červi lokalizují a rozmnožují nejčastěji v plicích. Vajíčka nebo L1 se následně dostávají do ústní dutiny, kde dojde k jejich polknutí a následnému vyloučení s trusem do okolí.[148] Pozoruhodný způsob šíření volí plicnivka Dictyocaulus viviparus, parazit typický především pro skot, jenž při vysokém stupni parazitózy působí závažné klinické projevy. Dictyocaulus nevyužívá mezihostitele, ale definitivní hostitel se nakazí přímo polknutím infekčních L3 během pastvy. Rozptyl larev, jejichž vývoj zpočátku probíhá v trusu infikovaných býložravců, zajišťuje koprofilní houba z rodu měchomršť (Priobolus); larvy invadují její výtrusnice a po jejich prasknutí jsou vyvrženy několik metrů do okolí.[149]
Konečně, některé veterinárně významné druhy pak ke svému šíření využívají také hmyzí vektory. Zřejmě nejznámější je z tohoto pohledu vlasovec psí (Dirofilaria immitis), jehož přenašečem jsou komárovití. Dospělci žijí v plicních tepnách nebo srdeční komoře psů. Výskyt tohoto parazita byl ještě na počátku 21. století omezen na regiony s teplým klimatem – v Evropě na mediterán. Vlivem lidských aktivit (urbanizace, nárůst cestování, mezinárodní obchod se zvířaty) a změn klimatu se však rozšiřuje i do severněji položených oblastí.[150] Jiným vlasovcem je např. Dirofilaria repens, jenž se lokalizuje v podkoží u psů, psovitých šelem a vzácněji u člověka a jehož výskyt byl potvrzen i na jižní Moravě.[151][152] U lidí se může D. repens vyskytovat v oku nebo v tkáních okolo očí.[153][154] Další hlísticí, která parazituje v oku u psů a vzácně u lidí, je Thelazia callipaeda. Je přenášena drobnými octomilkami Phortica variegata (Fallén, 1823) a její výskyt byl v roce 2019 potvrzen i v ČR.[155][156]
Zemědělští škůdci[editovat | editovat zdroj]

Fytopatogenní háďátka patří mezi obávané škůdce, přičemž ztráty na plodinách vyvolávané těmito druhy se ročně odhadují na 80 miliard USD. Tato čísla jsou navíc pravděpodobně podstatně podhodnocená, protože zahrnují především data z vyspělých států, které přítomnost těchto škůdců oproti rozvojovým zemím důkladněji monitorují.[116]
Celkem je známo přes 4 100 fytopatogenních druhů. Mezi nejvýznamnější škůdce se řadí háďátka rodu Meloidogyne, jež jsou rozšířena především v tropických oblastech, ale jejich dopad je celosvětový. Infikované rostliny vykazují zastavení růstu, vadnutí, změnu barvy listů a deformace kořenů. Ztráty na výnosech mohou být značné: například u rýže napadené M. graminicola činí až 87 %.[116]
Dalšími vrcholnými škůdci jsou háďátka rodů Heterodera a Globodera: řadí se sem například háďátko nažloutlé (G. pallida), háďátko bramborové (G. rostochiensis), háďátko ovesné (H. avenae), háďátko řepné (H. schachtii) či škůdce sóji Heterodera glycines. Pokles výnosů je i v tomto případě obrovský: například háďátko nažloutlé a bramborové způsobují celosvětově ztráty ve výši 9 % celkové produkce brambor. Velice obtížná se navíc ukazuje být kontrola těchto škůdců: háďátka Heterodera a Globodera totiž tvoří odolné cysty, jež mohou dlouhodobě přečkávat v půdě bez přítomnosti hostitele. Podobně je tomu i háďátek rodu Pratylenchus, parazitujících na celé škále plodin od banánovníků po obiloviny. Ta jsou schopna na mnoho měsíců kontaminovat půdu, když nepříznivé podmínky přečkávají buďto ve stádiu odolných vajíček, anebo pomocí anhydrobiózy. V Austrálii se tyto hlístice podílejí až na 30% ztrátách na úrodě pšenice.[116]
Vyjma druhů parazitujících na plodinách lze z fytopatogenních hlístic zmínit např. háďátko borové (Bursaphelenchus xylophilus), jež původně pochází ze Severní Ameriky, ale bylo zavlečeno i na jiné kontinenty. Infekce háďátky, která napadají pryskyřičné kanálky borovic, může v invadovaných areálech vést k devastaci místních ekosystémů, protože napadené stromy odumírají.[116][118] V Japonsku bylo během 20. století v důsledku napadení tímto organismem zničeno 28 % rozlohy borových porostů. V Evropě došlo k zavlečení háďátka do Portugalska, přičemž platí za obávaného škůdce, jenž podléhá eradikačním a karanténním programům, aby se zabránilo jeho dalšímu šíření na území Evropy.[117]
Ve vědeckém výzkumu[editovat | editovat zdroj]

Háďátko obecné (Caenorhabditis elegans), jež náleží do řádu Rhabditida, začalo již od 60. let 20. století vystupovat jako klasický modelový organismus. Mezi jeho hlavní přednosti patří malá velikost, snadný chov, rychlý životní cyklus, a především schopnost produkovat potomstvo jak vzájemným pohlavním rozmnožováním, tak samooplozením, což značně usnadňuje udržování jeho homozygotních linií. Další výhodu ve srovnání s jinými modelovými mnohobuněčnými organismy představuje fenomén eutelie: protože se všechny buňky háďátka se dělí kontrolovaně v přesně daném schématu a dospělci mají shodný počet buněk (959 u hermafrodita), otevírají se tak dveře mnohým výzkumům ohledně buněčné diferenciace.[157]
Díky tomu je s háďátkem spojena řada významných objevů. V roce 1998 se háďátko stalo prvním mnohobuněčným organismem, u něhož došlo ke kompletní sekvenaci genomu; celkový počet genů kódujících proteiny je asi 19 700, celková velikost genomu asi 100 Mbp.[158][159] Háďátko představuje jeden z organismů, jenž byl vynesen do vesmíru, přičemž přežilo i havárii raketoplánu Columbia.[160] Výzkumy na háďátcích přispěly k objevu či lepšímu pochopení programované buněčné smrti (Nobelova cena za fyziologii a lékařství 2002[161]); různých signálních drah vč. Wnt signalizační kaskády; neurobiologických procesů; genetické podstaty stárnutí; mikroRNA a RNA interference (Nobelova cena za fyziologii a lékařství 2006[162]) a dalších.[157] Recenzované články týkající se C. elegans shrnuje databáze WormBook.[163]
Vyjma háďátka obecného došlo k osekvenování genomů dalších hlístic, většinou parazitických druhů, jako je svalovec stočený,[164] měchovec americký[165] či některé fytopatogeny. Zajímavost z tohoto pohledu představuje Pratylenchus coffeae, škůdce banánovníku a dalších tropických plodin, jehož velikost genomu činí pouhých asi 20 Mbp a počet genů kódujících proteiny se pohybuje okolo 6 700. Nepočítaje výtrusenky jde o nejmenší známý genom mezi živočichy.[159][166]
Využití hlístic[editovat | editovat zdroj]

Pro mnoho druhů hlístic našel člověk i užitečné uplatnění. Zjevně nejvýznamnější úlohu zastávají hlístice v hubení různých škůdců: řada druhů je především v zemědělství využívána k biologické kontrole. Příklad poskytují hlístice druhu Phasmarhabditis hermaphrodita, které našly komerční uplatnění v biologickém boji proti slimákům a plzákům. Patří k druhům, jež využívají symbiotické bakterie – zde Moraxella osloensis – k zabíjení svých hostitelů, přičemž mrtvý plž pak hlístici a jejímu potomstvu poskytuje zdroj obživy.[136] Pomocí parazitických hlístic také lze kontrolovat populace bodavého hmyzu, jenž přenáší některá infekční onemocnění člověka. Mezi takové druhy se etablovaly především parazitoidní strunice: například hlístice Empedimermis cozii může jakožto parazit komárů omezovat šíření malárie, na muchničkách parazitující strunice Isomermis benevolus zase našla podobné využití při kontrole onchocerkózy (tedy onemocnění, které je samo o sobě vyvoláváno hlísticemi).[109] Objev strunic parazitujících na krevsajících plošticích z podčeledi Triatominae otevírá možnost jejich využití ke kontrole Chagasovy nemoci.[167]
Ukazuje se také, že vliv parazitických hlístic na člověka nemusí být za všech situací negativní a jejich přítomnost podle některých studií naopak pomáhá rozvíjet a regulovat imunitní systém. Řízená infekce některými helminty – helmintická terapie – se tak nabízí jako prostředek léčby autoimunitních zánětlivých onemocnění, jako je Crohnova nemoc či ulcerózní kolitida. Vhodným kandidátem se z tohoto pohledu ukazuje být například tenkohlavec prasečí (Trichuris suis), jehož přednostmi je, že se nepřenáší z člověka na člověka a neprobíhá u něj somatická migrace larev.[168]
Odkazy[editovat | editovat zdroj]
Poznámky[editovat | editovat zdroj]
- ↑ Lze však očekávat, že s přibývajícími molekulárními daty dojde k dalším úpravám systému kvůli jeho přirozenosti, přinejmenším od úrovně řádů níže; sama studie zmiňuje nutnou další revizi některých taxonů, např. řádu Rhigonematida a pravděpodobně parafyletického řádu Trefusiida; navíc všechny taxony mají v systému jednoznačné zařazení (tj. bez incertae sedis) i v případech, kdy existují pochybnosti.
- ↑ tj. popsaných platně a bezrozporně vzhledem k ostatním
- ↑ včetně pův. samostatného řádu Isolaimida
- ↑ včetně pův. samostatného řádu Trichurida
- ↑ včetně pův. samostatného řádu Araeolaimida
- ↑ včetně pův. samostatného řádu Strongylida – měchovci
- ↑ včetně pův. samostatných řádu Ascaridida – škrkavice a Oxyurida – roupi
- ↑ včetně pův. samostatného řádu Tylenchida – háďátka
Reference[editovat | editovat zdroj]
- ↑ LINNÉ, Carl von; SALVIUS, LARS. Caroli Linnaei...Systema naturae per regna tria naturae :secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. 10. vyd. Holmiae: Impensis Direct. Laurentii Salvii, 1758. Dostupné online. S. 648. (latinsky)
- ↑ a b CHITWOOD, B. G. The English Word "Nema" Revised. Systematic Zoology. 1957, roč. 6, čís. 4, s. 184–186. Dostupné online [cit. 2022-12-21]. ISSN 0039-7989. DOI 10.2307/2411424. (anglicky)
- ↑ a b c HODDA, M. Phylum Nematoda: a classification, catalogue and index of valid genera, with a census of valid species. Zootaxa. 2022-03-10, roč. 5114, čís. 1, s. 1–289. Dostupné online [cit. 2022-12-21]. ISSN 1175-5334. DOI 10.11646/zootaxa.5114.1.1. (anglicky)
- ↑ Poinar 2015, s. 273.
- ↑ HUETTEL, R N; GOLDEN, A M. Nathan Augustus Cobb: The Father of Nematology in the United States*. Annual Review of Phytopathology. 1991-09, roč. 29, čís. 1, s. 15–27. Dostupné online [cit. 2022-12-21]. ISSN 0066-4286. DOI 10.1146/annurev.py.29.090191.000311. (anglicky)
- ↑ a b c d Brusca, Moore a Shuster 2016, s. 671.
- ↑ REJZEK, Jiří. Český etymologický slovník. Voznice: LEDA, 2001, 2012. 752 s. ISBN 978-80-7335-296-7. Hesla hlíst(a), hlína, s. 202.
- ↑ a b c Giribet a Edgecombe 2020, s. 189–192.
- ↑ a b Hutchins, Thoney a Schlage 2003, s. 283.
- ↑ a b Volf a Horák 2007, s. 205.
- ↑ Lorenzen, S. 1981. Entwurf eines phylogenetischen Systems der freilebenden Nematoden. Veröffentlichungen des Institut für Meeresforschungen Bremerhaven, suppl. 7, 1–472.
- ↑ Brusca, Moore a Shuster 2016, s. 672.
- ↑ VAN MEGEN, Hanny; VAN DEN ELSEN, Sven; HOLTERMAN, Martijn; KARSSEN, Gerrit; MOOYMAN, Paul; BONGERS, Tom; HOLOVACHOV, Oleksandr. A phylogenetic tree of nematodes based on about 1200 full-length small subunit ribosomal DNA sequences. S. 927–950. Nematology [online]. Brill, 2009. Roč. 11, čís. 6, s. 927–950. ISSN 1568-5411. DOI 10.1163/156854109X456862. (anglicky)
- ↑ AHMED, Mohammed; ROBERTS, Nickellaus G.; ADEDIRAN, Funmilola; SMYTHE, Ashleigh B.; KOCOT, Kevin M.; HOLOVACHOV, Oleksandr. Phylogenomic Analysis of the Phylum Nematoda: Conflicts and Congruences With Morphology, 18S rRNA, and Mitogenomes. S. 769565. Frontiers in Ecology and Evolution [online]. 2022-01-28. Roč. 9, s. 769565. ISSN 2296-701X. DOI 10.3389/fevo.2021.769565. (anglicky)
- ↑ Kmen hlístice, Nematoda. BioLib.cz. Dostupné online
- ↑ VEJDOVSKÝ, F. Zur Morphologie der Gordüden. Zeitschrift für wissenschaftliche Zoologie. 1886, s. 369–433. (německy)
- ↑ HANELT, B.; THOMAS, F.; SCHMIDT-RHAESA, A. Biology of the phylum nematomorpha. Advances in Parasitology. 2005, roč. 59, s. 257–258. Dostupné online [cit. 2022-12-21]. ISSN 2163-6079. DOI 10.1016/S0065-308X(05)59004-3. PMID 16182867. (anglicky)
- ↑ a b HOWARD, Richard J.; GIACOMELLI, Mattia; LOZANO-FERNANDEZ, Jesus. The Ediacaran origin of Ecdysozoa: integrating fossil and phylogenomic data. Journal of the Geological Society. 2022-03-10, roč. 179, čís. 4. Dostupné online [cit. 2022-12-21]. ISSN 0016-7649. DOI 10.1144/jgs2021-107. (anglicky)
- ↑ BLEIDORN, Christoph; SCHMIDT-RHAESA, Andreas; GAREY, James R. Systematic relationships of Nematomorpha based on molecular and morphological data. Invertebrate Biology. 2005-05-11, roč. 121, čís. 4, s. 357–364. Dostupné online [cit. 2022-12-21]. DOI 10.1111/j.1744-7410.2002.tb00136.x. (anglicky)
- ↑ HOWARD, Richard J.; EDGECOMBE, Gregory D.; SHI, Xiaomei. Ancestral morphology of Ecdysozoa constrained by an early Cambrian stem group ecdysozoan. BMC Evolutionary Biology. 2020-12, roč. 20, čís. 1, s. 156. Dostupné online [cit. 2023-01-07]. ISSN 1471-2148. DOI 10.1186/s12862-020-01720-6. PMID 33228518. (anglicky)
- ↑ GIRIBET, Gonzalo; EDGECOMBE, Gregory D. Current Understanding of Ecdysozoa and its Internal Phylogenetic Relationships. Integrative and Comparative Biology. 2017-09, roč. 57, čís. 3, s. 455–466. Dostupné online [cit. 2023-01-07]. ISSN 1540-7063. DOI 10.1093/icb/icx072. (anglicky)
- ↑ CAMPBELL, Lahcen I.; ROTA-STABELLI, Omar; EDGECOMBE, Gregory D. MicroRNAs and phylogenomics resolve the relationships of Tardigrada and suggest that velvet worms are the sister group of Arthropoda. Proceedings of the National Academy of Sciences. 2011-09-20, roč. 108, čís. 38, s. 15920–15924. Dostupné online [cit. 2022-12-21]. ISSN 0027-8424. DOI 10.1073/pnas.1105499108. PMID 21896763. (anglicky)
- ↑ a b YAMASAKI, Hiroshi; FUJIMOTO, Shinta; MIYAZAKI, Katsumi. Phylogenetic position of Loricifera inferred from nearly complete 18S and 28S rRNA gene sequences. Zoological Letters. 2015-12, roč. 1, čís. 1, s. 18. Dostupné online [cit. 2022-10-24]. ISSN 2056-306X. DOI 10.1186/s40851-015-0017-0. PMID 26605063. (anglicky)
- ↑ Schmidt-Rhaesa 2014, s. 352.
- ↑ a b c d e BLAXTER, Mark; KOUTSOVOULOS, Georgios. The evolution of parasitism in Nematoda. Parasitology. 2015-02, roč. 142, čís. S1, s. S26–S39. Dostupné online [cit. 2022-12-22]. ISSN 0031-1820. DOI 10.1017/S0031182014000791. PMID 24963797. (anglicky)
- ↑ MAAS, Andreas; HUANG, Diying; CHEN, Junyuan. Maotianshan-Shale nemathelminths — Morphology, biology, and the phylogeny of Nemathelminthes. Palaeogeography, Palaeoclimatology, Palaeoecology. 2007-10, roč. 254, čís. 1–2, s. 288–306. Dostupné online [cit. 2022-12-22]. DOI 10.1016/j.palaeo.2007.03.019. (anglicky)
- ↑ Schmidt-Rhaesa 2014, s. 101.
- ↑ HELDER, J. & kol. Phytopathogenic Nematodes. In: LUGTENBERG, B. Principles of Plant-Microbe Interactions: Microbes for Sustainable Agriculture. Cham: Springer, 2014. ISBN 978-3-319-08575-3. DOI https://link.springer.com/chapter/10.1007/978-3-319-08575-3_11. (anglicky)
- ↑ Giribet a Edgecombe 2020, s. 202.
- ↑ Poinar 2015, s. 274.
- ↑ POINAR JR, George; KERP, Hans; HASS, Hagen. Palaeonema phyticum gen. n., sp. n. (Nematoda: Palaeonematidae fam. n.), a Devonian nematode associated with early land plants. Nematology. 2008, roč. 10, čís. 1, s. 9–14. Dostupné online [cit. 2022-12-22]. ISSN 1388-5545. DOI 10.1163/156854108783360159. (anglicky)
- ↑ Schmidt-Rhaesa 2014, s. 173–178.
- ↑ POINAR, George O. A mermithid nematode, Cretacimermis aphidophilus sp. n. (Nematoda: Mermithidae), parasitising an aphid (Hemiptera: Burmitaphididae) in Myanmar amber: a 100 million year association. Nematology. 2017-01-01, roč. 19, čís. 5, s. 509–513. Dostupné online [cit. 2022-12-22]. ISSN 1388-5545. DOI 10.1163/15685411-00003063. (anglicky)
- ↑ Phylum Nematoda | Biology for Majors II. courses.lumenlearning.com [online]. [cit. 2022-12-27]. Dostupné online.
- ↑ Schmidt-Rhaesa 2014, s. 4.
- ↑ a b c d e Volf a Horák 2007, s. 200.
- ↑ a b Schmidt-Rhaesa 2014, s. 1–3.
- ↑ a b c d e f Sedlák 2002, s. 53.
- ↑ a b c d e Smrž 2015, s. 97.
- ↑ a b Giribet a Edgecombe 2020, s. 196.
- ↑ a b Brusca, Moore a Shuster 2016, s. 673–675.
- ↑ a b c Brusca, Moore a Shuster 2016, s. 677–680.
- ↑ Smrž 2015, s. 97–98.
- ↑ Hermaphrodite Coelomocyte System. www.wormatlas.org [online]. [cit. 2022-12-27]. Dostupné online. (anglicky)
- ↑ Schmidt-Rhaesa 2014, s. 35.
- ↑ Sedlák 2002, s. 673–675.
- ↑ Giribet a Edgecombe 2020, s. 193.
- ↑ a b c Volf a Horák 2007, s. 201.
- ↑ a b c Nielsen 2012, s. 277.
- ↑ Schmidt-Rhaesa 2014, s. 10.
- ↑ Schmidt-Rhaesa 2014, s. 5–6.
- ↑ a b c d e f g Volf a Horák 2007, s. 203.
- ↑ Schmidt-Rhaesa 2014, s. 8.
- ↑ a b Poinar 2015, s. 278.
- ↑ Schmidt-Rhaesa 2014, s. 29.
- ↑ a b c d Brusca, Moore a Shuster 2016, s. 677.
- ↑ a b c d Volf a Horák 2007, s. 202.
- ↑ Nielsen 2012, s. 278.
- ↑ Poinar 2015, s. 278–279.
- ↑ Hutchins, Thoney a Schlage 2003, s. 289.
- ↑ a b Schmidt-Rhaesa 2014, s. 34.
- ↑ a b Poinar 2015, s. 283–284.
- ↑ SUNDARAM, Meera V.; BUECHNER, Matthew. The Caenorhabditis elegans Excretory System: A Model for Tubulogenesis, Cell Fate Specification, and Plasticity. Genetics. 2016-05, roč. 203, čís. 1, s. 35–63 [40]. Dostupné online [cit. 2022-12-29]. ISSN 1943-2631. DOI 10.1534/genetics.116.189357. PMID 27183565. (anglicky)
- ↑ a b c d e f Smrž 2015, s. 98.
- ↑ a b c Poinar 2015, s. 276–278.
- ↑ Giribet a Edgecombe 2020, s. 195.
- ↑ Hutchins, Thoney a Schlage 2003, s. 293.
- ↑ Schmidt-Rhaesa 2014, s. 27–28.
- ↑ VAN DE VELDE, M. C.; COOMANS, A. Ultrastructure of the photoreceptor of Diplolaimella sp. (Nematoda). Tissue & Cell. 1988, roč. 20, čís. 3, s. 421–429. Dostupné online [cit. 2022-12-30]. ISSN 0040-8166. DOI 10.1016/0040-8166(88)90074-2. PMID 18620234. (anglicky)
- ↑ PETR, Jaroslav. Slepí červi vnímají barvy. Vymyká se to všemu, co vědci znají | Věda. Lidovky.cz [online]. 2021-03-19 [cit. 2022-12-30]. Dostupné online.
- ↑ GHOSH, D. Dipon; LEE, Dongyeop; JIN, Xin. C. elegans discriminates colors to guide foraging. Science (New York, N.Y.). 2021-03-05, roč. 371, čís. 6533, s. 1059–1063. Dostupné online [cit. 2022-12-30]. ISSN 1095-9203. DOI 10.1126/science.abd3010. PMID 33674494. (anglicky)
- ↑ GONG, Jianke; YUAN, Yiyuan; WARD, Alex. The C. elegans Taste Receptor Homolog LITE-1 Is a Photoreceptor. Cell. 2016-11-17, roč. 167, čís. 5, s. 1252–1263.e10. Dostupné online [cit. 2022-12-30]. ISSN 0092-8674. DOI 10.1016/j.cell.2016.10.053. (anglicky)
- ↑ a b c d e f g Brusca, Moore a Shuster 2016, s. 681–682.
- ↑ a b c Hutchins, Thoney a Schlage 2003, s. 294.
- ↑ Schmidt-Rhaesa 2014, s. 45.
- ↑ a b Schmidt-Rhaesa 2014, s. 63.
- ↑ a b SHIH, Pei-Yin; LEE, James Siho; SHINYA, Ryoji. Newly Identified Nematodes from Mono Lake Exhibit Extreme Arsenic Resistance. Current Biology. 2019-10-07, roč. 29, čís. 19, s. 3339–3344.e4. Dostupné online [cit. 2023-01-14]. ISSN 0960-9822. DOI 10.1016/j.cub.2019.08.024. PMID 31564490. (anglicky)
- ↑ STAFF, News. New Species of Microscopic Worm Has Three Sexes, Lives in Arsenic-Rich Lake | Sci.News. Sci.News: Breaking Science News [online]. 2019-09-30 [cit. 2023-01-14]. Dostupné online. (anglicky)
- ↑ a b c Poinar 2015, s. 286.
- ↑ Schmidt-Rhaesa 2014, s. 43.
- ↑ a b c Smrž 2015, s. 102.
- ↑ a b Schmidt-Rhaesa 2014, s. 48.
- ↑ a b Poinar 2015, s. 284–285.
- ↑ Volf a Horák 2007, s. 208–209.
- ↑ Hutchins, Thoney a Schlage 2003, s. 294–295.
- ↑ Schmidt-Rhaesa 2014, s. 100.
- ↑ Poinar 2015, s. 294–295.
- ↑ Volf a Horák 2007, s. 204.
- ↑ GIBBS, H. C. Hypobiosis in Parasitic Nematodes—An Update. Advances in Parasitology Volume 25. 1986. DOI 10.1016/S0065-308X(08)60343-7. (anglicky)
- ↑ a b c KIONTKE, Karin; FITCH, David H.A. Nematodes. Current Biology. 2013-10, roč. 23, čís. 19, s. R862–R864. Dostupné online [cit. 2023-01-21]. DOI 10.1016/j.cub.2013.08.009. PMID 24112976. (anglicky)
- ↑ a b Giribet a Edgecombe 2020, s. 188.
- ↑ a b c Schmidt-Rhaesa 2014, s. 109.
- ↑ VAN DEN HOOGEN, Johan; GEISEN, Stefan; ROUTH, Devin; FERRIS, Howard; TRAUNSPURGER, Walter; WARDLE, David A.; DE GOEDE, Ron G.M. Soil nematode abundance and functional group composition at a global scale. Nature. 2019-07-24, s. 194–198. Dostupné v archivu pořízeném z originálu dne 2020-03-02. ISSN 0028-0836. DOI 10.1038/s41586-019-1418-6. PMID 31341281. S2CID 198492891. Bibcode 2019Natur.572..194V. (anglicky)
- ↑ KHANUM, T. A.; MEHMOOD, N. Bacterial Feeding Nematodes Use for Nitrogen Mineralization and Plant Production. Acta Scientific Pharmaceutical Sciences. 2021. Dostupné online. (anglicky)
- ↑ a b c Smrž 2015, s. 99.
- ↑ Poinar 2015, s. 288–289.
- ↑ BORGONIE, G.; GARCÍA-MOYANO, A.; LITTHAUER, D. Nematoda from the terrestrial deep subsurface of South Africa. Nature. 2011-06, roč. 474, čís. 7349, s. 79–82. Dostupné online [cit. 2023-01-21]. ISSN 1476-4687. DOI 10.1038/nature09974. (anglicky)
- ↑ CARPENTER, J. Deepest-living land animal found. BBC News. 2011-06-02. Dostupné online [cit. 2023-01-21]. (anglicky)
- ↑ SHATILOVICH, A. V.; TCHESUNOV, A. V.; NERETINA, T. V. Viable Nematodes from Late Pleistocene Permafrost of the Kolyma River Lowland. Doklady Biological Sciences. 2018-05-01, roč. 480, čís. 1, s. 100–102. Dostupné online [cit. 2023-03-26]. ISSN 1608-3105. DOI 10.1134/S0012496618030079. (anglicky)
- ↑ WEISBERGER, Mindy. Worms Frozen for 42,000 Years in Siberian Permafrost Wriggle to Life. livescience.com [online]. 2018-07-27 [cit. 2023-03-26]. Dostupné online. (anglicky)
- ↑ ŠVAMBERK, Alex. Hlístice byly zmrzlé 46 000 let. Vědci je nyní oživili. Novinky.cz [online]. Borgis, a. s., 2023-07-30 [cit. 2023-07-31]. Dostupné online.
- ↑ Volf a Horák 2007, s. 204–205.
- ↑ FLEGR, Jaroslav. Evoluční biologie. 2., opr. a rozš.. vyd. Praha: Academia, 2009. ISBN 978-80-200-1767-3, ISBN 80-200-1767-4. OCLC 505914273 S. 343.
- ↑ a b c Sedlák 2002, s. 55.
- ↑ Volf a Horák 2007, s. 221.
- ↑ Sedlák 2002, s. 56.
- ↑ Volf a Horák 2007, s. 223.
- ↑ POINAR, George O.; KANNANGARA, D. W. W. Rhabdochona praecox sp. n. and Proleptus sp. (Spiruroidea : Nematoda) from fresh water crabs in Ceylon. Annales de Parasitologie Humaine et Comparée. 1972, roč. 47, čís. 1, s. 121–129. Dostupné online [cit. 2023-01-18]. ISSN 0003-4150. DOI 10.1051/parasite/1972471121. (anglicky)
- ↑ a b c Poinar 2015, s. 294.
- ↑ Hutchins, Thoney a Schlage 2003, s. 289–290.
- ↑ Volf a Horák 2007, s. 211–212.
- ↑ Volf a Horák 2007, s. 225–227.
- ↑ Hutchins, Thoney a Schlage 2003, s. 35–36.
- ↑ a b Volf a Horák 2007, s. 210–211.
- ↑ a b Giribet a Edgecombe 2020, s. 200–201.
- ↑ a b c d e JONES, John T.; HAEGEMAN, Annelies; DANCHIN, Etienne G. J. Top 10 plant-parasitic nematodes in molecular plant pathology: Top 10 plant-parasitic nematodes. Molecular Plant Pathology. 2013-12, roč. 14, čís. 9, s. 946–961. Dostupné online [cit. 2023-01-24]. DOI 10.1111/mpp.12057. PMID 23809086. (anglicky)
- ↑ a b HÁĎÁTKO BOROVICOVÉ [online]. ÚSTŘEDNÍ KONTROLNÍ A ZKUŠEBNÍ ÚSTAV ZEMĚDĚLSKÝ [cit. 2023-02-15]. Dostupné online.
- ↑ a b Pine wood nematode (Bursaphelenchus xylophilus) [online]. [cit. 2023-01-25]. Dostupné online. (anglicky)
- ↑ Volf a Horák 2007, s. 207.
- ↑ WILLIAMS, C. M.; POULIN, R.; SINCLAIR, B. J. Increased haemolymph osmolality suggests a new route for behavioural manipulation of Talorchestia quoyana (Amphipoda: Talitridae) by its mermithid parasite. Functional Ecology. 2004-10, roč. 18, čís. 5, s. 685–691. Dostupné online [cit. 2023-01-20]. ISSN 0269-8463. DOI 10.1111/j.0269-8463.2004.00910.x. (anglicky)
- ↑ SHIK, Jonathan Z.; KASPARI, Michael; YANOVIAK, Stephen P. Preliminary assessment of metabolic costs of the nematode Myrmeconema neotropicum on its host, the tropical ant Cephalotes atratus. The Journal of Parasitology. 2011-10, roč. 97, čís. 5, s. 958–959. Dostupné online [cit. 2023-01-21]. ISSN 1937-2345. DOI 10.1645/GE-2735.1. PMID 21506804. (anglicky)
- ↑ COLGAN, T. J.; CAROLAN, J. C.; SUMNER, S. Infection by the castrating parasitic nematode Sphaerularia bombi changes gene expression in Bombus terrestris bumblebee queens. Insect Molecular Biology. 2020-04, roč. 29, čís. 2, s. 170–182. Dostupné online [cit. 2023-01-20]. ISSN 0962-1075. DOI 10.1111/imb.12618. (anglicky)
- ↑ Poinar 2015, s. 291–292.
- ↑ LEE, Ching-Han; LEE, Yi-Yun; CHANG, Yu-Chu. A carnivorous mushroom paralyzes and kills nematodes via a volatile ketone. Science Advances. 2023-01-18, roč. 9, čís. 3, s. eade4809. Dostupné online [cit. 2023-01-21]. ISSN 2375-2548. DOI 10.1126/sciadv.ade4809. (anglicky)
- ↑ KASHYAP, Dipti; JAISWAL, Kamal. Description of hyperparasitism of microsporidia in nematode (Ascaridia galli) parasitic in fowl, Gallus gallus domesticus. South Asian Journal of Experimental Biology. 2020-10-21, roč. 10, čís. 5, s. 332–336. Dostupné online [cit. 2023-01-20]. ISSN 2230-9799. DOI 10.38150/sajeb.10(5).p332-336. (anglicky)
- ↑ VAN HOOF, H. A. Viruses transmitted by Xiphinema species in the Netherlands. Netherlands Journal of Plant Pathology. 1971-01-01, roč. 77, čís. 1, s. 30–31. Dostupné online [cit. 2023-01-25]. ISSN 1573-8469. DOI 10.1007/BF01976396. (anglicky)
- ↑ Giribet a Edgecombe 2020, s. 200.
- ↑ a b Enterobiasis [online]. CDC, rev. 2019-08-05 [cit. 2023-01-23]. Dostupné online. (anglicky)
- ↑ Ascariasis [online]. CDC, rev. 2019-06-19 [cit. 2023-01-23]. Dostupné online. (anglicky)
- ↑ Ascariasis [online]. CDC, rev. 2020-11-23 [cit. 2023-01-23]. Dostupné online. (anglicky)
- ↑ a b Hookworm (Intestinal) [online]. CDC, rev. 2019-09-17 [cit. 2023-01-23]. Dostupné online. (anglicky)
- ↑ Hookworm [online]. CDC, rev. 2022-04-29 [cit. 2023-01-23]. Dostupné online. (anglicky)
- ↑ Trichuriasis [online]. CDC, rev. 2017-12-19 [cit. 2023-01-23]. Dostupné online. (anglicky)
- ↑ Strongyloidiasis [online]. CDC, rev. 2019-07-30 [cit. 2023-01-23]. Dostupné online. (anglicky)
- ↑ Lymphatic Filariasis [online]. CDC, rev. 2019-08-30 [cit. 2023-01-23]. Dostupné online. (anglicky)
- ↑ a b c d STEJSKAL, F. Paraziti na cestách aneb rizika parazitárních infekcí při cestách do zahraničí. In: VOTÝPKA, J.; KOLÁŘOVÁ, I.; HORÁK, P. & kol. O parazitech a lidech. Praha: Triton, 2018. ISBN 978-80-7553-350-0. S. 314.
- ↑ Onchocerciasis [online]. CDC, rev. 2017-12-14 [cit. 2023-01-23]. Dostupné online. (anglicky)
- ↑ Loiasis [online]. CDC, rev. 2019-04-11 [cit. 2023-01-23]. Dostupné online. (anglicky)
- ↑ Dracunculiasis [online]. CDC, rev. 2018-05-09 [cit. 2023-01-23]. Dostupné online. (anglicky)
- ↑ a b STEPEK, Gillian; BUTTLE, David J; DUCE, Ian R. Human gastrointestinal nematode infections: are new control methods required?. International Journal of Experimental Pathology. 2006-10, roč. 87, čís. 5, s. 325–341. Dostupné online [cit. 2023-03-23]. ISSN 0959-9673. DOI 10.1111/j.1365-2613.2006.00495.x. PMID 16965561. (anglicky)
- ↑ MARCHIONDO, A. A.; CRUTHERS, L. L.; REINEMEYER, C. R. Nematoda. In: Parasiticide screening. Volume 2 : in vitro and in vivo tests with relevant parasite rearing and host infection/infestation methods. London: [s.n.], 2012. ISBN 978-0-12-816577-5.. (anglicky)
- ↑ PAWLOWSKI, Zbigniew S. Ascariasis: Host-Pathogen Biology. Reviews of Infectious Diseases. 1982, roč. 4, čís. 4, s. 806–814. Dostupné online [cit. 2023-01-23]. ISSN 0162-0886.
- ↑ Volf a Horák 2007, s. 219.
- ↑ CDC - Guinea Worm Disease - Eradication Program. www.cdc.gov [online]. CDC-Centers for Disease Control and Prevention, 2022-03-18 [cit. 2023-03-23]. Dostupné online. (anglicky)
- ↑ Trichinellosis [online]. CDC, rev. 2017-12-19 [cit. 2023-01-23]. Dostupné online. (anglicky)
- ↑ Despommier D. Toxocariasis: clinical aspects, epidemiology, medical ecology, and molecular aspects. Clin Microbiol Rev. Duben 2003, roč. 16, čís. 2, s. 265–272. PMID 12692098. (anglicky)
- ↑ HOSSAIN, Mehrab E; KENNEDY, Karina J.; WILSON, Heather L. Human Neural Larva Migrans Caused by Ophidascaris robertsi Ascarid. Emerging Infectious Diseases. 2023-09, roč. 29, čís. 9. Dostupné online [cit. 2023-08-29]. ISSN 1080-6040. DOI 10.3201/eid2909.230351.
- ↑ Volf a Horák 2007, s. 215–216.
- ↑ Dictyocaulus viviparus [online]. University of Saskatchewan, 2021-03-28 [cit. 2023-03-26]. Dostupné online. (anglicky)
- ↑ Dirofilaria immitis – červ napadající srdce psů: fakta proti mýtům a hororům [online]. veterinarni-lekari.cz, 2020-04-27 [cit. 2023-01-24]. Dostupné online.
- ↑ MATĚJŮ, Jana; CHANOVÁ, Marta; MODRÝ, David. Dirofilaria repens: emergence of autochthonous human infections in the Czech Republic (case reports). BMC Infectious Diseases. 2016-12, roč. 16, čís. 1, s. 171. Dostupné online [cit. 2023-03-26]. ISSN 1471-2334. DOI 10.1186/s12879-016-1505-3. PMID 27094256. (anglicky)
- ↑ JURÁNKOVÁ, Jana; ŠENKYŘÍKOVÁ MITKOVÁ, Barbora; NOVOTNÁ, Marcela. Further data on the distribution of Dirofilaria spp. in the Czech Republic in dogs. Folia Parasitologica. 2022-03-31, roč. 69. Dostupné online [cit. 2023-03-26]. DOI 10.14411/fp.2022.007.
- ↑ GEBAUER, Jan; ONDRUŠ, Jaroslav; KULICH, Pavel. The first case of periorbital human dirofilariasis in the Czech Republic. Parasitology Research. 2021-02-01, roč. 120, čís. 2, s. 739–742. Dostupné online [cit. 2023-03-26]. ISSN 1432-1955. DOI 10.1007/s00436-020-07003-9. (anglicky)
- ↑ CAPELLI, Gioia; GENCHI, Claudio; BANETH, Gad. Recent advances on Dirofilaria repens in dogs and humans in Europe. Parasites & Vectors. 2018-12, roč. 11, čís. 1, s. 663. Dostupné online [cit. 2023-03-26]. ISSN 1756-3305. DOI 10.1186/s13071-018-3205-x. PMID 30567586. (anglicky)
- ↑ DO VALE, Beatriz; LOPES, Ana Patrícia; DA CONCEIÇÃO FONTES, Maria. Systematic review on infection and disease caused by Thelazia callipaeda in Europe: 2001–2020. Parasite. 2020, roč. 27, s. 52. Dostupné online [cit. 2023-03-26]. ISSN 1776-1042. DOI 10.1051/parasite/2020048. PMID 32996882.
- ↑ HOFMANNOVÁ, Lada, et al. Oční hlístice Thelazia callipaeda: nový patogen psů v České republice. Veterinární lékař. 2019, roč. 17, čís. 1, s. 19. Dostupné online.
- ↑ a b MENEELY, Philip M.; DAHLBERG, Caroline L.; ROSE, Jacqueline K. Working with Worms: Caenorhabditis elegans as a Model Organism. Current Protocols Essential Laboratory Techniques. 2019-12, roč. 19, čís. 1. Dostupné online [cit. 2023-01-25]. ISSN 1948-3430. DOI 10.1002/cpet.35. (anglicky)
- ↑ THE C. ELEGANS SEQUENCING CONSORTIUM*. Genome Sequence of the Nematode C. elegans : A Platform for Investigating Biology. Science. 1998-12-11, roč. 282, čís. 5396, s. 2012–2018. Dostupné online [cit. 2023-01-25]. ISSN 0036-8075. DOI 10.1126/science.282.5396.2012. (anglicky)
- ↑ a b Giribet a Edgecombe 2020, s. 201–202.
- ↑ SZEWCZYK, Nathaniel J.; MANCINELLI, Rocco L.; MCLAMB, William. Caenorhabditis elegans survives atmospheric breakup of STS-107, space shuttle Columbia. Astrobiology. 2005-12, roč. 5, čís. 6, s. 690–705. Dostupné online [cit. 2023-01-25]. ISSN 1531-1074. DOI 10.1089/ast.2005.5.690. PMID 16379525. (anglicky)
- ↑ The Nobel Prize in Physiology or Medicine 2002. NobelPrize.org [online]. [cit. 2023-01-25]. Dostupné online. (anglicky)
- ↑ The Nobel Prize in Physiology or Medicine 2006. NobelPrize.org [online]. [cit. 2023-01-25]. Dostupné online. (anglicky)
- ↑ http://www.wormbook.org/
- ↑ MITREVA, Makedonka; JASMER, Douglas P.; ZARLENGA, Dante S. The draft genome of the parasitic nematode Trichinella spiralis. Nature Genetics. 2011-03, roč. 43, čís. 3, s. 228–235. Dostupné online [cit. 2023-03-20]. ISSN 1546-1718. DOI 10.1038/ng.769. (anglicky)
- ↑ TANG, Yat T.; GAO, Xin; ROSA, Bruce A. Genome of the human hookworm Necator americanus. Nature Genetics. 2014-03, roč. 46, čís. 3, s. 261–269. Dostupné online [cit. 2023-01-25]. ISSN 1546-1718. DOI 10.1038/ng.2875. (anglicky)
- ↑ BURKE, Mark; SCHOLL, Elizabeth H.; BIRD, David McK. The plant parasite Pratylenchus coffeae carries a minimal nematode genome. Nematology. 2015-01-01, roč. 17, čís. 6, s. 621–637. Dostupné online [cit. 2023-01-25]. ISSN 1388-5545. DOI 10.1163/15685411-00002901. (anglicky)
- ↑ MARTINS, Mirian Francisca; MORAES, Sinara Cristina de; COHEN, Simone Chinicz. First record of a mermithid worm (Nematoda, Mermithidae) parasitizing a third instar nymph of Triatoma sordida (Stål, 1859) (Hemiptera, Reduviidae, Triatominae) from Mato Grosso, Brazil. ZooKeys. 2020-10-28, roč. 980, s. 79–91. Dostupné online [cit. 2023-02-15]. ISSN 1313-2970. DOI 10.3897/zookeys.980.55865. (anglicky)
- ↑ Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění [online]. prolekare.cz, 2019-09-16 [cit. 2023-01-24]. Dostupné online.
Literatura[editovat | editovat zdroj]
- Česky
- SEDLÁK, Edmund, 2002. Zoologie bezobratlých. Brno: Přírodovědecká fakulta MU. ISBN 80-210-2892-0.
- SMRŽ, Jaroslav, 2015. Základy biologie, ekologie a systému bezobratlých živočichů. Praha: Karolinum Press. ISBN 8024622580, ISBN 9788024622583.
- VOLF, Petr; HORÁK, Petr, 2007. Paraziti a jejich biologie. Praha: Triton. ISBN 9788073870089, ISBN 8073870088.
- Anglicky
- BRUSCA, R. C.; MOORE, Wendy; SHUSTER, S. M, 2016. Invertebrates. Sunderland, Massachusetts: Sinauer Associates, lnc., Publishers. Dostupné online. ISBN 9781605353753. (anglicky)
- GIRIBET, Gonzalo; EDGECOMBE, Gregory, 2020. The Invertebrate Tree of Life. Princeton, NJ Oxford: Princeton University Press. ISBN 978-0-691-19706-7, ISBN 0-691-19706-7. OCLC 1129197548 (anglicky)
- NIELSEN, Claus, 2012. Animal Evolution : Interrelationships of The Living Phyla. 3. vyd. Oxford: OUP. ISBN 978-0-19-162530-5, ISBN 0-19-162530-2. (anglicky)
- POINAR, George O, 2015. Phylum Nemata. In: THORP, James H.; ROGERS, D. Christopher. Ecology and General Biology (Thorp and Covich’s Freshwater Invertebrates – Volume I). 4. vyd. London: Academic Press. ISBN 978-0-12-385027-0, ISBN 0-12-385027-4. (anglicky)
- RAVEN, P. & kol, 2016. Biology. 11. vyd. New York, NY: McGraw-Hill Education. ISBN 978-1-259-18813-8, ISBN 1-259-18813-2. OCLC 930364325
- SCHMIDT-RHAESA, A. (Scientific Editor), 2014. Gastrotricha, Cycloneuralia and Gnathifera. Volume 2, Nematoda. Berlin: de Gruyter. 775 s. ISBN 978-3-11-027425-7, ISBN 3-11-027425-6. OCLC 878137063
- HUTCHINS, Michael; THONEY, Dennis A.; SCHLAGE, Neil, 2003. Lower Metazoans And Lesser Deuterostomes. 2. vyd. Farmington Hills, MI: Gale. (Grzimek's Animal Life Encyclopedia; sv. 1). ISBN 0787657778, ISBN 9780787657772. (anglicky)
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu hlístice na Wikimedia Commons
Obrázky, zvuky či videa k tématu hlístice na Wikimedia Commons  Taxon Nematoda ve Wikidruzích
Taxon Nematoda ve Wikidruzích













