Oxid vápenatý
| Oxid vápenatý | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Oxid vápenatý |
| Triviální název | pálené vápno |
| Anglický název | Calcium oxide |
| Německý název | Calciumoxid |
| Sumární vzorec | CaO |
| Vzhled | bílá pevná práškovitá látka |
| Identifikace | |
| Registrační číslo CAS | 1305-78-8 |
| PubChem | 14778 |
| UN kód | 1910 |
| SMILES | [Ca]=O |
| Číslo RTECS | EW3100000 |
| Vlastnosti | |
| Molární hmotnost | 56,08 g/mol |
| Teplota tání | 2 580 °C |
| Teplota varu | 2 850 °C |
| Hustota | 3,316 g/cm³ |
| Index lomu | nD=1,837 |
| Rozpustnost ve vodě | 0,131 hm.% (0 °C) 0,123 hm.% (20 °C) 0,096 hm.% (50 °C) 0,05 hm.% (100 °C) |
| Měrná magnetická susceptibilita | −3,4×10−6 cm3 g−1 |
| Struktura | |
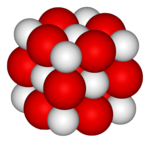
| Krystalová struktura | krychlová plošně centrovaná |
| Hrana krystalové mřížky | a= 481,08 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −635,07 kJ/mol |
| Entalpie tání ΔHt | 1 343 J/g |
| Standardní molární entropie S° | 38,1 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −604,04 kJ/mol |
| Izobarické měrné teplo cp | 0,763 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R34, R36, R41 |
| S-věty | S2, S8, S22, S24/25, S26, S27, S28, S36/37/39 |
| NFPA 704 |  0
3
2
|
Některá data mohou pocházet z datové položky. | |
Oxid vápenatý (chemický vzorec CaO), triviálními názvy pálené vápno nebo též nehašené vápno je široce rozšířená běžně používaná chemická sloučenina. Oxid vápenatý je bílá žíravá a alkalická krystalická látka. Komerčně vyráběný oxid vápenatý také často obsahuje příměsi oxidu hořečnatého, oxidu křemičitého a malá množství oxidu hlinitého a oxidu železitého.[2]
Oxid vápenatý je obvykle vyráběn tepelným rozkladem hornin, jako je vápenec, který obsahuje uhličitan vápenatý (CaCO3 ve formě minerálů kalcitu a aragonitu). Rozklad je prováděn zahříváním jemně mleté horniny na teplotu přesahující 825 °C.[3] Tento proces je nazýván kalcinace nebo též pálení vápna. Uvolňuje se při něm oxid uhličitý (CO2) a uhličitan se přeměňuje na oxid vápenatý (CaO). Jako palivo se používá nejčastěji hnědé uhlí, koks, černé uhlí (respektive antracit) nebo zemní plyn. Dříve se jako palivo používalo též dřevo.
CaCO3 → CaO + CO2 |
|
Tento proces je reverzibilní, a proto od okamžiku, kdy je vypálené vápno ochlazeno, začíná vstřebávat okolní oxid uhličitý ze vzduchu a po čase se opět změní na původní uhličitan. Pálení vápna patří mezi první chemické procesy objevené člověkem již v pravěku.
Použití[editovat | editovat zdroj]
Jako hydratované nebo též triviálně hašené vápno ve formě hydroxidu vápenatého Ca(OH)2 (název tohoto minerálu je portlandit). Je využíván jako součást malty a sádry ke zvýšení tvrdosti materiálu. Příprava hašeného vápna je velmi jednoduchá, neboť oxid vápenatý je jeho zásaditý anhydrid a s vodou reaguje velmi živě.
Historicky nejstarší využití vápna bylo ve stavebnictví – v omítkách je používali již starověcí Římané. Při nedostatku vápence kvůli tomu dokonce někdy byly rozbíjeny mramorové sochy.
Oxid vápenatý je též používán při výrobě skla a díky své schopnosti reagovat s křemičitany je používán v moderních postupech výroby ocelí a hořčíkových, hliníkových a jiných neželezných kovů. Napomáhá vyplavování nečistot do strusky.
Bývá také používán jako přísada pro úpravu vody. Snižuje její kyselost, změkčuje ji, funguje jako flokulant (sbaluje koloidní nečistoty) a napomáhá odstraňování fosfátů a jiných nečistot.
V papírnictví pomáhá rozpouštět lignin, působí jako koagulant a bělidlo.
V zemědělství a lesnictví snižuje kyselost půdy. Bývá též používán jako účinná složka při čistění a odsiřování plynných zplodin.
Tradičně bývá používán při pohřbívání mrtvých těl do otevřených hrobů zvláště v období epidemií například moru za účelem dezinfekce a zamezení zápachu rozkladu.
Ve forenzních vědách je používán k detekci otisků prstů. Jako dehydratační činidlo se používá k čištění kyseliny citronové, glukosy, barviv a jako pohlcovač CO2. Často bývá používán v hrnčířství, malířství a potravinářství.
Energie uvolněná reakcí oxidu vápenatého s vodou bývá používaná jako zdroj tepla k ohřevu speciálních samoohřevných konzerv jídla.
Roční světová produkce oxidu vápenatého je asi 130 milionů tun. Největší producenti, USA a Čína, vyprodukují každý přibližně 20 milionů tun.[4]
Využití ve stavebnictví[editovat | editovat zdroj]
Dle jakosti surovin lze vyrobit dva druhy vápna, které se ve stavebnictví technicky označuje jako tzv. vzdušné vápno.[5]
Druhy vzdušného vápna bílého[editovat | editovat zdroj]
| Označení | Značení | Obsah CaO + MgO 1 | Obsah MgO 1, 2 | Obsah SO3 1 |
|---|---|---|---|---|
| Bílé vápno 90 | CL90 | ≥90 | ≤5 | ≤2 |
| Bílé vápno 80 | CL80 | ≥80 | ≤5 | ≤2 |
| Bílé vápno 70 | CL70 | ≥70 | ≤5 | ≤2 |
| Doplňující třídění | Přípona |
|---|---|
| Nehašené vápno | Q |
| Hašené vápno bílé | S |
- Pozn.:
- 1 Hodnoty uvedené v hmotnostních %. Pro nehašené vápno platí přímo. U nehašeného vápna se vápenné kaše po odpočtu volné a vázané vody
- 2 Vyhoví-li zkoušce objemové stálosti dle ČSN EN 459 – 2, připouští se až 7%.
Druhy vzdušného vápna dolomitického[editovat | editovat zdroj]
| Označení | Značení | Obsah CaO + MgO 1 | Obsah MgO 1, 2 | Obsah SO3 1 |
|---|---|---|---|---|
| Dolomitické vápno 85 | DL85 | ≥85 | ≤30 | ≤2 |
| Dolomitické vápno 80 | DL80 | ≥80 | ≥5 | ≤2 |
| Doplňující třídění | Přípona |
|---|---|
| Polohašené vápno dolomitické | S1 |
| Plně hašené vápno dolomitické | S2 |
- Pozn.:
- 1 Hodnoty uvedené v hmotnostních %. Pro nehašené vápno platí přímo. U nehašeného vápna se vápenné kaše po odpočtu volné a vázané vody
- 2 Vyhoví-li zkoušce objemové stálosti dle ČSN EN 459 – 2, připouští se až 7%.
Reference[editovat | editovat zdroj]
- ↑ a b Calcium oxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Oxid vápenatý - E 529. Doktorka.cz [online]. [cit. 2020-11-02]. Dostupné online.
- ↑ Merck Index of chemicals and Drugs, 9th ed. monograph 1650
- ↑ http://indexmundi.com/en/commodities/minerals/lime/lime_t9.html
- ↑ Stavební materiály pro 1. roční SPŠ stavebních. M. Dědek, F. Vošický
Literatura[editovat | editovat zdroj]
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Oxid vápenatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Oxid vápenatý na Wikimedia Commons


