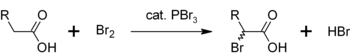Bromid fosforitý
| Bromid fosforitý | |
|---|---|
 Struktura molekuly bromidu fosforitého | |
 Struktura molekuly bromidu fosforitého | |
| Obecné | |
| Systematický název | Bromid fosforitý |
| Anglický název | Phosphorus tribromide |
| Německý název | Phosphortribromid |
| Sumární vzorec | PBr3 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 7789-60-8 |
| EC-no (EINECS/ELINCS/NLP) | 232-178-2 |
| PubChem | 24614 |
| Číslo RTECS | TH4460000 |
| Vlastnosti | |
| Molární hmotnost | 270,686 g/mol |
| Teplota tání | −40,5 °C |
| Teplota varu | 173,2 °C |
| Hustota | 3,412 g/cm3 (−79 °C) 2,871 g/cm3 (20,7 °C) |
| Index lomu | nD= 1,696 32 (27 °C) |
| Rozpustnost ve vodě | reaguje |
| Rozpustnost v polárních rozpouštědlech | diethylether s alkoholy reaguje |
| Rozpustnost v nepolárních rozpouštědlech | chlorid uhličitý aromatické uhlovodíky |
| Součin rozpustnosti | 3,88 (20 °C) |
| Povrchové napětí | 44,7 mN/m (0 °C) 36 mN/m (100 °C) |
| Struktura | |
| Dipólový moment | 2,0×10−30 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −132 kJ/mol (plyn) −177 kJ/mol (kapalina) |
| Entalpie varu ΔHv | 143 J/g |
| Standardní molární entropie S° | 348 JK−1mol−1 (plyn) |
| Standardní slučovací Gibbsova energie ΔGf° | −155,7 kJ/mol (plyn) |
| Izobarické měrné teplo cp | 0,281 JK−1g−1 (25 °C, plyn) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R14, R34, R37 |
| S-věty | (S1/2), S26, S45 |
| NFPA 704 |  0
3
2
|
Některá data mohou pocházet z datové položky. | |
Bromid fosforitý je anorganická sloučenina se vzorcem PBr3, jeden z bromidů fosforu. Za běžných podmínek se jedná o bezbarvou kapalinu, která na vzduchu dýmá (protože podléhá hydrolýze vzdušnou vlhkostí) a pronikavě páchne. Široce se používá v laboratořích na přeměny alkoholů na alkylbromidy.
Příprava
[editovat | editovat zdroj]PBr3 se připravuje působením bromu na červený fosfor. Fosfor musí být v nadbytku, aby se zabránilo tvorbě PBr5:[2]
Reakce
[editovat | editovat zdroj]Bromid fosforitý, podobně jako chlorid a fluorid fosforitý, má vlastnosti jak Lewisovy kyseliny, tak Lewisovy zásady. Například s Lewisovou kyselinou, jako je bromid boritý, tvoří stabilní adukty, kupříkladu Br3B-PBr3. Současně ale může v mnoha reakcích reagovat jako elektrofil či Lewisova kyselina, například s aminy.
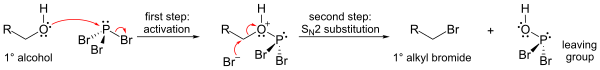
Nejdůležitějšími reakcemi PBr3 jsou ty s alkoholy, kde se hydroxylová skupina nahrazuje atomem bromu a vzniká alkylbromid. Všimněte si, že lze přenést všechny tři atomy bromu.
- PBr3 + 3 ROH → 3 RBr + HP(O)(OH)2
Mechanismus (ukázaný pro primární alkohol) zahrnuje počáteční aktivaci kyslíkového atomu v molekule alkoholu elektrofilním fosforem (čímž vzniká dobrá odstupující skupina) a substituci SN2 na atomu uhlíku.
Vzhledem k substitučnímu kroku SN2 tato reakce obecně dobře funguje pro primární a sekundární alkoholy, ale selhává pro alkoholy terciární. Pokud je reakční uhlíkové centrum chirální, reakce většinou invertuje konfiguraci na alfa uhlíku alkoholu, jak je u reakcí SN2 obvyklé.
Podobnou reakcí PBr3 přeměňuje také karboxylové kyseliny na acylbromidy:
- PBr3 + 3 RCOOH → 3 RCOBr + HP(O)(OH)2
PBr3 je poměrně silným redukčním činidlem, oxidace PBr3 plynným kyslíkem je mnohem bouřlivější než u PCl3. Reakce probíhá explozivně za vzniku oxidu fosforečného a bromu.
Použití
[editovat | editovat zdroj]Hlavním použitím bromidu fosforitého je přeměna primárních a sekundárních alkoholů na alkylbromidy,[3] jak je popsáno výše. PBr3 obvykle poskytuje vyšší výtěžnost než kyselina bromovodíková a lze se vyhnout problémům s přesmykem karbokationtu. Například i neopentylbromid lze získat z alkoholu s výtěžností 60 %.[4]
Jinou oblastí použití PBr3 je jako katalyzátor α-bromace karboxylových kyselin. Přestože se acylbromidy vyrábějí v porovnání s acylchloridy v mnohem menší míře, používají se jako meziprodukty v Hell-Volhard-Zelinského halogenaci.[5] Nejdřív PBr3 reaguje s karboxylovou kyselinou za vzniku acylbromidu, který je při bromaci reaktivnější. Celý proces vypadá takto:
Bromid fosforitý se využívá také při výrobě léčiv, například alprazolamu, methohexitalu nebo fenoprofenu. Je též potentním zpomalovačem hoření.
Bezpečnost
[editovat | editovat zdroj]PBr3 uvolňuje žíravý bromovodík, je toxický a bouřlivě reaguje s vodou a alkoholy.
V reakcích, kde jako vedlejší produkt vzniká kyselina fosforitá, je při destilaci třeba dát pozor na to, že se tato může při teplotě nad cca 160 °C rozkládat za vzniku fosfanu, který může při kontaktu se vzduchem explodovat.[3]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Phosphorus tribromide na anglické Wikipedii.
- ↑ a b Phosphorus tribromide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Theodore M. Burton and Ed. F. Degering. The Preparation of Acetyl Bromide. J. Am. Chem. Soc.. 1940, s. 227. DOI 10.1021/ja01858a502.
- ↑ a b GEORGE C. HARRISON, H. DIEHL. β-Ethoxyethyl bromide. Org. Synth.. 1955. Dostupné online.; Coll. Vol.. S. 370.
- ↑ L. G. Wade, Jr., Organic Chemistry, 6th ed., p. 477, Pearson/Prentice Hall, Upper Saddle River, New Jersey, USA, 2005.
- ↑ L. G. Wade, Jr., Organic Chemistry, 6th ed., p. 1051, Pearson/Prentice Hall, Upper Saddle River, New Jersey, USA, 2005.
Literatura
[editovat | editovat zdroj]- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- R. R. Holmes. An examination of the basic nature of the trihalides of phosphorus, arsenic and antimony,. Journal of Inorganic and Nuclear Chemistry. 1960, s. 266–275. DOI 10.1016/0022-1902(60)80372-7.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu bromid fosforitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu bromid fosforitý na Wikimedia Commons