Bromid hlinitý
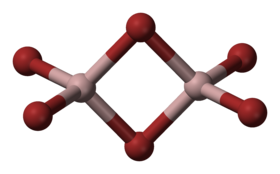
Bromid hlinitý (AlBr3) je chemická sloučenina, patří mezi halogenidy. Nejobvyklejší formou je dimer (Al2Br6), který je za normálních podmínek hygroskopická krystalická pevná látka.
Je mírně toxický, LD50 je 1 598 mg/kg.
Výroba[editovat | editovat zdroj]
Bromid hlinitý se vyrábí několika způsoby, například:
6/n "[AlBr]n" → Al2Br6 + 4 Al nebo
2 Al + 6 HBr → Al2Br6 + 3 H2, také přímou reakcí hliníku s bromem:
2 Al + 3 Br2 → Al2Br6.
Reakce[editovat | editovat zdroj]
Bromid hlinitý reaguje s tetrachlormethanem při teplotě asi 100 °C, přitom vzniká tetrabrommethan:
4 AlBr3 + 3 CCl4 → 4 AlCl3 + 3 CBr4.
S fosgenem reaguje za vzniku karbonylbromidu a chlorobromidu hlinitého:
AlBr3 + COCl2 → COBr2 + AlCl2Br.
Použití[editovat | editovat zdroj]
Bezvodá forma se používá jako katalyzátor při Friedel-Craftově alkylaci (používá se i bezvodý chlorid hlinitý).
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Aluminium bromide na anglické Wikipedii.
- ↑ a b Aluminum bromide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura[editovat | editovat zdroj]
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu bromid hlinitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu bromid hlinitý na Wikimedia Commons