Fluorid boritý
| Fluorid boritý | |
|---|---|
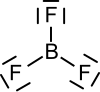 | |
| Obecné | |
| Systematický název | Fluorid boritý |
| Ostatní názvy | Trifluoroboran |
| Anglický název | Boron trifluoride |
| Německý název | Bortrifluorid |
| Sumární vzorec | BF3 |
| Vzhled | Bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 7637-07-2 |
| Vlastnosti | |
| Molární hmotnost | 67,805 g/mol |
| Teplota tání | −127,1 °C |
| Teplota varu | −99,9 °C |
| Hustota | 1,98 g/cm3 (−188 °C, pevná látka) 1,589 g/cm3 (−101 °C, kapalina) 0,002 99 g/cm3 (20 °C, 1013 hPa, plyn) |
| Kritická teplota Tk | −12,25 °C |
| Kritický tlak pk | 4 980 kPa |
| Rozpustnost ve vodě | Prudká reakce |
| Tlak páry | 1,333 kPa (−142 °C) 13,332 kPa (−124 °C) |
| Ionizační energie | 15,5 eV |
| Struktura | |
| Koordinační geometrie | rovnostranný trojúhelník |
| Tvar molekuly | rovinný |
| Dipólový moment | 0 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −1 137 kJ/mol |
| Entalpie tání ΔHt | 68,1 J/g |
| Entalpie varu ΔHv | 252 J/g |
| Standardní molární entropie S° | 254,3 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −1 120 kJ/mol |
| Izobarické měrné teplo cp | 0,744 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R14, R26, R35 |
| S-věty | S1/2, S9, S26, S28, S36/37/39, S45 |
Některá data mohou pocházet z datové položky. | |
Fluorid boritý je ostře štiplavě páchnoucí bezbarvý toxický plyn s hustotou více než dvakrát (2,37×) větší než vzduch.
Příprava
[editovat | editovat zdroj]Fluorid boritý lze připravit přímým slučováním elementárního bóru s plynným fluorem za zvýšené teploty
- 2 B + 3 F2 → 2 BF3;
reakce je značně prudká, proto bývá plynný fluor ředěn dusíkem, který slouží jako inertní plyn. Obvykle se však BF3 připravuje reakcí oxidu boritého s fluorovodíkem
- B2O3 + 6 HF → 2 BF3 + 3 H2O.
Vlastnosti
[editovat | editovat zdroj]
Molekula fluoridu boritého je planární (rovinná) a má trojčetnou symetrii (bodová grupa symetrie D3h). Vzhledem k této symetrii nemá tato molekula dipólový moment, ačkoliv jednotlivé vazby B—F jsou samy o sobě značně polarizované se záporným nábojem na atomu fluoru a s kladným na atomu bóru.
Vzhledem k tomu, že valenční elektronová slupka atomu bóru v této molekule je neúplně obsazená pouze šesti elektrony (je elektronově deficitní), funguje jako elektron akceptor a v reakcích vystupuje jako Lewisova kyselina. Proto se molekula fluoridu boritého váže s molekulami obsahujícími volný elektronový pár. Např. s fluorovodíkem vytváří kyselinu tetrafluoroboritou
- BF3 + HF → HBF4;
podobně s fluoridovými solemi, např. fluoridem draselným vytváří komplexní soli
- KF + BF3 → K[BF4],
v tomto případě tetrafluoroboritan draselný.
S menšími molekulami, jejichž některý atom má volný elektronový pár, tvoří adiční sloučeniny. Např. s vodou vytváří relativně stabilní komplex
- BF3 + H2 → F3B−—O+H2,
který se jen pozvolna za normální teploty rozkládá na kyselinu difluoroboritou a fluorovodík
- F3B−—O+H2 → HF + HBOF2.
Tato hydrolýza může proběhnout, byť pomalu a méně snadno, než tomu je u jiných halogenidů boritých (např. u chloridu boritého), sumárně až k rozkladu na kyselinu boritou
- BF3 + 3 H2O → H3BO3 + 3 HF.
V důsledku toho se při styku plynného fluoridu boritého s vlhkým vzduchem vytváří dým, tvořený směsí pevných hydrolytických produktů. Probíhá-li však hydrolýza ve vodném prostředí (např. rozpouštěním BF3 ve vodě), vzniká jako výsledný produkt směsný roztok, tvořený kyselinou boritou, kyselinou tetrafluoroboritou a kyselinou fluorovodíkovou
- 2 BF3 + 3 H2O → H3BO3 + 2 HF + HBF4.
S amoniakem vytváří fluorid boritý stabilní komplex
- BF3 + NH3 → F3B−—N+H3.
Významná je tvorba komplexu s diethyletherem
- BF3 + CH3OCH3 → F3B−—O+(CH3)2.
Tato sloučenina je za normálních podmínek kapalná a používá se při řadě aplikací ke skladování jinak nebezpečného fluoridu boritého nebo při manipulaci s ním.
Použití
[editovat | editovat zdroj]Fluorid boritý se používá v iontové implantaci pro vnášení atomů bóru (dopování) do monokrystalických vrstev křemíku pří výrobě polovodičů typu p. Obdobně se pro implantaci používá fluorid arsenitý nebo fluorid fosforečný pro implantaci arsenu, resp. fosforu.
Fyziologické působení
[editovat | editovat zdroj]Plynný fluorid boritý při nadechnutí uvolňuje působením vody ve sliznicích fluorovodík, který je dráždí. Ve větším množství může způsobit poleptání sliznic nebo kůže, případně až edém plic.
Reference
[editovat | editovat zdroj]- ↑ a b Boron trifluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
[editovat | editovat zdroj]- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Fluorid boritý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid boritý na Wikimedia Commons


