Škrkavka psí
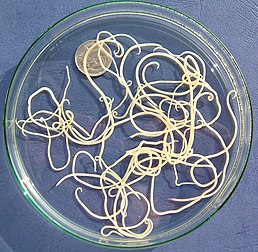 Dospělí jedinci škrkavky psí | |
| Vědecká klasifikace | |
| Říše | živočichové (Animalia) |
| Kmen | hlístice (Nematoda) |
| Třída | Secernentea |
| Řád | škrkavice (Ascaridida) |
| Nadčeleď | Ascaridoidea |
| Čeleď | Toxocaridae |
| Rod | Toxocara (Stilles, 1905) |
| Binomické jméno | |
| Toxocara canis (Werner, 1782) | |
| Některá data mohou pocházet z datové položky. | |
Škrkavka psí (Toxocara canis, Werner 1782) je celosvětově rozšířený červ z kmene Nematoda, který parazituje u psů a psovitých masožravců. Dospělí jedinci T. canis jsou odděleného pohlaví, bělavě žluté barvy, měří 9–18 cm a vyskytují se ve střevě definitivního hostitele. Škrkavky způsobují záněty střeva, migrující larvy škrkavek vyvolávají záněty v dalších orgánech. Zatímco u starších psů nevyvolávají většinou žádné klinické příznaky, u štěňat mohou způsobit závažné onemocnění končící úhynem. Jako paratenický hostitel slouží škrkavkám řada obratlovců včetně člověka a někteří bezobratlí. U lidí mohou larvy škrkavek způsobit vážné onemocnění zvané larvální toxokaróza.
Škrkavka psí představuje jednoho z nejběžnějších parazitů psů a vzhledem k možnosti přenosu z feny na štěňata se doporučuje preventivní odčervení feny a novorozených štěňat od 2.–3. týdne po narození. Mezi účinná anthelmintika používaná k léčbě psů patří například preparáty na bázi pyrantelu, fenbendazolu nebo mebendazolu.
Morfologie
[editovat | editovat zdroj]
Škrkavky psí jsou oblé hlístice, jejichž tělo je na obou koncích zašpičatělé a pokryté kroužkovanou kutikulou nažloutlé barvy. Samci měří 9–13 × 0,2–0,25 cm a samičky 10–18 × 0,25–0,3 cm.[1] Přední konec škrkavek je opatřen latelárními (bočními), poměrně širokými křidélky (alae) dlouhými 2,0–2,5 mm a širokými jen 0,2 mm. Samec má na ocasním konci kónusovitý prstovitý výběžek.[2] Vajíčka jsou oválná až kulovitá, silnostěnná s granulovaným povrchem, v čerstvém stavu obsahují jednu velkou tmavě šedou blastomeru, která vyplňuje celý obsah vajíčka. Velikost se pohybuje od 72 do 85 μm.[1]
Taxonomie
[editovat | editovat zdroj]Systematika a taxonomie, zejména na úrovni čeledí, není u škrkavek dosud ustálena. V rámci nadčeledi Ascaridoidea preferují někteří autoři dělení na čeledi Anisakidae a Ascarididae, která obsahuje rody Ascaris, Parascaris, Toxocara, Toxascaris a další méně známé rody.[3][4] Dle jiného zdroje[5] se nadčeleď Ascaridoidea člení na více čeledí: Anisakidae, Ascarididae a Toxocaridae (nově vytvořená čeleď) atd., z čehož plyne, že škrkavka psí (Toxocaridae) patří do jiné čeledě než třeba Ascaris lumbricoides (Ascarididae).
Biologie a vývojový cyklus
[editovat | editovat zdroj]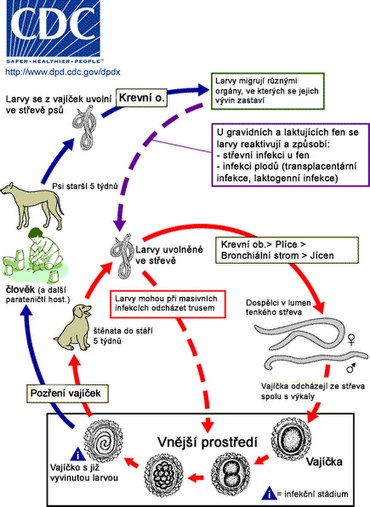
Dospělé škrkavky žijí v tenkém střevě definitivního hostitele, kde se živí střevním obsahem. Zde rovněž dochází k pohlavnímu rozmnožování. Oplozená vajíčka produkovaná samičkami škrkavek jsou vylučována trusem do vnějšího prostředí, kde se postupně rýhují. Ve vajíčku se rýhováním blastomery vyvíjí postupně larva 1. generace (larva L1). Ta se ve vajíčku dvakrát svléká až do stádia larvy 3. generace tzv. larvy L3. Toto stádium je již infekční. Vývoj larvy ve vajíčku trvá v závislosti na teplotě vnějšího prostředí 2–5 týdnů. Při teplotách pod 8 °C se larvy nevyvíjí a cyklus je přerušen, avšak vajíčka jsou nadále životná a při vzestupu teploty vývoj opět pokračuje. Teploty nad 35 °C způsobují značnou mortalitu (úmrtnost) larev. Vysoké teploty (zhruba nad 50 °C) a teploty pod bodem mrazu vajíčka s larvami devitalizují (usmrtí).[6]
Hostitel se nakazí pozřením vajíček obsahující larvy L3, které se dostanou do střeva. Larvy L3 se v tenkém střevě uvolní z vajíčka a pronikají skrze stěnu střevní do krevních kapilár a migrují organismem hostitele. Obecně se škrkavky rodu Toxocara vyznačují tzv. entero-hepato-pulmonálním typem migrace (larvy migrují ze střeva přes játra do plic). Larvy L3 se krevním řečištěm dostávají ze střeva do jater, a odtud žilním oběhem do pravého srdce. Ze srdce jsou larvy unášeny krví do plic, kde se usazují a postupně se vyvíjejí. Při průniku plicní tkáni larvy poškozují plicní sklípky a sliznici dolních cest dýchacích. Postupně se dostávají do průdušnice, jsou vykašlány a se slinami opět polknuty. Larvy se tak dostávají zpět do tenkého střeva, kde se naposledy svlékají a pohlavně dospívají. Do střeva se larvy dostávají zhruba za 10 dní po pozření vajíček hostitelem. Dospělci škrkavek ve střevě kopulují a samičky následně produkují vajíčka. Takto popsaný cyklus je označován jako tracheální migrace. Při tzv. somatické migraci se larvy dostávají z plic do velkého krevního oběhu a jsou krví roznášeny do všech orgánů, nejčastěji játra, ledviny, střevo, mozek, svalovina, podkoží. Zde se usazují, opouzdřují a mohou zůstat velmi dlouhou dobu životaschopné. Bylo prokázáno, že infekce mladých psů velkým počtem vajíček vede převážně k somatické migraci, zatímco nízký počet vajíček snáze dokončí vývoj jako pohlavně dospělé škrkavky ve střevě. U dospělých a starších zvířat dochází především k somatické migraci, a tím lze vysvětlit skutečnost, že se u těchto kategorií psů se škrkavky ve střevě vyskytují minimálně.[1]
Opouzdřené larvy v různých orgánech dospělých psů mají velký význam při přenosu škrkavek na štěňata. U gravidních (březích) fen dochází k aktivaci těchto larev, které prostupují přes placentu do plodu – transplacentární infekce. Štěňata se tudíž mohou narodit infikovaná. Rovněž dochází u fen po porodu k přestupu larev do mateřského mléka (laktogenní infekce) a štěňata se infikují při kojení.
Molekulární aspekty
[editovat | editovat zdroj]S ohledem na fakt, že molekulární biologie je relativně mladý, ale velmi progresivní obor, je rovněž řada molekulárních aspektů týkajících se T. canis stále předmětem intenzivního výzkumu. V porovnání s medicínsky významnějšími helminty jako je Schistosoma spp. či Ancylostoma spp., je značná část genů a proteinů T. canis dosud neprobádána. Prvním helmintem vůbec, u něhož byl popsán celý genom (udělena Nobelova cena za fyziologii a medicínu v roce 2002), je volně žijící půdní hlístice Caenorhabditis elegans. Její genom obsahuje celkem 19 000 genů.[7] Odhaduje se, že genom T. canis je zhruba stejně velký jako u škrkavky dětské (Ascaris lumbricoides), jejíž genom je asi 3 x větší než právě C. elegans. Zatímco buňky škrkavky dětské obsahují celkem 24 chromozómů, jaderná DNA T. canis je seskupena do 18 chromozómů.[8]
Hlavní pozornost parazitologů je zaměřena na tzv. exkrečně-sekreční produkty (antigeny) larválních stádií T. canis, jelikož tyto látky mají velký význam při vývoji vakcíny či nových imunodiagnostických postupů u larvální toxokarózy člověka. Exkrečně-sekreční produkty vylučují larvy během migrace hostitelským organizmem. Jedná se především proteolytické enzymy, které pomáhají parazitu při pohybu v tkáních. U škrkavky psí bylo popsán nejméně 6 různých mucinů,[9] 4 typy lektinů typu C,[8] cathepsin-Z-like proteázy (cysteinové proteázy)[10] a další různé proteiny.[8] Při vývoji molekulárních vakcín (DNA vakcíny) byl vytipován gen pro protein myosin, který se jeví jako vhodný kandidát pro přípravu DNA vakcíny.[11] Nicméně žádná komerčně dostupná vakcína proti T. canis dosud neexistuje.
Rozšíření
[editovat | editovat zdroj]Vzhledem k tomu, že člověk žil odjakživa ve společenství se psem, je T. canis rozšířena po celém světě. Během objevitelských plaveb a osídlování nových území byl vždy přítomen vedle člověka i pes. Následkem kolonizací jsou pak četné populace zdivočelých psů a koček v místech, kde se přirozeně žádní savci nikdy nevyskytovali. Proto jsou škrkavky přítomny i na všech ostrovech v Tichém oceánu, včetně Galapág.[8]
Definitivní hostitel
[editovat | editovat zdroj]
Mezi definitivní hostitele, u nichž škrkavky ve střevě pohlavně dospívají a množí se, patří všechna plemena psa domácího a ostatní zástupci čeledi psovitých (Canidae). Kromě psů je v odborných pracích nejčastěji popisována škrkavka psí u lišek obecných (Vulpes vulpes) a lišek polárních (Alopex lagopus).[12][13]
Přestože kočky obecně nejsou tímto druhem infikovány,[1] existují důkazy o nálezech T. canis larva migrans v ledvinách, játrech a plicích.[14] Kočka v tomto případě figurovala jako paratenický hostitel. Někteří autoři však referují dokonce o přítomnosti dospělých škrkavek T. canis ve střevech experimentálně infikovaných koček.[15] Faktem nicméně zůstává, že kočka nepatří mezi definitivní hostitele T. canis.
Klinické příznaky u psů
[editovat | editovat zdroj]
Škrkavky se klinicky manifestují zejména u štěňat. U dospělých psů je sice vysoká (až 100 %) prevalence, nicméně infekce škrkavkami probíhá u nich většinou bez klinických příznaků. Nejvíce nebezpečné jsou pro štěňata již transplacentární a laktogenní infekce, které mohou vést k úhynu během prvních dnů života. Od 2. až 3. týdne stáří štěňat se škrkavky nacházejí již ve střevě.

(foceno při zvětšení 400×)
Migrující larvy škrkavek v plicích vyvolávají zánět plic, který se projevuje kašlem a výtokem z nosu. Přítomnost dospělých škrkavek ve střevě štěňat může způsobit totální neprůchodnost střeva a vést až k ruptuře (prasknutí) střeva. Postižená štěňata mají zvětšené, bolestivé tzv. škrkavkové břicho. Dochází k častému zvracení, průjmu. Z dalších nespecifických příznaků lze pozorovat vyhublost, nechutenství, apatie, matnou srst, křeče až epileptické záchvaty, nebo také svědění a kopřivku. Slabé infekce probíhají většinou bez výraznějších klinických příznaků.[1][16] Někdy můžeme pozorovat u psů přechodné nechutenství či průjem střídaný se zácpou. Prognóza je u dospělých psů dobrá. V případě výskytu zjevných klinických příznaků (např. škrkavkové břicho) u štěňat je prognóza dubiózní až špatná.[17]
Významným patogenetickým faktorem při infekci T. canis je toxin askaridin. Tento toxin, který působí inhibičně na nervové synapse, je produkován dospělými škrkavkami a ve zvýšené míře se uvolňuje při rozkladu uhynulých škrkavek ve střevě hostitele. Askaridin je zodpovědný za křeče střevní svaloviny a může vést až k úhynu psa. V případech masivních infekcí po podání anthelmintik může dojít k rozkladu červů ve střevě a tím uvolnění značného množství askaridinu.[1] V důsledku toho může dojít ke křečím vedoucím až k úhynu odčervovaného psa.
Parateničtí hostitelé
[editovat | editovat zdroj]Vajíčky s vyvinutou larvou L3 se může nakazit celá řada obratlovců (nejčastěji drobní hlodavci nebo drůbež), včetně člověka. Vajíčka mohou pozřít i bezobratlí živočichové (např. žížala). U všech těchto hostitelů však dochází pouze k somatické migraci a larvy zůstávají opouzdřeny v různých orgánech. Škrkavky tedy nedokončí svůj vývoj a do střeva se nikdy nedostanou. Tyto hostitele označujeme jako paratenické. Význam paratenických hostitelů z hlediska parazita samotného spočívá především v tom, že slouží jako zdroj infekce. Psi a psovité šelmy se mohou nakazit právě pozřením infikovaného drobného hlodavce.[6] Při experimentálních infekcích u potkanů, kterým bylo aplikováno do úst cca 500 vajíček s infekční larvou, bylo zjištěno, že nejvíce larev se nacházelo v plicích, játrech, pod kůží, méně pak již v mozku a v ledvinách.[18]
Člověk
[editovat | editovat zdroj]Člověk jakožto paratenický hostitel se může nakazit pozřením vajíček T. canis s infekčními larvami L3 z prostředí nebo přímo larvami od jiného paratenického hostitele (konzumace tepelně neupraveného masa a orgánů zvířat). Podobně jako u ostatních paratenických hostitelů škrkavky v lidském těle migrují různými tkáněmi, ale nikdy nedospějí. Onemocnění, které takto migrující larvy vyvolávají se nazývá larvální toxokaróza.[8] V odborné literatuře se pro označení migrujících larev v organismu užívá pojem larva migrans. Larvy T. canis jsou krevním oběhem roznášeny do různých orgánů, kde vyvolávají zánětlivou reakci a vznik granulomů. Larvy u člověka se mohou lokalizovat v játrech, plicích nebo v mozku. V tomto případě se užívá pojem larva migrans visceralis. Larvy Toxocara sp. mají rovněž vysokou afinitu k oku (larva migrans ocularis).[8] Přítomnost larev L3 v oku může narušit sítnici a vede ke ztrátě zraku.[8][16] Na základě epidemiologických dat je patrné, že larvální toxokaróza u lidí je vždy ve formě orgánové, oční anebo bezpříznakové.[8] Zatímco u dětí do pěti let je typická orgánová forma, u starších dětí (nad pět let) a dospělých převažuje forma oční.[8] Při epidemiologickém hodnocení je třeba odlišit skutečný počet nemocných od tzv. séroprevalence, což je počet jedinců v dané populaci, u nichž byly zjištěny protilátky proti T. canis. Ne u všech séropozitivních jedinců přitom muselo dojít ke klinickému onemocnění. Například v Česku se uvádí séroprevalence okolo 18–20 %, ale skutečný počet pacientů nemocných toxokarózou je daleko nižší a většina onemocnění probíhá bez příznaků.[19] Séroprevalence u dětí ve věku od 1 do 11 let z různých států USA v letech 1971–1973 se pohybovala od 4,6 do 7,3 %.[20] V tropických oblastech, zejména v rozvojových zemích, dosahuje séroprevalence daleko vyšších hodnot. V některých zemědělských oblastech Tchaj-wanu činila séroprevalence u lidí 46 %,[21] na ostrově Bali až 63,2 %.[22] Ve francouzské ostrovní kolonii Réunion v Indickém oceánu byly zjištěny protilátky proti T. canis dokonce u 92,8 % tamních obyvatel.[22]
Vajíčka ve vnějším prostředí
[editovat | editovat zdroj]
Zdrojem vajíček jsou výkaly psů, zejména pak štěňat. Vajíčka se s trusem psů dostávají do půdy, kde se kumulují. V půdě vydrží životaschopná až 3 roky.[1] Ve vnějším prostředí jsou vajíčka škrkavek rozptýlena pomocí vody, činností žížal a mechanickým přenosem na zobácích a nohou ptáků. Parateničtí hostitelé, kteří pozřou vajíčka T. canis, se také podílejí na šíření škrkavek v prostředí.[8]
Kontaminace půdy je závažným problémem městských travnatých ploch, především městských parků.[23] Ve většině velkých měst se provádějí odběry vzorků půdy z městských parků a zahrad či dětských hřišť s cílem zjistit přítomnost vajíček T. canis nebo T. cati. Například v sedmdesátých létech 20. století bylo při odběrech z londýnských parků zjištěny vajíčka T. canis v 35 % vzorcích půdy.[6] V brazilském Rio de Janeiru bylo téměř 42 % vzorků půdy z veřejných prostranství pozitivních na T. canis.[23] V hlavním městě Peru Limě byla dokonce 80 % pozitivita T. canis v půdě.[24]
Podle řady studií je séroprevalence T. canis u lidí na venkově většinou vyšší než u obyvatel žijících ve městech.[25][26][27][22] Z tohoto důvodu, je riziko nákazy větší u člověka na venkově než u lidí z městských aglomerací. Proto také kontaminace půdy na venkově může být velmi významná. Vajíčka se kumulují v půdách na travnatých prostorách ve vesnicích, na zahrádkách a dvorcích, polích či kompostech. Nejpravděpodobnějším vysvětlením tohoto faktu je, že na venkově je veterinární prevence na nižší úrovni. To znamená, že zdaleka ne všichni psi a kočky (v případě T. cati) na venkově jsou pravidelně odčervováni.[27]
Hlavními faktory ovlivňující životaschopnost vajíček a larev škrkavek v prostředí je teplota a vlhkost. Bylo prokázáno, že v půdě, kde se drží konstantní vlhkost, vajíčka vydrží déle životaschopná než na pískovištích, kde vajíčka při slunečných dnech rychle vysychají, a tudíž se inaktivují. Vajíčka jsou citlivá pouze na teploty pod bodem mrazu a vydrží i relativně vysoké teploty (kolem 40 °C). Při teplotách –15 °C vajíčka ztrácejí životaschopnost a larvy hynou. Přesto však v kanadském Montrealu, kde teploty v zimě klesají na -26 °C je 32,5 % vzorků půdy pozitivních.[6]
Jeden z dalších faktorů, který ovlivňuje výskyt vajíček škrkavek v prostředí, je přítomnost mikroskopických hub, respektive plísní. Bylo již prokázáno u jiných hlístic, že výskyt plísní v půdě má negativní vliv na vajíčka. Hyfy plísní buď vajíčka parazitů hubí nebo brzdí jejich vývoj.[28] Proto má výzkum vztahu plísní a hlístic v půdě zásadní význam jakožto potenciální způsob biologického boje proti parazitům. Jedním z druhů plísní, které mají inhibiční účinek na škrkavku psí, je druh Fusarium pallidoroseum. Předpokládá se, že mycelia této plísně pronikají do vajíček T. canis a narušují tak jejich další vývoj.[29] Vajíčka škrkavky psí ničí rovněž plíseň Paecilomyces lilacinus.[30]
Zdroje infekce
[editovat | editovat zdroj]U psů
[editovat | editovat zdroj]Štěňata se nejčastěji nakazí transplacentární nebo laktogenní cestou.[1] Díky somatické migraci tak v těle každého infikovaného štěněte larvy zůstanou opouzdřeny v tkáních a mladý pes se tak stává latentním (skrytý, bezpříznakový) nosičem škrkavek. U gravidních nebo laktujících fen se tyto larvy aktivují a krevním oběhem se dostávají do plodu feny či po porodu do mléka. Dospělí psi i mladí psi se také mohou nakazit pozřením škrkavkami infikovaného paratenického hostitele.
U lidí
[editovat | editovat zdroj]Člověk se může nakazit nejčastěji z vajíček s larvami pocházejících z kontaminované půdy. Pojídání půdy (geofágie) u malých dětí či retardovaných osob nebo olizovaní špinavých rukou od hlíny je nejčastější příčinou infekce.[31][8] Proto je taky největší počet případů larvální toxokarózy u dětí do pěti let.[1][8] Rizikovým faktorem v domácnostech je kontakt s laktující fenou či štěňaty. Rovněž veterinární lékaři, veterinární technici a ošetřovatelé zvířat jsou vystaveni vyššímu riziku nákazy.[8] Nebylo však prokázáno, že by chovatelé psů a veterinární personál byli častěji nakaženi T. canis než zbytek populace. Například američtí autoři uvádějí srovnatelnou séroprevalenci T. canis mezi zaměstnanci veterinární nemocnice a populací lidí, kteří nechovají psy.[32] Další studie provedená v Rakousku zase naznačuje, že riziko infekce může souviset i s jinými faktory. Během roku 1999 byla odebrána krev na stanovení přítomnosti protilátek proti T. canis celkem 585 plně zdravým dospělým obyvatelům Štýrska. Autoři se zaměřili na 4 rizikové skupiny lidí dle povolání. Podle jejich výsledků byla nejvyšší séroprevalence (44 %) zjištěna u farmářů, za nimi se pak umístili veterináři (27 %), zaměstnanci jatek (25 %) a nakonec myslivci (17 %). U negativní kontroly, jež představovala běžné obyvatele města Graz, činila prevalence pouhé 2 %. Z toho vyplývá, že největšímu riziku nákazy T. canis jsou vystaveni zemědělci, tedy lidé, kteří žijí a pracují na venkově.[27] Zdá se být zřejmé, že riziko infekce pro dospělého člověka nesouvisí příliš s faktem, zda je člověk chovatelem psa či je s nimi často v kontaktu, ale spíše v jakém prostředí žije a pracuje. To ostatně dokládají i vyšší séroprevalence (protilátky v krvi, nemusí být klinicky nemocní) u populací lidí žijících na venkově než ve městech.[25][26][22]
Diagnostika
[editovat | editovat zdroj]
(foceno při zvětšení 400×)

(foceno při zvětšení 400×)
U psů
[editovat | editovat zdroj]Diagnostika u psů je založena především na koprologickém a klinickém vyšetření. Při koprologickém vyšetření lze najít typická oválná až kulatá silnostěnná vajíčka (o velikosti 72–85 μm) s granulovaným povrchem a tmavou blastomerou vyplňující celý obsah vajíčka.[1] Je třeba odlišit vajíčka Toxascaris leonina, která se může u psů rovněž vyskytovat. Vajíčka T. leonina měří 75–85 μm, nemají na rozdíl od T. canis výrazně granulovaný povrch, jejich blastomera je světlejší, menší a uložena excentricky.[1][2][16] Dospělé škrkavky mohou odcházet samovolně trusem nebo je pes může vyzvracet. Vedle klinických příznaků (viz kapitola Klinické příznaky u psů) a koprologie může v diagnostice pomoci i hematologické vyšetření s nálezem eosinofilie.
U lidí
[editovat | editovat zdroj]U lidí je diagnostika založena především na laboratorních metodách (hematologie, biochemie, sérologie, biopsie) a důsledném klinickém vyšetření. Orgánová forma larvální toxokarózy se diagnostikuje sérologickými a hematologickými metodami. Podezření na škrkavky naznačuje nález eosinofilie a hyperglobulinemie či zvětšení jater, avšak teprve sérologický test potvrzuje diagnózu. Ze sérologických testů se nejčastěji používá ELISA, méně pak Western blot, při kterých se zjišťuje přítomnost specifických protilátek (a to buď IgG nebo IgE) proti T. canis. Jako antigen se v těchto metodách používá výše zmiňovaný exkrečně-sekreční produkt larev L3 získaný jejich kultivací v tkáňovém médiu.[33]
V případě oční toxokarózy má zásadní význam oční vyšetření s nálezem larvy či granulomů na sítnici. Sérologické vyšetření u oční formy není spolehlivé. Podle jedné studie pouze u 45 % pacientů s klinicky diagnostikovanou oční formou byly detekovány specifické protilátky proti T. canis.[34]
Terapie a prevence
[editovat | editovat zdroj]Hlavním terapeutickým a zároveň preventivním opatřením při tlumení škrkavek u psů je pravidelná dehelmintizace. Zatímco dospělé psy stačí odčervovat jen v případě pozitivního koprologického vyšetření, u nejmladších kategorií štěňat a gravidních fen je periodická dehelmintizace nevyhnutelná.[35] U fen, u kterých dochází k aktivaci encystovaných larev během gravidity, doporučují někteří autoři podat preventivně anthelmintika již před krytím (pářením) a dále pak 3. týden po narození štěňat.[1] Jiní autoři doporučují odčervení feny denně pomocí fenbendazolu od 40. dne gravidity (tedy dva týdny před porodem) do 2. týdne po porodu.[16] U novorozených štěňat je doporučené schéma odčervení: 2., 4., 6., 8. týden po narození, dále každé dva měsíce až do věku 6 měsíců.[35] Opakované odčervení ve dvoutýdenním intervalu je důležité, protože anthelmintikum působí v organismu jen po dobu 24 hodin a pouze na dospělé škrkavky ve střevě hostitele.[36] Larvy, které v okamžiku aplikace léčiva migrující tkáněmi, tak nejsou zasaženy. Ve velkých chovech psů je třeba dbát na dodržování hygienických standardů (čištění kotců apod.) a zabránit psům v pojídání drobných hlodavců.
Pravidelným odčervením štěňat i dospělých psů se zároveň snižuje kontaminace prostředí vajíčky.[6] Stejně tak odklízení psích výkalů nebo odchyt toulavých psů ve městech má preventivní účinek a vede ke snížení kontaminace půdy.


K odčervení psů se používá celá řada anthelmintik s různou účinností, většinou ve formě tablet, pasty, spot-on nebo v injekční formě.
| Účinná látka | Název přípravku |
|---|---|
| pyrantel | Banminth® pasta |
| fenbendazol | Panacur® tbl., Fenbion® tbl. |
| flubendazol | Flubenol® |
| mebendazol | Telmin® KH |
| selamektin | Stronghold® |
| ivermektin | Ivomec® |
| nitroskanát | Lopatol® tbl., Troscan® |
| praziquantel+pyrantel+febantel | Drontal® Plus, Dehinel® Plus, Prazinon® Plus, Zipyran® Plus |
| oxibendazol+niklosamid | Polyverkan®, Vitaminthe Oral® |
| praziquantel+fenbedazol | Caniquantel® Plus, Bihelminth® mv, Optivermin® tbl., Zantel® |
| praziquantel+pyrantel | Helm-Ex®, Pratel® |
| fenbendazol+pyrantel+praziquantel | Caniverm®, Cestal® Plus |
| moxidektin+imidakloprid | Advocate® |
| mylbemicin+praziquantel | Milbemax® |
Výsledky účinností různých anthelmintik se liší mezi jednotlivými studiemi. V Německu srovnávali různá anthelmintika u psů a koček v terénních podmínkách. Stanovená účinnost u pyrantelu 75,5 %, piperazinu 82,8 %, fenbendazolu 93,8 % a mebendazolu 89 % ukazuje, že dříve a často používané účinné látky pyrantel a piperazin vykázaly nižší účinnost než méně často aplikované benzimidazoly.[38] Při studii v Pákistánu provedené u psů masivně infikovaných T. canis byly testovány látky pyrantel, levamisol a ivermektin. Bylo zjištěno, že zatímco levamisol a ivermektin vykazovaly 100 % účinnost, pyrantel účinkoval jen z 95 %.[39] V Česku byla sledována účinnost různých anthelmintik proti T. canis u štěňat v chovné stanici Policie ČR. Při použití kombinace praziquantel, febantel, pyrantel (Drontal Plus®) byla účinnost 76 %, účinnost levamizolu (Decaris®) 52,9 %, zatímco účinnost mebendazolu (Telmin KH®) byla 100 %. Po aplikaci oxibendazolu s niklosamidem (Polyverkan®) byla účinnost 58,6 % a po podání fenbendazolu (Fenbion®) 80 %.[40]
Rovněž makrocyklické laktony působí proti škrkavkám. Jedná se především o milbemycin[41] či moxidektin[42][43][44].
Terapie u lidí je rovněž založena na aplikaci anthelmintik, případné symptomatické léčbě. Lékem první volby jsou benzimidazoly albendazol, mebendazol nebo thiabendazol.[8][22] Dle jedné pediatrické učebnice je doporučována dávka 400 mg albendazolu dvakrát denně po dobu pěti dní.[8] V případě oční formy je často vedle anthelminitcké léčby vyžadován i chirurgický zákrok či laserová terapie. K potlačení alergických příznaků se podávají kortikosteroidy. Kromě některých pacientů s oční či mozkovou formou (larvy v mozku) je prognóza při adekvátní léčbě larvální toxokarózy všeobecně příznivá.[22]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]- ↑ a b c d e f g h i j k l SVOBODOVÁ, V.; SVOBODA, M. Klinická parazitologie psa a kočky. Brno: ČAVLMZ, 1995. 238 s.
- ↑ a b JURÁŠEK, V.; DUBINSKÝ, P. Veterinárna parazitológia. Bratislava: Príroda, 1993. 382 s. ISBN 80-07-00603-6.
- ↑ BioLib: Profil taxonu Ascaridoidea [online]. [cit. 2008-02-20]. Dostupné online.
- ↑ VOLF, P.; HORÁK, P, et al. Paraziti a jejich biologie. Praha: Triton, 2007. 318 s. ISBN 978-80-7387-008-9.
- ↑ UniProt: Family Ascaridoidea [online]. [cit. 2008-02-20]. Dostupné online. (anglicky)
- ↑ a b c d e GILLESPIE, S. H. The epidemiology of Toxocara canis. Parasitol Today. Červen 1988, roč. 4, čís. 6, s. 180–182. PMID 15463080. (anglicky)
- ↑ C. elegans Sequencing Consortium. Genome sequence of the nematode C. elegans: a platform for investigating biology. Science. Prosinec 1998, roč. 282, čís. 5396, s. 2012–2018. Dostupné online. PMID 9851916. (anglicky)
- ↑ a b c d e f g h i j k l m n o DESPOMMIER, D. Toxocariasis: clinical aspects, epidemiology, medical ecology, and molecular aspects. Clin Microbiol Rev. Duben 2003, roč. 16, čís. 2, s. 265–272. Dostupné online. PMID 12692098. (anglicky)
- ↑ DOEDENS, A.; LOUKAS, A.; MAIZELS, R. M. A cDNA encoding Tc-MUC-5, a mucin from Toxocara canis larvae identified by expression screening. Acta Trop. Červen 2001, roč. 79, čís. 3, s. 211–217. PMID 11412804. (anglicky)
- ↑ FALCONE, F. H., et al. The new subfamily of cathepsin-Z-like protease genes includes Tc-cpz-1, a cysteine protease gene expressed in Toxocara canis adults and infective stage larvae. Exp Parasitol. Březen 2000, roč. 94, čís. 3, s. 201–207. PMID 10831387. (anglicky)
- ↑ OBWALLER, A., et al. Recombinant dissection of myosin heavy chain of Toxocara canis shows strong clustering of antigenic regions. Parasitol Res. Květen 2001, roč. 87, čís. 5, s. 383–389. PMID 11403381. (anglicky)
- ↑ TAIRA, K.; SAEED, I.; KAPEL, C. M. Dose-dependent egg excretion in foxes (Vulpes vulpes) after a single infection with Toxocara canis eggs. Parasitol Res. Říjen 2002, roč. 88, čís. 10, s. 941–943. PMID 12209336. (anglicky)
- ↑ SAEED, I.; TAIRA, K.; KAPEL, C. M. Toxocara canis in experimentally infected silver and arctic foxes. Parasitol Res. Září 2005, roč. 97, čís. 2, s. 160–166. PMID 15986242. (anglicky)
- ↑ PARSONS, J. C.; BOWMAN, D. D.; GRIEVE, R. B. Pathological and haematological responses of cats experimentally infected with Toxocara canis larvae. Int J Parasitol. Srpen 1989, roč. 19, čís. 5, s. 479–488. Dostupné online. PMID 2777467. (anglicky)
- ↑ BHOWMICK, D. K. Beitraege zu dem Problem der Wanderwege der Askaridenlarven (Ascaris lumbricoides Linne 1758 und Toxocara canis Werner 1782) in Experimentellen und Natuerlichen Wirt.. Z Parasitenkd. Duben 1964, roč. 24, s. 121–168. PMID 14208916. (německy)
- ↑ a b c d The Merck Veterinary Maual: Roundworms (Ascariasis) [online]. Whitehouse Station, NJ USA: Merck, 2006 [cit. 2008-02-08]. Dostupné online. (anglicky)
- ↑ SVOBODA, M.; SENIOR, D.; DOUBEK, J.; KLIMEŠ, J. Nemoci psa a kočky - II. díl. Brno: Noviko, 2001. 1019 s. ISBN 80-902595-3-7.
- ↑ LESCANO, S. Z.; QUEIROZ, M. L.; CHIEFFI, P. P. Larval recovery of Toxocara canis in organs and tissues of experimentally infected Rattus norvegicus.. Mem Inst Oswaldo Cruz. Říjen 2004, roč. 99, čís. 6, s. 627–628. PMID 15558175. (anglicky)
- ↑ KOLÁŘOVÁ, L. Tkáňové helmintózy. Klin mikrobiol inf lék. 2006, roč. 12, čís. 4, s. 131–134. Dostupné v archivu pořízeném dne 2007-10-21. Archivováno 21. 10. 2007 na Wayback Machine.
- ↑ HERRMANN, N., et al. Seroprevalence of zoonotic toxocariasis in the United States: 1971–1973. Am J Epidemiol. Listopad 1985, roč. 122, čís. 5, s. 890–896. PMID 4050776. (anglicky)
- ↑ FAN, C. K., et al. Seroepidemiology of Toxocara canis infection among mountain aboriginal adults in Taiwan. Am J Trop Med Hyg. Srpen 2004, roč. 71, čís. 2, s. 216–221. PMID 15306714. (anglicky)
- ↑ a b c d e f Sun Huh. eMedicine: Toxocariasis [online]. Omaha, Nebraska: WebMD, rev. 2006-06-15 [cit. 2008-02-08]. Dostupné online. (anglicky)
- ↑ a b COELHO, L. M., et al. Human toxocariasis: a seroepidemiological survey in schoolchildren of Sorocaba, Brazil. Mem Inst Oswaldo Cruz. Říjen 2004, roč. 99, čís. 6, s. 553–557. PMID 15558160. (anglicky)
- ↑ LESCANO, S. A., et al. Soil contamination and human infection by Toxocara sp. in the urban area of Lima,Peru. Mem Inst Oswaldo Cruz. Prosinec 1998, roč. 93, čís. 6, s. 733–734. PMID 9921292. (anglicky)
- ↑ a b HAVASIOVÁ, K.; DUBINSKÝ, P.; STEFANCÍKOVÁ, A. A seroepidemiological study of human Toxocara infection in the Slovak Republic. J Helminthol. Prosinec 1993, roč. 67, čís. 4, s. 291–296. PMID 8132974. (anglicky)
- ↑ a b UHLÍKOVÁ, M.; HÜBNER, J. Seroprevalence of Toxocara canis infection in Czech Republic. Cent Eur J Public Health. Srpen 1998, roč. 6, čís. 3, s. 195–198. PMID 9787920. (anglicky)
- ↑ a b c DEUTZ, A., et al. Toxocara-infestations in Austria: a study on the risk of infection of farmers, slaughterhouse staff, hunters and veterinarians. Parasitol Res. Listopad 2005, roč. 97, čís. 5, s. 390–394. PMID 16151740. (anglicky)
- ↑ LÝSEK, H.; KRAJČÍ, D. Penetration of ovicidal fungus Verticillium chlamydosporium through the Ascaris lumbricoides egg-shells. Folia Parasitol (Praha). 1987, roč. 34, čís. 1, s. 57–60. PMID 3583130. (anglicky)
- ↑ CIARMELA, M. L., et al. Biological interaction between soil fungi and Toxocara canis eggs. Vet Parasitol. Leden 2002, roč. 103, čís. 3, s. 251–257. PMID 11750118. (anglicky)
- ↑ BASUALDO, J. A., et al. Biological activity of Paecilomyces genus against Toxocara canis eggs. Parasitol Res. Říjen 2000, roč. 86, čís. 10, s. 854–859. PMID 11068820. (anglicky)
- ↑ MARMOR, M., et al. Toxocara canis infection of children: epidemiologic and neuropsychologic findings. Am J Public Health. Květen 1987, roč. 77, čís. 5, s. 554–559. Dostupné online. PMID 3565646. (anglicky)
- ↑ GLICKMAN, L. T.; CYPESS, R. H. Toxocara infection in animal hospital employees. Am J Public Health. Prosinec 1977, roč. 67, čís. 12, s. 1193–1195. Dostupné online. PMID 563680. (anglicky)
- ↑ JACQUIER, P, et al. Immunodiagnosis of toxocarosis in humans: evaluation of a new enzyme-linked immunosorbent assay kit. J Clin Microbiol. Září 1991, roč. 29, čís. 9, s. 1831–1835. Dostupné online. PMID 1774303. (anglicky)
- ↑ SCHANTZ, P. M. Toxocara larva migrans now. Am J Trop Med Hyg. Září 1989, roč. 41, čís. 3, s. 21–34. PMID 2679161. (anglicky)
- ↑ a b VERNEROVÁ, E. Zastoupení účinných látek v anthelmintických přípravcích určených pro psy a kočky u registrovaných léčiv v ČR. Veterinářství. 2005, roč. 55, s. 309–310.
- ↑ Paraziti psů a koček [online]. www.veterinarni-prevence.cz [cit. 2008-05-22]. Dostupné v archivu pořízeném dne 2009-04-14.
- ↑ AISLP. Mikro-verze 2008.1 [CD-ROM]. Praha: Bohuslav Škop, rev. 2008-01-? [cit. 2008-02-08]. Dostupné v archivu pořízeném dne 2008-02-09.
- ↑ ENDE, C. Investigation of the resistance of Toxocara canis and Toxocara cati to anthelmintics. Der Praktische Tierarzt. 1993, roč. 9, s. 811–822. (německy)
- ↑ MAQBOOL, A., et al. Prevalence and chemotherapy of toxocariasis in the dog in Faisalabad (Punjab), Pakistan. Vet Arhiv. 1998, roč. 68, s. 121–125. (anglicky)
- ↑ HOŘEJŠÍ, R. Účinnost anthelmintik na škrkavky u štěňat. Veterinářství. 1999, roč. 49, s. 393–396.
- ↑ NOLAN, T. J.; LOK, J. B. Macrocyclic lactones in the treatment and control of parasitism in small companion animals. Curr Pharm Biotechnol. 2012, roč. 13, čís. 6, s. 1078–1094. Dostupné online.
- ↑ GARGILI, A., et al. Efficacy of moxidectin against Toxocara canis in experimentally infected dogs. Turkish J Vet Anim Sci. 1999, roč. 23, s. 159–161. Dostupné v archivu pořízeném dne 02-05-2005. (anglicky) Archivováno 2. 5. 2005 na Wayback Machine.
- ↑ REINEMEYER, C. R.; CHARLES, S. Evaluation of the efficacy of a combination of imidacloprid and moxidectin against immature Toxocara cati in cats. Parasitol Res. Červenec 2003, roč. 90, čís. suppl.3, s. 140–141. Dostupné online. PMID 12928882. (anglicky)[nedostupný zdroj]
- ↑ VON SAMSON-HIMMELSTJERNA, G., et al. Larvicidal and persistent efficacy of an imidacloprid and moxidectin topical formulation against endoparasites in cats and dogs. Parasitol Res. Červenec 2003, roč. 90, čís. suppl. 3, s. 114–115. PMID 12928872. (anglicky)
Literatura
[editovat | editovat zdroj]- SVOBODOVÁ, V.; SVOBODA, M. Klinická parazitologie psa a kočky. Brno: ČAVLMZ, 1995. 238 s.
- JURÁŠEK, V.; DUBINSKÝ, P. Veterinárna parazitológia. Bratislava: Príroda, 1993. 382 s. ISBN 80-07-00603-6.
- DESPOMMIER, D. Toxocariasis: clinical aspects, epidemiology, medical ecology, and molecular aspects. Clin Microbiol Rev. Duben 2003, roč. 16, čís. 2, s. 265–272. Dostupné online. ISSN 0893-8512. PMID 12692098. (anglicky)
Související články
[editovat | editovat zdroj]- Toxocara cati (škrkavka kočičí) – parazituje u koček a kočkovitých šelem
- Toxocara vitulorum – parazit skotu, zebu, buvolů
- Toxocara malaysiensis – parazit koček v Malajsii
- Toxocara lyncis – parazit karakalů
- Toxocara pteropodis – parazit netopýrů z čeledi kaloňovitých
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu škrkavka psí na Wikimedia Commons
Obrázky, zvuky či videa k tématu škrkavka psí na Wikimedia Commons  Taxon Toxocara canis ve Wikidruzích
Taxon Toxocara canis ve Wikidruzích
česky
anglicky
- The Merck Veterinary Manual
- Animal Planet Videos: Monsters Inside Me: The Puppy-Borne Parasite
- Emedicine – Toxocariasis
- CDC Parasitic Diseases Division – Toxocariasis
- DPDx, Parasite Image Library – Toxocariasis
