Oxid praseodymito-praseodymičitý
| Oxid praseodymito-praseodymičitý | |
|---|---|
 | |
| Obecné | |
| Systematický název | Oxid praseodymito-praseodymičitý |
| Německý název | Praseodym(III,IV)-oxid |
| Funkční vzorec | Pr2O3 · 4 PrO2 |
| Sumární vzorec | Pr6O11 |
| Vzhled | černá bezzápašná pevná látka[1] |
| Identifikace | |
| Registrační číslo CAS | 12037-29-5 |
| PubChem | 16211481 |
| Vlastnosti | |
| Molární hmotnost | 1 021,44 g/mol |
| Teplota tání | 2 500 °C[1] |
| Teplota varu | 4 200 °C[1] |
| Hustota | 6,5 g/cm3 (při 20 °C v pevném stavu)[1] |
| Rozpustnost ve vodě | prakticky nerozpustný ve vodě[1] |
| Bezpečnost | |
| [1][2] Varování[2] | |
| H-věty | H315, H319, H335 |
| P-věty | P261, P305+351+338[1] |
Některá data mohou pocházet z datové položky. | |
Oxid praseodymito-praseodymičitý (Pr6O11) je chemická sloučenina prvků praseodymu a kyslíku, kterou lze zařadit mezi oxidy kovů.
Výskyt v přírodě
[editovat | editovat zdroj]Oxid praseodymito-praseodymičitý se v přírodě nejčastěji vyskytuje jako příměs v některých minerálech, např. v bastnesitu, monazitu nebo xenotimu.[3]
Vlastnosti
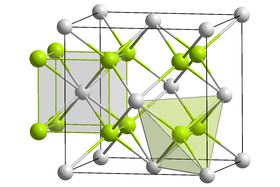
[editovat | editovat zdroj]Oxid praseodymito-praseodymičitý je černá pevná látka bez vůně, či zápachu, prakticky zcela nerozpustná ve vodě.[1] V základní struktuře je trojmocný praseodym zastoupen dvakrát, čtyřmocný čtyřikrát, formálně správnější by tedy byl funkční vzorec Pr2O3 · 4 PrO2. Krystalizuje v kubické krystalografické soustavě se strukturou fluoritu, kde však 1/12 kyslíkových pozic zůstává neobsazena; mřížková konstanta zde činí 5,468 Å.[4][5][6] Rozkládá se při kontaktu s vodní párou za vzniku oxidu praseodymičitého a hydroxidu praseodymitého.[7]
Za povšimnutí stojí též fakt, že existuje ještě jedna mezifáze mezi oxidem praseodymitým a oxidem praseodymičitým, s funkčním vzorcem 2 Pr2O3 · n PrO2 (kde n je libovoné číslo mezi 0 a 8), respektive sumárním vzorcem PrnO2n−2 (kde n je libovolné číslo mezi 4 a 12).[8]
Příprava/výroba
[editovat | editovat zdroj]Oxid praseodymito-praseodymičitý může být získán jednoduchým spálením praseodymu za přítomnosti kyslíku.[9]
Použití
[editovat | editovat zdroj]Oxid praseodymito-praseodymičitý se pro svoji sytě černou barvu používá například při barvení skla nebo keramiky.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Praseodym(III,IV)-oxid na německé Wikipedii.
- ↑ a b c d e f g h Záznam sloučeniny CAS 12037-29-5[nedostupný zdroj] v databázi GESTIS Institutu bezpečnosti a zdraví německé asociace pojišťovatelů, zadán dne 2. února 2013.
- ↑ a b Praseodymium(III,IV) oxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ SASTRI, V. S.; BUNZLI, Jean-Claude G.; RAMACHANDRA RAO, V. Modern Aspects of Rare Earths and Their Complexes. [s.l.]: Elsevier Science & Technology, 2003. Dostupné online. ISBN 978-0-44451010-5. S. 13.
- ↑ JØRGENSEN, Christian Klixbüll; RIITERSHAUS, Elfriede. Powder-diagram and Spectroscopic Studies of Mixed Oxides of Lanthanides and Quadrivalent Metals. Mat. Fys. Medd. Dan. Vid. Selsk.. 1967, roč. 15, čís. 35, s. 15. Dostupné v archivu pořízeném dne 2018-09-02.
- ↑ MCCULLOUGH, J. D. An X-Ray Study of the Rare-earth Oxide Systems: CeIV—NdIII, CrIV—PrIII, CeIV—PrIV and PrIV—NdIII. Journal of the American Chemical Society. 1950, roč. 72, čís. 3, s. 1386–1390. DOI 10.1021/ja01159a085.
- ↑ GUTH, E. Daniel; HOLDEN, J. R.; BAENZIGER, N. C.; EYRING, LeRoy. Praseodymium Oxides. II. X-Ray and Differential Thermal Analyses. Journal of the American Chemical Society. 1954, roč. 76, čís. 20, s. 5239–5242. DOI 10.1021/ja01649a088.
- ↑ BECKY L., Treu; FAHRENHOLTZ, William; O'KEEFE, Matthew; MORRIS, Eric; ALBERS, Richard. Effect of Phase on the Electrochemical and Morphological Properties of Praseodymium-Based Coatings. ECS Transactions. 2011, roč. 35, čís. 33, s. 53–66. DOI 10.1149/1.3577753.
- ↑ MASHELKAR, R. A. Solid State Chemistry: Selected Papers of C N R Rao. [s.l.]: World Scientific, 1995. ISBN 981279589-8. S. 339.
- ↑ ADACHI, Ginya; IMANAKA, Nobuhito; KANG, Zhen Chuan. Binary rare earth oxides. [s.l.]: Springer Netherlands, 2004. ISBN 978-1-40202568-6. S. 166.
Literatura
[editovat | editovat zdroj]- MARTIN, R. L. Oxides of Praseodymium. Nature. 4. února 1950, roč. 165, čís. 4188, s. 202–203. DOI 10.1038/165202b0.
- WEISEMOELLER, T.; DEITER, C.; BERTRAM, F.; GEVERS, S.; GIUSSANI, A.; ZAUMSEIL, P.; SCHROEDER, T. Epitaxy of single crystalline PrO2 films on Si(111). Applied Physics Letters. 2008, roč. 93, čís. 3, s. 032905. Dostupné online [PDF]. DOI 10.1063/1.2958227.[nedostupný zdroj]
- SHAMSHI HASSAN, M.; SHAHEER AKHTAR, M.; SHIM, Kyung-Bo; YANG, O-Bong. Morphological and Electrochemical Properties of Crystalline Praseodymium Oxide Nanorods. Nanoscale Research Letters. 2010, roč. 5, čís. 4, s. 735–740. DOI 10.1007/s11671-010-9547-8.
- FERRO, Sergio. Physicochemical and Electrical Properties of Praseodymium Oxides. International Journal of Electrochemistry. 2011, roč. 2011, čís. 561204, s. 1–7. DOI 10.4061/2011/561204.

