Chlorid ceritý
| Chlorid ceritý | |
|---|---|
 Vzorek chloridu ceritého | |
| Obecné | |
| Systematický název | chlorid ceritý |
| Anglický název | Cerium(III) chloride |
| Sumární vzorec | CeCl3 |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | 7790-86-5 |
| PubChem | 24636 |
| SMILES | [Cl-].[Cl-].[Cl-].[Ce+3] |
| InChI | InChI=1S/Ce.3ClH/h;3*1H/q+3;;;/p-3á látks |
| Vlastnosti | |
| Molární hmotnost | 246,48 g/mol (bezvodý) 372,58 g/mol (heptahydrát) |
| Teplota tání | 817 °C (1 090 K) (bezvodý) |
| Teplota varu | 1 727 °C (2 000 K) |
| Teplota rozkladu | 90 °C (363 K) (heptahydrát) |
| Hustota | 3,97 g/cm3 |
| Rozpustnost ve vodě | 100 g/100 ml |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu a acetonu |
| Struktura | |
| Krystalová struktura | šesterečná (typ UCl3) |
Některá data mohou pocházet z datové položky. | |
Chlorid ceritý (CeCl3) je sloučenina ceru a chloru; hygroskopická pevná látka. Na vzduchu rychle pohlcuje vlhkost za vzniku hydrátu proměnlivého složení. Je velmi dobře rozpustný ve vodě a v bezvodé formě také v ethanolu a acetonu.[1]
Příprava bezvodého CeCl3
[editovat | editovat zdroj]Samotné zahřívání hydrátu může vést k hydrolýze.[2]
V použitelné podobě lze chlorid ceritý získat pozvolným, několikahodinovým, zahříváním heptahydrátu na 140 °C ve vakuu.[1][3][4] V něm se může nacházet malé množství CeOCl vzniklého hydrolýzou, ovšem je možné jej použít společně s organolithnými i Grignardovými činidly. Čistý bezvodý CeCl3 je možné připravit z hydrátu dehydratací pomalým zahříváním na 400 °C za přítomnosti 4- až 6násobného množství chloridu amonného ve vysokém vakuu[2][5][6][7] nebo zahříváním s přebytkem chloridem thionylu po 3 hodiny.[2][8]
Dalším způsobem přípravy bezvodého chloridu ceritého je reakce kovového ceru s kyselinou chlorovodíkovou.[9][10]
Přečištění se většinou provádí sublimací za vysoké teploty ve vysokém vakuu.
Použití
[editovat | editovat zdroj]Chlorid ceritý je možné použít jako výchozí látku na přípravu dalších ceritých solí, jako například trifluormethansulfonátu ceritého, Lewisovy kyseliny používané při Friedelových-Craftsových acylacích a jako katalyzátor při Friedelových-Craftsových alkylacích.[11]
V Lucheově redukci[12] α,β-nenasycených karbonylových sloučenin, často využívané v organické syntéze, se používá CeCl3·7H2O společně s tetrahydridoboritanem sodným; například z karvonu vzniká pouze allylový alkohol 1 a ne nasycený alkohol 2. Za nepřítomnosti CeCl3 vzniká směs obou těchto alkoholů.
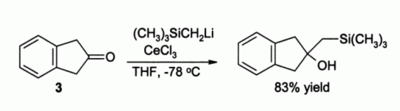
Další významné využití v organické syntéze nalézá chlorid ceritý při alkylaci ketonů, kde při použití organolithných sloučenin vznikají enoláty; například sloučenina 3 se za nepřítomnosti CeCl3 přemění na samotný enolát, zatímco je-li přítomen CeCl3, tak dojde k alkylaci:
Bylo zjištěno, že organolithné sloučeniny jsou při této reakci účinnější než Grignardova činidla.[3]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Cerium(III) chloride na anglické Wikipedii.
- ↑ a b PAQUETTE, L. A. Handbook of Reagents for Organic Synthesis: Reagents, Auxiliaries and Catalysts for C-C Bond Formation. Redakce Coates, R. M.. New York: Wiley, 1999. ISBN 0-471-97924-4.
- ↑ a b c EDELMANN, F. T.; POREMBA, P. Synthetic Methods of Organometallic and Inorganic Chemistry. Redakce Herrmann, W. A.. Stuttgart: Georg Thieme Verlag, 1997. ISBN 3-13-103021-6.
- ↑ a b JOHNSON, C. R.; TAIT, B. D. A cerium(III) modification of the Peterson reaction: methylenation of readily enolizable carbonyl compounds. Journal of Organic Chemistry. 1987, s. 281–283. ISSN 0022-3263. DOI 10.1021/jo00378a024.
- ↑ DIMITROV, Vladimir; KOSTOVA, KALINA; GENOV, MIROSLAV. Anhydrous cerium(III) chloride — Effect of the drying process on activity and efficiency. Tetrahedron Letters. 1996, s. 6787–6790. DOI 10.1016/S0040-4039(96)01479-7.
- ↑ TAYLOR, M. D.; CARTER, P. C. Preparation of anhydrous lanthanide halides, especially iodides. Journal of Inorganic and Nuclear Chemistry. 1962, s. 387–391. DOI 10.1016/0022-1902(62)80034-7.
- ↑ KUTSCHER, J.; SCHNEIDER, A. Notiz zur Präparation von wasserfreien Lanthaniden-Haloge-niden, Insbesondere von Jodiden. Inorg. Nucl. Chem. Lett.. 1971, s. 815. DOI 10.1016/0020-1650(71)80253-2.
- ↑ GREENWOOD, N. N.; EARNSHAW, A. Chemistry of the Elements. New York: Pergamon Press, 1984. ISBN 0-08-022056-8.
- ↑ FREEMAN, J. H.; SMITH, M. L. The preparation of anhydrous inorganic chlorides by dehydration with thionyl chloride. Journal of Inorganic and Nuclear Chemistry. 1958, s. 224–227. DOI 10.1016/0022-1902(58)80073-1.
- ↑ DRUDING, L. F.; CORBETT, J. D. Lower Oxidation States of the Lanthanides. Neodymium(II) Chloride and Iodide. Journal of the American Chemical Society. 1961, s. 2462–2467. ISSN 0002-7863. DOI 10.1021/ja01472a010.
- ↑ CORBETT, J. D. Rev. Chim. Minerale. 1973, s. 239.
- ↑ MINE, Norioki; FUJIWARA, YUZO; TANIGUCHI, HIROSHI. Trichlorolanthanoid (LnCl3)-catalyzed Friedel-Crafts alkylation reactions. Chemistry Letters. 1986, s. 357–360. DOI 10.1246/cl.1986.357.
- ↑ LUCHE, Jean-Louis; RODRIGUEZ-HAHN, LYDIA; CRABBÉ, PIERRE. Reduction of natural enones in the presence of cerium trichloride. Journal of the Chemical Society, Chemical Communications. 1978, s. 601–602. DOI 10.1039/C39780000601.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu chlorid ceritý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid ceritý na Wikimedia Commons