Sulfid draselný
| Sulfid draselný | |
|---|---|
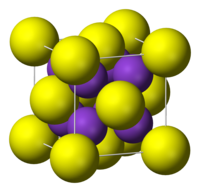 Struktura | |
| Obecné | |
| Systematický název | Sulfid draselný |
| Anglický název | Potassium sulfide |
| Německý název | Kaliumsulfid |
| Sumární vzorec | K2S |
| Vzhled | bílé krystaly (čistý) hnědožluté krystaly (technický) |
| Identifikace | |
| Registrační číslo CAS | 1312-73-8 |
| Vlastnosti | |
| Molární hmotnost | 110,262 g/mol |
| Teplota tání | 840 °C |
| Teplota varu | rozklad |
| Hustota | 1,805 g/cm3 (14 °C) |
| Rozpustnost ve vodě | rozklad na KOH a KHS |
| Rozpustnost v polárních rozpouštědlech | methanol ethanol glycerol |
| Relativní permitivita εr | 6,85 |
| Měrná magnetická susceptibilita | −4,55 Sm−1 |
| Struktura | |
| Krystalová struktura | krychlová |
| Hrana krystalové mřížky | a=735 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −380,7 kJ/mol |
| Standardní molární entropie S° | 104,6 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −364,0 kJ/mol |
| Bezpečnost | |
| R-věty | R17, R23, R25, R31, R34, R50 |
| S-věty | S24, S26 |
Některá data mohou pocházet z datové položky. | |
Sulfid draselný je draselná sůl kyseliny sirovodíkové. Síra má v této sloučenině oxidační číslo -II a draslík +I. Při reakci s vodou vzniká hydroxid draselný a hydrogensulfid draselný, což vytváří podobný zápach jako sulfan.
Výroba[editovat | editovat zdroj]
Existuje mnoho způsobů jak vytvořit sulfid draselný. Jedna z nich je reakce síranu draselného s uhlíkem, obvykle v podobě koksu. Reakce probíhá za tepla.
Lze je také připravit reakcí elementární síry s manganistanem draselným.
2 KMnO4 + S → K2S + 2 MnO2 + 2 O2
Reakce[editovat | editovat zdroj]
Při reakci s vodou hydrolyzuje za vzniku hydroxidu draselného a hydrogensulfidu draselného. Tato reakce je nevratná.
Velice podobně se chovají i dajší sulfidy alkalických kovů.
Sulfid draselný se společně se sulfidem sodným, sulfidem amonným a sulfanem používají pro analýzu iontů. Nejpraktičtější je však používat poměrně levný, sulfid sodný, jenž je v pevném skupenství, na rozdíl od sulfanu.
Pyrotechnika[editovat | editovat zdroj]
Sulfid draselný je meziproduktem při spalování černého střelného prachu. Jednoduchá, avšak používaná reakce pro spalování střelného prachu je:
2 KNO3 + S + 3 C → K2S + N2 + 3 CO2.
Reakce probíhá dále složitěji, avšak meziproduktem může být sulfid draselný.
Literatura[editovat | editovat zdroj]
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Sulfid draselný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Sulfid draselný na Wikimedia Commons

