Superoxid draselný
| Superoxid draselný | |
|---|---|
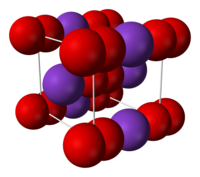 Model krystalové mřížky superoxidu draselného | |
| Obecné | |
| Systematický název | superoxid draselný |
| Ostatní názvy | hyperoxid draselný |
| Anglický název | Potassium superoxide, Potassium dioxide |
| Německý název | Kaliumhyperoxid, Kaliumsuperoxid |
| Sumární vzorec | KO2 |
| Vzhled | žlutá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 12030-88-5 |
| EC-no (EINECS/ELINCS/NLP) | 234-746-5 |
| UN kód | 2466 |
| Číslo RTECS | TT6053000 |
| Vlastnosti | |
| Molární hmotnost | 71,1 g/mol |
| Teplota tání | 490—530 °C (rozklad na K2O2 a O2 |
| Hustota | 2,158 g/cm3 |
| Rozpustnost ve vodě | reaguje za vzniku KOH a O2 |
| Struktura | |
| Krystalová struktura | tetragonální, I 4/mmm, |
| Hrana krystalové mřížky | a = 570 pm, c = 672 pm, Z = 4 |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −283 kJ/mol−1 |
| Standardní molární entropie S° | 117 JK−1mol−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R8 - R35 |
| S-věty | S17 - S26 S36/37/39 - S45 |
| NFPA 704 |  0
3
3
|
Některá data mohou pocházet z datové položky. | |
Superoxid draselný (KO2) je sloučenina draslíku a kyslíku. Je to jedna z mála existujících solí se superoxidovým aniontem O=O−. Další jsou: CsO2, RbO2 a nejméně stabilní NaO2. Superoxid draselný nelze pojmenovat jako „oxid drasličitý“, stejně jako ostatní superoxidy, protože draslík zde vystupuje jako jednomocný kation K+. Vyrábí se spalováním roztaveného draslíku v čistém kyslíku:
Používá se jako oxidační činidlo, jako pohlcovač oxidu uhličitého CO2 a vlhkosti, zároveň produkujícím kyslík v systémech obnovy vydýchaného vzduchu v uzavřeném koloběhu v kosmických lodích, ponorkách a podobně.
- 4 KO2 + 2 H2O → 4 KOH + 3 O2
- 2 KOH + CO2 → K2CO3 + H2O
- K2CO3 + CO2 + H2O → 2 KHCO3
- 4 KO2 + 2 CO2 → 2 K2CO3 + 3 O2
S větším množstvím vody reaguje až explozivně, také reaguje s ethanolem. Je nestabilní a při zahřívání ve vakuu odštěpuje kyslík:
Při rozkladu působením zředěných kyselin vzniká i peroxid vodíku a kyslík:
Při reakci s koncentrovanou kyselinou sírovou (H2SO4) se uvolňuje ozón:
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Potassium superoxide na anglické Wikipedii.
- ↑ a b Potassium superoxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Superoxid draselný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Superoxid draselný na Wikimedia Commons






