Chlorid joditý
Vzhled
| Chlorid joditý | |
|---|---|
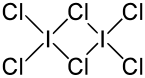 Struktura dimerního chloridu joditého | |
 Ampule s chloridem joditým | |
| Obecné | |
| Systematický název | Chlorid joditý |
| Anglický název | Iodine trichloride |
| Německý název | Iodtrichlorid |
| Sumární vzorec | I2Cl6 |
| Vzhled | žlutá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 865-44-1 |
| PubChem | 70076 |
| SMILES | ClI(Cl)Cl |
| InChI | InChI=1S/Cl3I/c1-4(2)3 |
| Vlastnosti | |
| Molární hmotnost | 466,5281 g/mol |
| Teplota tání | 63 °C |
| Hustota | 3,11 g·cm−3 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
Chlorid joditý je interhalogen, v pevném stavu vytváří dimerní molekuly I2Cl6. Dimer se skládá ze čtyř terminálních a dvou můstkových atomů chloru, strukturu lze popsat vzorcem Cl2I(µ-Cl)2ICl2.
Lze jej připravit reakcí jodu s nadbytkem kapalného chloru při teplotě −70 °C. V tavenině je vodivý, což lze vysvětlit existencí disociace:[2]
- I2Cl6 ↔ ICl +
2 + ICl -
4
Existence této rovnováhy byla potvrzena i strukturou některých solí, např. K[ICl2]·H2O nebo [ICl2][AlCl4].[2]
Je to silné chlorační[2] a oxidační činidlo, při kontaktu s organickým materiálem může vzplanout.
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Iodine trichloride na anglické Wikipedii.
- ↑ a b Iodine trichloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b c GREENWOOD, NORMAN NEILL. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. ISBN 8085427389, ISBN 9788085427387. OCLC 320245801 S. 1023.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu chlorid joditý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid joditý na Wikimedia Commons


