Hydrid draselný
| Hydrid draselný | |
|---|---|
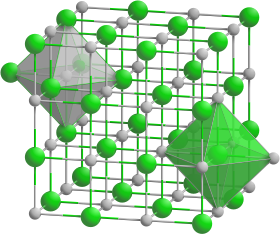 Model krystalové mřížky hydridu draselného __ K+ __ H− | |
| Obecné | |
| Systematický název | hydrid draselný |
| Anglický název | Potassium hydride |
| Německý název | Kaliumhydrid |
| Sumární vzorec | KH |
| Vzhled | bezbarvá až šedá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 7693-26-7 |
| EC-no (EINECS/ELINCS/NLP) | 231-704-8 |
| PubChem | 82127 |
| SMILES | [H-].[K+] |
| InChI | InChI=1S/K.H |
| Vlastnosti | |
| Molární hmotnost | 40,106 24 g/mol |
| Teplota tání | 400 °C (rozklad) |
| Hustota | 1,43 g/cm3[1] |
| Struktura | |
| Krystalová struktura | krychlová |
| Hrana krystalové mřížky | a=570 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −57,82 kJ/mol |
| Bezpečnost | |
| [2] Nebezpečí[2] | |
| H-věty | H260 H314 |
| R-věty | R14/15 - R34 |
| S-věty | (S7/8) S26 S36/37/39 S43 S45 |
Některá data mohou pocházet z datové položky. | |
Hydrid draselný je anorganická sloučenina vodíku a draslíku s empirickým vzorcem KH. Používá se především jako velmi silná zásada (silnější než hydrid sodný) v organické syntéze k deprotonaci (podobnosti a podrobnosti viz hydrid sodný. KH patří mezi solné (iontové) hydridy, je složen z iontů K+ a H−. S vodou reaguje, stejně jako ostatní iontové hydridy, bouřlivě:
Reakce je exotermní a natolik bouřlivá, že se vznikající vodík za přístupu kyslíku ze vzduchu uvolněným teplem často vznítí a hoří fialově karmínovým plamenem (zbarvení způsobeno přítomností draslíku). Ještě bouřlivěji reaguje s kyselinami a vzplane při reakci s kyslíkem, chlorem nebo fluorem. Je pyroforem a z toho důvodu vyžaduje velmi opatrné zacházení a je uchováván v/pod inertními látkami. Z toho důvodu se prodává jako suspenze (koncentrace asi 35 %) v minerálním oleji. V jedné studii byl rozptýlen v parafínu pro možnost snazšího zacházení.
Výroba
[editovat | editovat zdroj]Hydrid draselný může být připraven i přímou reakcí z kovového draslíku a vodíku:
- 2K + H2 → 2KH
Tuto reakci objevil Humphry Davy brzy po svém objevu draslíku v roce 1807.[3]
Použití
[editovat | editovat zdroj]Používá se k přípravě dalších „superbází“ RNHK (alkylamidy draselné) a ROK (alkoholáty draselné). Hydrid draselný je rozpustný v taveninách hydroxidů nebo směsí solí, ale je nerozpustný v organických rozpouštědlech (s některými z nich, například s alkoholy, reaguje).[1]
Sledujte také
[editovat | editovat zdroj]- Hydrid sodný (NaH)
- Hydrid lithný (LiH)
- Hydrid rubidný (RbH)
- Hydrid cesný (CsH)
- Hydrid vápenatý (CaH2)
- Amid draselný (KNH2)
- Imid draselný (K2NH)
- Nitrid draselný (K3N)
- Tetrahydridoboritan draselný (KBH4)
- Tetrahydridohlinitan draselný (KAlH4)
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Potassium hydride na anglické Wikipedii.
- ↑ a b (anglicky) Pradyot Patnaik (1 July 2007). A Comprehensive Guide to the Hazardous Properties of Chemical Substances. John Wiley and Sons. str. 631–. ISBN 978-0-470-13494-8. http://books.google.com/books?id=WdmWkkKF1UoC&pg=PA631.
- ↑ a b Potassium hydride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ (anglicky) Humphry Davy (1808), The Bakerian Lecture on some new phenomena of chemical changes produced by electricity, particularly the decomposition of fixed alkalies, and the exhibition of the new substances which constitute their bases; and on the general nature of alkaline bodies. Philosophical Transactions of the Royal Society, svazek 88, str. 1–44. In The Development of Chemistry, 1789–1914: Selected essays, edited by D. Knight, str. 17–47.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu hydrid draselný na Wikimedia Commons
Obrázky, zvuky či videa k tématu hydrid draselný na Wikimedia Commons


