Molybdenan sodný
| Molybdenan sodný | |
|---|---|
 Vzhled | |
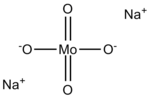 Strukturní vzorec | |
 Krystalická struktura dihydrátu | |
| Obecné | |
| Systematický název | molybdenan sodný |
| Ostatní názvy | molybdenan disodný |
| Anglický název | Sodium molybdate Disodium molybdate |
| Německý název | Natriummolybdat |
| Sumární vzorec | Na2MoO4 |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | (bezvodý)&Units=SI 7631-95-0 (bezvodý) 10102-40-6 (dihydrát) |
| EC-no (EINECS/ELINCS/NLP) | 231-551-7 |
| PubChem | 4384450 |
| Číslo RTECS | QA5075000 |
| Vlastnosti | |
| Molární hmotnost | 205,92 g/mol (bezvodý) 241,95 g/mol (dihydrát) |
| Teplota tání | 687 °C |
| Hustota | 3,780 g/cm3 |
| Index lomu | 1,714 |
| Rozpustnost ve vodě | 84 g/100 ml (100 °C) |
| Bezpečnost | |
| [1] Varování[1] | |
| NFPA 704 |  0
2
0
|
| Teplota vznícení | nehořlavý |
Některá data mohou pocházet z datové položky. | |
Molybdenan sodný (Na2MoO4) je sodná sůl kyseliny molybdenové. Často se vyskytuje jako dihydrát Na2MoO4·2H2O.
Příprava[editovat | editovat zdroj]
Molybdenan sodný se připravuje rozpouštěním oxidu molybdenového v roztoku hydroxidu sodného při 50–70 °C, krystalizací a filtrací,[2] bezvodá forma se připravuje zahřátím na 100 °C:
- MoO3 + 2 NaOH → Na2MoO4·2H2O
Použití[editovat | editovat zdroj]
Na2MoO4 se dá použít jako zdroj molybdenu.
V zemědělství se jej spotřebuje 450 tun ročně jako umělé hnojivo, například pro pěstování brokolice nebo květáku. Potravinářský průmysl ho používá pro výrobu některých potravinových doplňků.[3]
Dále se používá v průmyslu jako inhibitor koroze.[2]
Struktura[editovat | editovat zdroj]
Molybdenanový aniont má tetraedrickou strukturu, na každý aniont připadají dva kationty sodíku.[2]
Reakce[editovat | editovat zdroj]
Reakcí s tetrahydridoboritanem sodným se molybden redukuje na oxid s nižším oxidačním číslem[4]:
Molybdenan sodný také reaguje s dithiofosforečnanovými kyselinami[2]:
- Na2MoO4 + (RO)2PS2H (R = Me, Et) → [MoO2(S2P(OR)2)2]
které dále reagují za vzniku [MoO3(S2P(OR)2)4].
Bezpečnost[editovat | editovat zdroj]
Molybdenan sodný nesmí přijít do styku s alkalickými kovy, většinou běžných kovů a oxidačními činidly. Při dotyku s roztaveným hořčíkem exploduje, nebezpečně reaguje s interhalogeny (fluorid jodistý, fluorid bromičný atd.).[5]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Sodium molybdate na anglické Wikipedii.
- ↑ a b Sodium molybdate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ a b c d Braithwaite, E.R.; Haber, J. Molybdenum: An outline of its Chemistry and Uses. 1994. Elsevier Science B.V. Amsterdam, The Netherlands.
- ↑ Molybden z potravin tělu stačí. Nejsme v Íránu
- ↑ Chi Fo Tsang and Arumugam Manthiram. Journal of Materials Chemistry 1997. 7(6). 1003–1006.
- ↑ http://www.mallbaker.com/americas/msds/english/s4394_msds_us_default.pdf[nedostupný zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Molybdenan sodný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Molybdenan sodný na Wikimedia Commons - http://lpi.oregonstate.edu/infocenter/minerals/molybdenum/

