Thioly
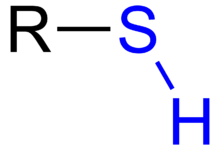
Thioly (též thioalkoholy nebo sirné alkoholy, starší název merkaptany) jsou organické sloučeniny síry formálně odvoditelné od alkoholů nahrazením jednoho či více alkoholových atomů kyslíku sírou. V molekule tedy obsahují sulfanylovou skupinu –SH. V pevném skupenství se zpravidla jedná o bílé, ve vodě téměř nerozpustné, krystalické látky. Nižší alifatické thioly se vyskytují za normálních podmínek v kapalném skupenství, methanthiol je plyn.[1] Thioly podléhají podobným reakcím jako alkoholy, jsou to velmi silně zapáchající látky, například methanthiol je možné detekovat lidským čichem již při koncentraci 1 μg/dm3 vzduchu. Soli thiolů se nazývají thioláty. Thioalkoholy mohou být alifatického i aromatického charakteru (pak se také nazývají thiofenoly).
Názvosloví[editovat | editovat zdroj]
Názvy thiolů se tvoří pomocí substitučního názvosloví, vychází z názvosloví alkoholů. Názvem thiolů bývá jen jedno slovo, jehož kořenem je základní uhlovodík, prefixy jsou názvy lokantů a násobící předpony, sufixem je –thiol; podobně jako u alkoholů, u nichž se používá sufixu -ol. Ve starší literatuře se můžeme setkat se starší předponou merkapto-, místo přípony -thio. Je-li dnes nutno použít předponu, je volena novější varianta sulfanyl-.
-
Benzenthiol
-
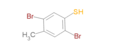
2,5-dibrom-4-methylbenzen-1-thiol
-
Butan-1,4-dithiol
-
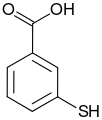
3-sulfanylbenzoová kyselina
Vazba S-H[editovat | editovat zdroj]
Vazba S-H tvoří v thiolech analog k alkoholové vazbě O-H. Většinu vlastností mají S-H a O-H podobné. Z nižší elektronegativity síry 2,44 (elektronegativita O2 je 3,5), a z větších rozměrů atomů síry však vyplývají určité odlišnosti. Předně vazba S-H je slabší než O-H. Ze stejných důvodů je i vodíková vazba v thiolech mnohem slabší než v alkoholech. Proto mají thioly nižší bod varu než jejich alkoholové analogy.
| Thiol | Bod varu °C | Alkohol | Bod varu °C |
|---|---|---|---|
| [1]Methanthiol CH3SH | 6 | Methanol | 65 |
| [2]Ethanthiol C2H5SH | 35 | Ethanol | 78 |
| [3]Benzenthiol | 168 | Fenol | 182 |
Slabá vazba mezi sírou a vodíkem rovněž způsobuje, že thioly jsou mnohem kyselejší než alkoholy. Díky vyšší kyselosti je možné připravit soli thiolů-alkoholáty, na rozdíl od solí alkoholů reakcí thiolu s vodným roztokem bazického hydroxidu.
- CH3CH2-SH + NaOH → CH3CH2-S− Na+ + H2O
Příprava[editovat | editovat zdroj]
Thioly se obvykle připravují SN2-reakcí (substituce nukleofilní binukleární) odpovídajících halogenalkanů se sirnými nukleofily, například s hydrogensulfidovým aniontem HS-. Vedlejším produktem reakce je sůl halogenalkanu.
- R-Br + Na+ −SH → R-SH + NaBr
Hydrogensulfid musí být použit ve stechiometrickém přebytku, jinak dochází k následné nežádoucí reakci (jedná se rovněž o SN2-reakci) s halogenalkanem na symetrický sulfid.
- R-SH + R-Br → R-S-R
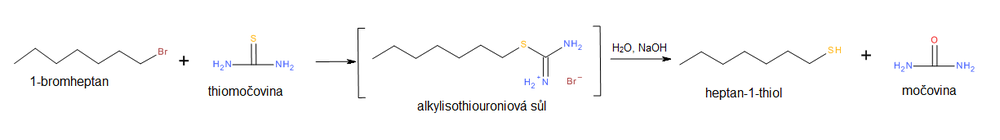
Další možností jak předejít nežádoucímu vzniku sulfanu je použití thiomočoviny jako nukleofilu. Při reakci dochází k substituci halogenidového iontu thiomočovinou přes intermediální sůl alkylisothiomočoviny, která je následně hydrolyzována vodným roztokem alkalického hydroxidu, např. NaOH(aq).
Thioly lze rovněž připravovat redukcí disulfidů zinkem v kyselém prostředí. K redukci lze také použít alkalické kovy v kapalném amoniaku, nebo tetrahydroboritan sodný NaBH4.
- R-S-S-R + HX− → 2R-SH
Thioly je rovněž možno připravit reakcí Grignardova činidla sírou na thiolát a následnou reakcí s kyselinou chlorovodíkovou.
- R-Li + S → R-SLi
- R-SLi + HCl → R-SH + LiCl
Výroba[editovat | editovat zdroj]
V průmyslu se thioly nejčastěji vyrábějí reakcí odpovídajícího alkoholu se sulfanem H2S v kyselém prostředí. Dále se thioly vyrábějí adicí sulfanu na alkeny za přítomnosti katalyzátoru oxidu hlinitého.
- CH3OH + H2S → CH3SH + H2O
Reakce[editovat | editovat zdroj]
Thioly se poměrně snadno oxidují, již při použití slabých oxidovadel jako je třeba brom nebo jod. Produktem oxidace jsou disulfidy.
- 2R-SH + I2 → R-S-S-R + 2HI
Thioly lze oxidovat rovněž peroxidem vodíku, který při reakci působí jako oxidovadlo a sám se redukuje. Produktem této reakce je sulfonová kyselina a voda.
- R-SH + 3H2O2 → RSO3H + 3H2O
Reakcí thiolu s bází, například s hydridem sodným vzniká thiolátový ion (RS-), který může následně reagovat s primárním nebo sekundárním alkylahalogenidem za vzniku organosulfidů. Reakce probíhá SN2 mechanismem. Thiolátové anionty patří mezi nejsilnější nukleofily a výtěžky jejich reakcí jsou velmi vysoké.
Thioly se též velice ochotně slučují s těžkými kovy, zejména se rtutí za vzniku organometalických sloučenin merkaptidů. Podobně thioly reagují s olovem a mědí.
- CH3CH2-SH + HgO → (CH3CH2S)2Hg + H2O
Výskyt[editovat | editovat zdroj]

Thioly způsobují charakteristický pach mléka, mléčných výrobků, česneku (prop-2-en-1-thiol čili „allylmerkaptan“; mimo jiných látek, např. allyl(methyl)sulfid neboli 3-(methylsulfanyl)prop-1-en) a cibule (propan-1-thiol). 3-methylbutan-1-thiol se vyskytuje v žlázovém sekretu produkovaném šelmami z čeledi skunkovitých, kteří je používají jako chemickou zbraň. Methanthiol vzniká v zažívacím traktu savců rozkladem proteinů při trávení.
V neživé přírodě se thioly vyskytují v ropě, uhlí a kondenzátu zemního plynu. Zemní plyn těžený v Kataru a Íránu obsahuje až 3 000 ppm thiolů. V energetice způsobují thioly problémy svou přítomností ve skládkovém plynu a bioplynu. Thioly způsobují u nesprávně skladovaných vín charakteristický zápach, který má za následek jejich znehodnocení.
Využití[editovat | editovat zdroj]
Zemní plyn, hojně používaný v domácnostech a průmyslu jako palivo, je bez barvy a bez zápachu, na druhou stranu se však jedná o látku, která tvoří při smíšení se vzduchem výbušnou směs. Pro snadnější možnost detekce unikajícího plynu, zhaslé karmy, neuzavřeného hořáku atd. se do zemního plynu před distribucí k odběrateli přidávají thioly, tento proces se nazývá odorizace, k odorizaci se používá především ethanthiol.
Thioly se oxidací převádějí na disulfidy, které tvoří sulfidové, disulfidové a polysulfidové můstky. Tyto můstky spojují polymerní řetězce syntetického kaučuku při jeho vulkanizaci. Ochota thiolů reagovat s těžkými kovy, a vázat je na sebe se používá v lékařství, při léčení otravy rtutí, kadmiem a olovem. 2,3-disulfanylpropanol se rovněž používá jako radioprotektivní látka, tj. látka snižující následky radioaktivního záření na organismus.
Odstraňování thiolů z paliv[editovat | editovat zdroj]
Thioly v ropě a ropných derivátech[editovat | editovat zdroj]
Thioly, jak už bylo řečeno, jsou velice zapáchající a korozivní látky. Jejich korozivnost vede k destrukci potrubí při dopravě ropy a ropných derivátů. Ničí vnitřky motorů a vyžaduje vyšší nároky na povrchovou úpravu nádrží, v nichž jsou ropa a její deriváty uchovávány. Co se týče obsahu thiolů v ropě, obecně platí, že čím je ropa mladší, tím je v ní větší obsah thiolů. Jedná se o pozůstatek rozkladu živočichů při vzniku ropy. Aby se těmto nežádoucím vlivům předešlo, musí se thioly odstraňovat. Jednou z možností je hydrogenační rafinace, při níž se za zvýšené teploty a tlaku míchá s vodíkem, následkem čehož vzniká sulfan, který se následně vypírá v amoniakální vypírce. Hydrogenační metoda je poměrně drahá a používá se u těžkých thiolů, zvláště při odstraňování thiolů z benzinu a petroleje. Společně s thioly se odstraňují i další sirné sloučeniny.
Levnější metodou je slazení thiolů.[4] Slazení spočívá v extrakci thiolů v roztocích louhů a převádění na disulfidy, které nejsou zapáchající a korozivní, a mohou se v palivech nadále ponechat. Slazení probíhá při mírně zvýšeném[5] tlaku 0,3-0,8 MPa a mírně zvýšené [5]teplotě 40-60 °C. Slazení se používá hlavně když nejsou přítomny ostatní, nežádoucí sirné sloučeniny jako např. sulfidy, disulfidy a thiofeny. Slazení z důvodu vysokého obsahu thiolů způsobujících zápach a korozi se postupně snižuje, z důvodu legislativních omezení využívání ropy s vysokým obsahem síry. Thioly se však z ropných produktů odstraňují i v koncentracích, kdy již nezpůsobují korozivnost, a to v případech, kdy se zvyšuje oktanové číslo benzínů izomerací, k níž se používá platinových katalyzátorů, na něž působí thioly jako jed.
- R-S + NaOH → R-SNa + H2O
Thioly v energetických plynech[editovat | editovat zdroj]

Thioly se společně s dalšími sirnými sloučeninami vyskytují v skládkovém plynu a bioplynu, v menší míře pak v zemním plynu. Thioly v těchto energetických plynech obsažené vznikly rozkladem tlejícího masa, živočichů, z fekálií a z dalších složek živočišného původu použitých při získávání bioplynu ve fermentorech, popř. na skládkách. Thioly působí korozivně na zařízení kogenerace, spalovací motory a potrubí v němž jsou dopravovány. Nejčastější metodou jejich odstranění je sorbce na vrstvě aktivního uhlí,a to jak absorpce, tak adsorbce. Jelikož je žádoucí, aby sorbent byl v anaerobním prostředí, je impregnován jódem. Jinak by nedocházelo k žádoucí oxidaci (kvůli absenci kyslíku v anaerobním prostředí). Impregnaci je možné provádět i sloučeninami šestimocného chromu a manganistanem draselným.
| Složka | Koncentrace mg/m3 |
|---|---|
| [6]Sulfan | 50-3000 |
| [6]Methanthiol | 0,1 – 30 |
| [6]Ethanthiol | 0 – 20 |
| [6]Sirouhlík | 0,5 – 20 |
| [6]Diethylsulfid | 0,02 – 40 |
Význam v biologii[editovat | editovat zdroj]
Thioly se snadno oxidují na disulfidy a naopak, tato vzájemná přeměna je velice důležitá pro vznik disulfidových můstků, které stabilizují terciární struktury bílkovin a dalších biopolymerů. Vazba -SH je charakteristická pro aminokyselinu cystein.
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
- ↑ a b http://www.chemspider.com/Chemical-Structure.855.html
- ↑ http://www.chemspider.com/Chemical-Structure.6103.html
- ↑ http://www.chemspider.com/Chemical-Structure.7681.html
- ↑ Blažek V. Rábl J., Základy zpracování a využití ropy, VŠCHT Praha, 2. vydání, 2006, str. 120
- ↑ a b Archivovaná kopie. www.petroleum.cz [online]. [cit. 2011-03-31]. Dostupné v archivu pořízeném dne 2015-09-24.
- ↑ a b c d e http://paliva.vscht.cz/data/clanky/14_odstranovani_sulfanu_z_bioplynu.pdf
Literatura[editovat | editovat zdroj]
- Klouda P.:Základy biochemie, Ostrava, 2005
- Kolář K., Kodíček M., Pospíšil J., Chemie II pro gymnázia (organická a biochemie), SPN, 2005
- McMurry J., Organická chemie, VŠCHT Praha, 1.vydání, 2007
- Svoboda J. a kol, VŠCHT Praha, 1. vydání, 2005
- Blažek V. Rábl J., Základy zpracování a využití ropy, VŠCHT Praha, 2. vydání, 2006
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu thiol na Wikimedia Commons
Obrázky, zvuky či videa k tématu thiol na Wikimedia Commons - Shrnutí informací o thiolech[nedostupný zdroj]
- Metoda extrakce thiolů louhem Archivováno 24. 9. 2015 na Wayback Machine.
- Srovnání reaktivnosti s alkoholy, ethery a thioethery – vysokoškolský učební text