RNA: Porovnání verzí
→Metody práce s RNA: výměna obrázku, zahození jednoho, který se sem nehodil |
→Funkce: sobecká RNA |
||
| Řádek 122: | Řádek 122: | ||
Kromě tvorby tělísek, v jejichž skládání RNA hraje důležitou roli, pomáhají molekuly RNA organizovat vyšší úroveň organizace genomu a tím i regulovat funkci genů. Významná je dlouhá nekódující RNA nazvaná [[XIST]] vyvolávající u samic savců [[inaktivace X-chromozomu|inaktivaci chromozomu X]] tím, že obalí jeden ze dvou chromozomů X a zastaví čtení jeho genetické informace; jako jedna z mála přepisovaných oblastí zůstává okolí gen XIST. |
Kromě tvorby tělísek, v jejichž skládání RNA hraje důležitou roli, pomáhají molekuly RNA organizovat vyšší úroveň organizace genomu a tím i regulovat funkci genů. Významná je dlouhá nekódující RNA nazvaná [[XIST]] vyvolávající u samic savců [[inaktivace X-chromozomu|inaktivaci chromozomu X]] tím, že obalí jeden ze dvou chromozomů X a zastaví čtení jeho genetické informace; jako jedna z mála přepisovaných oblastí zůstává okolí gen XIST. |
||
=== Sobecká RNA === |
|||
Některé molekuly RNA je možné vnímat jako molekulární parazity. Jsou totiž přítomny v organismu hostitele, někdy jsou dokonce kódovány jeho vlastním genomem, a často se množí na jeho úkor. Jedná se o [[RNA virus|RNA viry]] a [[retrovirus|retroviry]], [[retrotranspozon]]y a [[sebevystřihující introny]]. V organismu často zabírají významnou část hostitelského genomu, u člověka zabírá [[nekódující DNA]] vniklá činností těchto elementů téměř polovinu jeho genomu.<ref name="genom">{{Citace periodika | příjmení = International Human Genome Sequencing Consortium | titul = Initial sequencing and analysis of the human genome | periodikum = Nature | ročník = 409 | číslo = 6822 | datum = 2001-02-15 | strany = 860–921 | doi = 10.1038/35057062}}</ref> |
|||
[[RNA virus|RNA viry]] v užším slova smyslu jsou zástupci [[vir]]ů, kterým RNA slouží jako nositelka genetické informace (viry způsobující [[Orthomyxoviridae|chřipku]], [[Klíšťová encefalitida|klíšťovou encefalitidu]], [[Koronavirus SARS|SARS]],...). [[Retrovirus|Retroviry]] (např. [[HIV]]) mají ve svém genomu RNA, ale využívají [[reverzní transkripce|zpětný přepis RNA→DNA]], jsou schopny svůj genom vložit do genomu hostitele a u člověka tvoří jejich pozůstatky 5-8 % genomu.<ref name="genom"/> Retroviry mohou ztratit schopnost se šířit mezi hostiteli a stát se [[endogenní retrovirus|endogenními retroviry]]. Lidské endogenní retroviry jsou téměř neaktivní, jsou pravděpodobně schopny se šířit pouze mezi pohlavními buňkami hostitele.<ref name="Belshaw-2004">{{Citace periodika | příjmení = Belshaw | jméno = R. | příjmení2 = Pereira | jméno2 = V. | příjmení3 = Katzourakis | jméno3 = A. | spoluautoři = et al. | titul = Long-term reinfection of the human genome by endogenous retroviruses. | periodikum = Proc Natl Acad Sci U S A | ročník = 101 | číslo = 14 | strany = 4894-9 | měsíc = Apr | rok = 2004 | doi = 10.1073/pnas.0307800101 | pmid = 15044706 }}</ref> Zajímavý případ lidského endogenního retroviru je [[HERV-W]] kódující protein [[syncytin]]; tento protein původně sloužil viru pro vstup do buněk, lidský organismus jej ale převzal a využívá jej pro fúzování buněk ([[trofoblast]]ů) v placentě.<ref name="Dupressoir-2012">{{Citace periodika | příjmení = Dupressoir | jméno = A. | příjmení2 = Lavialle | jméno2 = C. | příjmení3 = Heidmann | jméno3 = T. | titul = From ancestral infectious retroviruses to bona fide cellular genes: role of the captured syncytins in placentation. | periodikum = Placenta | ročník = 33 | číslo = 9 | strany = 663-71 | měsíc = Sep | rok = 2012 | doi = 10.1016/j.placenta.2012.05.005 | pmid = 22695103 }}</ref> Ještě jednodušší než endogenní retroviry jsou [[retrotranspozon]]y, což jsou úseky DNA schopné se přepsat do RNA a pak [[reverzní transkripce|zpětně přepsat]] do DNA; jejich činností vzniklo asi 42 % lidského genomu.<ref name="genom"/> |
|||
Geny kódující proteiny často obsahují [[intron]]y, nekódující oblasti, které musí být v průběhu zrání [[mRNA]] [[splicing|vystřihnuty]]. V některých případech je vystřihnutí katalyzováno samotným intronem, jedná se tedy o [[sebevystřihující introny]]. Ty velmi často kódují proteiny, které jim umožňuje šířit se genomem hostitele. Podle mechanismu sestřihu se rozlišují na typ I, který následně pro své množení zneužívá mechanismus [[oprava DNA|opravy DNA]] tak, že "opraví" úsek hostitelské DNA podle své sekvence; typ II se většinou šíří [[reverzní transkripce|zpětným přepisem RNA→DNA]].<ref name="Edgell-2011">{{Citace periodika | příjmení = Edgell | jméno = DR. | příjmení2 = Chalamcharla | jméno2 = VR. | příjmení3 = Belfort | jméno3 = M. | titul = Learning to live together: mutualism between self-splicing introns and their hosts. | periodikum = BMC Biol | ročník = 9 | číslo = | strany = 22 | měsíc = | rok = 2011 | doi = 10.1186/1741-7007-9-22 | pmid = 21481283 }}</ref> Díky tomu, že jsou schopny se z [[mRNA]] vystřihnout, tak většinou významně nepoškozují hostitele. Je zajímavé, že mechanismus vyštěpování sebevystřihujících intronů typu II je velmi podobný eukaryotnímu [[spliceozomu]] a je pravděpodobné, že eukaryotní buňky získaly své introny tak, že sebevystřihující introny typu II se rozšířily z předchůdce [[mitochondrie]] do buňky eukaryot.<ref>{{Citace periodika | příjmení = Rogozin | jméno = IB. | příjmení2 = Carmel | jméno2 = L. | příjmení3 = Csuros | jméno3 = M. | spoluautoři = et al. | titul = Origin and evolution of spliceosomal introns. | periodikum = Biol Direct | ročník = 7 | číslo = | strany = 11 | měsíc = | rok = 2012 | doi = 10.1186/1745-6150-7-11 | pmid = 22507701}}</ref> |
|||
=== Další funkce === |
=== Další funkce === |
||
[[Soubor:Aptamer biotin.png|200px|thumb|right|Struktura RNA [[aptamer]]u (žlutě), který je schopen specificky vázat [[vitamín H|biotin]]. Podle [[PDB]]ID:1F27.]] |
[[Soubor:Aptamer biotin.png|200px|thumb|right|Struktura RNA [[aptamer]]u (žlutě), který je schopen specificky vázat [[vitamín H|biotin]]. Podle [[PDB]]ID:1F27.]] |
||
* Parazitické RNA elementy |
|||
** [[RNA viry]] |
|||
*** [[Viroidy]] a [[virusoid]]y – infekční molekuly RNA napadající rostliny. Nekódují žádný protein, replikace virusoidů je navíc závislá na přítomnosti viroidu |
|||
** [[Retrotranspozon]]y |
|||
* [[IRES]] – vnitřní vazebné místo pro [[ribozom]] |
* [[IRES]] – vnitřní vazebné místo pro [[ribozom]] |
||
Vazba malých molekul: |
|||
* [[Riboswitch]] |
* [[Riboswitch]] |
||
** Například lyzinový [[riboswitch]] nacházející se v řadě bakteriálních mRNA regulujících metabolismus lyzinu. Vazba lyzinu do struktury tvořící riboswitch reguluje [[translace|překlad]] molekuly mRNA.<ref>{{Citace periodika | příjmení = Serganov | jméno = Alexander | titul = Structural insights into amino acid binding and gene control by a lysine riboswitch | periodikum = Nature | ročník = 455 | číslo = 7217 | datum = 2008 | strany = 1263–1267 | doi = 10.1038/nature07326 | spoluautoři=Huang, Lili; Patel, Dinshaw J.}}</ref> <!-- Text původního obrázku; bude potřeba zapracovat do textu. --> |
** Například lyzinový [[riboswitch]] nacházející se v řadě bakteriálních mRNA regulujících metabolismus lyzinu. Vazba lyzinu do struktury tvořící riboswitch reguluje [[translace|překlad]] molekuly mRNA.<ref>{{Citace periodika | příjmení = Serganov | jméno = Alexander | titul = Structural insights into amino acid binding and gene control by a lysine riboswitch | periodikum = Nature | ročník = 455 | číslo = 7217 | datum = 2008 | strany = 1263–1267 | doi = 10.1038/nature07326 | spoluautoři=Huang, Lili; Patel, Dinshaw J.}}</ref> <!-- Text původního obrázku; bude potřeba zapracovat do textu. --> |
||
Verze z 1. 3. 2014, 18:33

Ribonukleová kyselina (RNA, česky dříve RNK) je nukleová kyselina tvořená vláknem nukleotidů, jež obsahují cukr ribózu. Je zodpovědná za přenos informace z úrovně nukleových kyselin do proteinů a u některých virů je dokonce samotnou nositelkou genetické informace. Je velmi podobná deoxyribonukleové kyselině (DNA), od které se liší jednak přítomností ribózy, kterou má ve své cukr-fosfátové kostře namísto deoxyribózy, a také tím, že využívá nukleovou bázi uracil namísto thyminu. Díky větší reaktivitě ribózy může molekula RNA zaujímat větší množství uspořádání a zastávat mnohem více funkcí, než mnohem stabilnější DNA, která je využívaná buňkou především jako úložiště genetické informace. Molekula RNA je také na rozdíl od DNA obvykle jednovláknová, často ovšem zaujímá složitější strukturu díky vnitřnímu párování, a v některých případech, například u řady virů, se vyskytuje i dvouvláknová RNA.
RNA má v těle řadu funkcí, z nichž hlavní je zajištění překladu genetického kódu, tedy převod informace z DNA do struktury proteinů. Oblast DNA nesoucí gen je nejprve procesem transkripce přepsána do tzv. mediátorové RNA. Ta je následně tzv. translatována do proteinů tvořených řetězcem aminokyselin. Zařazení správné aminokyseliny při tvorbě proteinů zajišťuje vazba transferové RNA na specifický kodon v mRNA pomocí párování jejich bází. Samotný překlad genetického kódu probíhá na ribozomu, který je složený z RNA (tzv. rRNA) i proteinů, přičemž RNA v ribozomu tvoří nejen strukturní složku, ale je zodpovědná i za syntézu peptidové vazby v nově vznikajícím proteinu. Ribozom je tedy významným zástupcem skupiny RNA s katalytickou aktivitou, tzv. ribozymů.
Kromě už zmíněných funkcí v překladu genetického kódu, strukturní a katalytické funkce hraje RNA roli v řadě dalších buněčných pochodů, jako je úprava RNA, jemná kontrola translace pomocí RNA interference, funguje jako templát pro syntézu telomer, atd. Podle hypotézy RNA světa mohla být RNA pro svou všestrannost, schopnost nést i replikovat genetickou informaci a syntetizovat podle ní proteiny první nukleovou kyselinou využívanou živými organismy.
Stavba

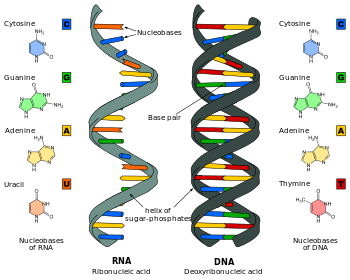
Chemická struktura
Ribonukleová kyselina je biopolymer tvořený ribonukleotidy, což jsou látky složené z nukleové báze (adenin (A), guanin (G), cytosin (C) nebo uracil (U), pětiuhlíkatého monosacharidu ribózy a jednoho zbytku kyseliny fosforečné. Samotná nukleová báze napojená na ribózu se nazývá ribonukleosid, až jeho fosforylovaná forma nacházející se v RNA je ribonukleotid. V kostře RNA se střídá ribóza s fosfátovou skupinou, které jsou vzájemně kovalentně propojené fosfodiesterovou vazbou. Na ribózu jsou v pozici 1' připojeny glykosidickou vazbou nukleové báze, které jsou vlastní jednotky dědičnosti, a právě pomocí nich je v RNA zapsána informace. První tři báze jsou totožné s těmi, které se nacházejí v DNA, ale thymin přítomný v DNA je nahrazen uracilem, který se od thyminu liší nepřítomností methylové skupiny.
Dalším významným rozdílem je to, že ribóza nesená v RNA má oproti deoxyribóze tvořící DNA na pozici 2' hydroxylovou (OH) skupinu. RNA je kvůli volné 2' OH skupině výrazně reaktivnější a flexibilnější, ale také nestabilnější a v zásaditém prostředí dochází k hydrolýze fosfodiesterové vazby blízkou -OH skupinou, což vyvolává rozštěpení kostry RNA.[1] Kromě toho je RNA citlivější k degradaci řadou enzymů. Reaktivita RNA jí ovšem umožňuje v mnohých případech působit jako katalyzátor chemických reakcí - takovým molekulám RNA se říká ribozymy.[2]
V porovnání s DNA, která vytváří v drtivé většině případů tzv. dvoušroubovici (složenou ze dvou komplementárních vláken), vytváří RNA často kratší jednoduchá vlákna, která jsou obvykle jednovláknová. Vyskytuje se i dvouvláknová RNA, která zaujímá dvoušroubovici, pro níž je typické prostorové uspořádání A-formy. RNA je ovšem díky své flexibilitě schopna vytvářet bohaté sekundární a terciární struktury, jejichž variabilita je v porovnání s DNA výrazně bohatší. (Sekundární a terciární struktura se vyskytuje i v proteinech.)
Modifikace RNA v buňkách

Do RNA jsou při translaci vneseny pouze čtyři základní báze, následnou modifikací báze nebo ribózy ale vzniká celá řada dalších ribonukleotidů, což rozšiřuje variabilitu molekul RNA. V současné době je známo více než 100 modifikovaných ribonukleotidů, přičemž nejvíce různých modifikací se dá nalézt v molekule tRNA.[3] Mezi nejčastější příklady nestandardních ribonukleotidů patří:
- Dihydrouridin (D) vznikající redukcí báze uracilu přidáním dvou molekul vodíku. Báze obsažená v dihydrouridinu není na rozdíl od běžných bází planární (v rovině) a ruší patrové interakce (stacking), takže destabilizuje strukturu RNA.
- Pseudouridin (Ψ) lišící se od uridinu pozicí připojení báze k ribóze, v případě uridinu je to uhlík na pozici 1', u pseudouridinu 5' uhlík (viz obrázek). Pseudouridin stabilizuje strukturu RNA zesilováním patrových interakcí a svým potenciálem tvořit další vodíkový můstek, případně vázat další molekulu vody pomocí dusíku N1. Pseudouridin se vyskytuje v řadě RNA, významný je především pro tRNA, u které je podle jeho výskytu nazváno TΨC rameno. Při modifikaci rRNA v jadérku je uridin určený k modifikaci rozpoznán malou jadérkovou RNA třídy H/ACA box, která se přesně váže v bezprostřední blízkosti nukleotidu určeného k modifikaci, ale samotný uridin vystavuje k úpravě enzymem pseudouridin syntázou.[4]
- Inosin (I), ve kterém je molekula hypoxantinu připojená na ribózu jako neobvyklá báze. Inosin v tRNA umožňuje i nestandardní, tzv. kolísavé párování bází. Inosin v RNA vzniká při procesu editace RNA deaminací adenosinu.[5]
- 5-methylcytidin (m5C) obsahuje namísto báze cytosinu 5-methylcytosin. V případě tRNA tato modifikace stabilizuje strukturu a ovlivňuje funkčnost a stabilitu tRNA, a v rRNA zvyšuje přesnost translace. Zatímco v případě DNA je tato modifikace dobře prozkoumaný epigenetický znak, v případě RNA není biologická funkce této modifikace dobře prozkoumaná, i když je relativně běžná, a to především v nekódujících RNA a nekódujících oblastech mRNA.[6]
- Ribothymidin, tedy thymin vázaný na ribózu, se v RNA vyskytuje například v takzvaném TΨC rameni tRNA nebo v tmRNA,[7] v případě RNA se tento nukleosid kvůli jednoznačnosti nazývá ribothymidin nebo 5-methyluridin a ne thymidin.
- 7-Methylguanosin (m7G) je nukleosid tvořící neobvyklou strukturu 5' čepičky, která chrání 5' konec eukaryotních mRNA. Kromě toho je 7-methylguanosin navázaný na první nukleotid mRNA řetězce neobvyklou 5′ — 5′ trifosfátovou vazbou a okolní nukleotidy jsou často methylovány, což způsobuje, že tuto strukturu nejsou schopny rozpoznat exonukleázy štěpící RNA.
Kromě modifikací báze často dochází i k modifikaci ribózy, především k její 2'-O-metylaci, která je esenciální pro funkci ribozomu a spliceosomu.[8]
Strukturní motivy v RNA

Funkce RNA není určena pouze pořadím jejích bází, ale podobně jako u proteinů i její strukturou. RNA dokáže pomocí párování bází a patrových interakcí v rámci svého řetězce vytvářet stejné druhy struktury jako DNA, díky flexibilitě kolem své glykosidické vazby a schopnosti vytvářet další vodíkový můstek ale může zaujímat i mnohem složitější uspořádání. Složitější typy struktur se vytvářejí jak pomocí párování bází mezi jednotlivými částmi molekuly, tak i využíváním dalších interakcí, například patrových interakcí mezi ribonukleotidy v různých částech molekuly (tzv. koaxiální skládání) nebo využívání kovových iontů pro stabilizaci řetězce. RNA je také schopná, v mnohem větším rozsahu než DNA, využívat také nestandardní typy párování bází, jako je hoogsteenovské párování nebo kolísavé párování bází.[2] Kromě uspořádaných oblastí mají v RNA význam i oblasti bez stabilní struktury, podobně jako u neuspořádaných oblastí proteinů. Neuspořádané oblasti jsou často místem vazby RNA-vazebných proteinů nebo jiných RNA (například při vazbě mezi tRNA a mRNA) a jsou často cílovým místem RNA interference.[9]
Mezi nejčastější typy prostorového uspořádání RNA patří:
- dvoušroubovice, v případě RNA ovšem pouze tzv. A-formy, která je ve srovnání s B-formou širší, má více plochý tvar, hlubší velký žlábek a méně hluboký malý žlábek.
- vlásenka
- vyboulená smyčka vznikající ve dvoušroubovici při lokálním nedokonalém párování
- pseudouzel vytvářející několik interakcí v rámci jedné molekuly a kissing loops (tj. "líbající se smyčky") vzniklé mezi různými molekulami
- trojšroubovice, ve které se do klasické dvoušroubovice připojí další vlákno, nejčastěji do malého žlábku
- G-kvadruplex, podobně jako v případě DNA
- složitější struktury vzniklé koaxiálním skládáním, při kterém dochází k patrovým interakcím mezi bázemi tvořícími různé helixy, jako je tomu v případě tRNA a rRNA
- Hlavní typy struktur v RNA
-
Krátká dvouvláknová RNA s vyznačenou šířkou 32 angströmů
-
Příklad vlásenky
-
Schematické zobrazení pseudouzlu
-
Způsob vzniku pseudouzlu
-
Reálný příklad pseudouzlu, dvě různá zobrazení
-
Schématické znázornění struktury kissing loops
Funkce
Ribonukleové kyseliny plní v buňkách mnoho možných úloh. Mohou například nést informaci o stavbě proteinů, jako je tomu v případě mRNA. Většina RNA přítomná v buňce (kolem 98 %[10]) je ovšem tzv. nekódující RNA a má jiné funkce. RNA může také, podobně jako bílkovinné enzymy, plnit katalytickou (často autokatalytickou) funkci, taková enzymaticky fungující RNA se nazývá ribozym. Pro RNA viry slouží RNA, ať už jednovláknová nebo dvouvláknová, pro uložení vlastní genetické informace.
Čtení genetického kódu

Informace potřebné pro tvorbu proteinů živými organismy jsou v buňkách uloženy na DNA ve formě genů, které kódují molekulu mRNA sloužící jako prostředník. Proces překladu mRNA do proteinů probíhá podle souboru pravidel nazývaných genetický kód, která jsou z velké části zajišťována právě molekulami RNA:
Mediátorová RNA (mRNA z angl. messenger RNA) je přepisována podle sekvence DNA (u eukaryot je pak exportována do cytoplazmy) a využita pro překlad do proteinů. mRNA je nejdříve přepisována jako prekurzor (hnRNA), který často obsahuje nekódující oblasti, introny. Zralá mRNA stále obsahuje nepřekládané oblasti s regulačními funkcemi a je často ukončena čepičkou a poly(A) koncem, které dále určující její osud v buňce. Samotná kódující oblast obsahuje nepřekrývající se kodóny tvořené trojicí nukleotidů, podle kterých je připojena příslušná aminokyselina, a start kodon a stop kodon určující začátek a konec transkripce. Aktivně překládaná mRNA je u eukaryot pomocí proteinů rozpoznávajících poly(A) konec a čepičku spojena do pseudokružnice, což umožňuje ribozomům po ukončení translace a jejich odpadnutí rychle znovu nalézt začátek transkripce, takovou mRNA navíc často překládá více ribozomů najednou, což vytváří útvar nazvaný polyzom.
tRNA (transferová RNA) připojuje specifickou aminokyselinu do rostoucího polypeptidového řetězce při translaci. Slouží tedy jako adaptér pro specifickou nabitou aminokyselinu a umožňuje tak překlad informace z úrovně RNA do úrovně proteinů, přičemž samotné rozpoznání probíhá podle párování kodon-antikodon. V molekule tRNA je průměrně 17 % bází modifikováno,[11] což mimo jiné umožňuje kolísavé párování bází, tedy i jiné než klasické Watson-crickovské párování. Jedna tRNA je proto schopna rozpoznávat více různých kodónů patřících jedné aminokyselině, což je příčinou degenerovanosti genetického kódu.
rRNA (ribozomální RNA) je nejčastější molekulou RNA v buňce, u bakterií může tvořit kolem 95-98 % celkové RNA.[12] rRNA je významná jednak svou stavební funkcí v ribozomu, který je tvořen z velké části právě rRNA, jednak tím, že rRNA je zodpovědná za katalytickou aktivitu ribozomu.[13] Důvodů, proč má v ribozomu katalytickou aktivitu RNA a ne protein, může být několik, Podle evolučního vysvětlení (tzv. hypotézy RNA světa) byly první proteiny syntetizovány výhradně RNA (bez pomoci proteinů, které se připojily až později) a rRNA už nebyla nikdy nahrazena. Biochemicky se tento fenomén dá vysvětlit tak, že RNA snadno mění konformaci a umožňuje tak nezbytný pohyb ribozomu; navíc právě RNA je nejvhodnější pro specifické rozpoznání dalších RNA, řídících syntézu RNA (mRNA a tRNA) pomocí párování bází a dalších interakcí.[13]
Kromě těchto RNA pro proteosyntézu nezbytných se vyskytují další RNA, které ji přímo regulují:
- Transferová-mediátorová RNA (tmRNA), která se vyskytuje u řady bakterií a v plastidech.[14] Slouží k záchraně ribozomu, který nerozpoznal terminační kodon a nemůže ukončit transkripci. tmRNA se nejdříve naváže jako tRNA a následně je přeložena jako mRNA. tmRNA kóduje krátký polypeptid sloužící jako značka pro degradaci vznikajícího proteinu, zajišťuje degradaci poškozené mRNA a uvolňuje ribozom.[15]
- 7SL RNA tvoří strukturní část signál rozpoznávající částice, která je zodpovědná za kotranslační translokaci syntetizovaných proteinů, které mají být sekretovány mimo buňku. Spekuluje se, že kromě strukturní role je právě 7SL RNA zodpovědná za zastavení proteosyntézy během přesunu ribozomu k endoplazmatickému retikulu.[16]
Regulace genové exprese


Kromě toho, že RNA zajišťuje čtení genetického kódu, je také schopná tento proces i dále regulovat. U eukaryot je nejvýznamnějším mechanismem takzvaná RNA interference, při které je rozštěpena dvouvláknová molekula RNA a jedno z jejích vláken je vneseno do komplexu RISC. Pokud se v buňce vyskytne molekula RNA plně komplementární s vláknem RNA neseném v komplexu RISC, je tato molekula rozštěpena komplexem RISC, pokud je ale druhé vlákno komplementární pouze částečně, mRNA není degradována, ale je zabráněno její translaci.
RNA interferenci řídí dva hlavní typy RNA:
- siRNA (short interfering RNA) vznikající z dvouvláknové RNA především vnějšího původu (například dsRNA viry). Protože se v tomto případě v komplexu RISC nachází vlákno RNA přesně komplementární k druhému z vláken cizorodé RNA, dochází k přesnému rozpoznání jiných kopií této cizorodé RNA, která je následně komplexem RISC rozštěpena.
- miRNA (microRNA) je naopak kódována buňkou, ať už samostatnými geny pro miRNA, oblastmi uvnitř intronů genů kódujících protein nebo geny pro jinou nekódující RNA. miRNA reguluje genovou expresi tak, že zabraňuje translaci těch mRNA, se kterými nedokonale páruje (příklad viz obrázek). Tento mechanismus se nazývá RNA silencing. Podle bioinformatických analýz se zdá, že až 60 % lidských genů může být regulováno pomocí miRNA[17] a probíhá intenzivní výzkum propojení miRNA a různých nemocí, například rakoviny.[18]
Kromě zmíněných dvou hlavních skupin se rozlišují i další typy RNA řídících RNA interferenci, jako jsou rozšířené, ale zatím málo prozkoumané piRNA a siRNA pocházející z repetitivních sekvencí (rasiRNA). Pro výzkumné nebo léčebné účely se často používá umělá shRNA (small hairpin RNA), což jsou krátké molekuly RNA tvořící vlásenku, která je rozeznána a dále zpracována aparátem RNA interference stejně jako prekurzory siRNA nebo miRNA.[19] I když je RNA interference známá pouze z eukaryot, řada bakterií a archeí má pro obranu proti bakteriofágům a dalším parazitickým DNA elementům vyvinut funkční analog RNA interference zvaný CRISPR systém.[20]
Katalytická funkce

Katalytickou funkci mají v živých organismech především proteinové enzymy, roste ale množství známých molekul RNA, které mají také katalytickou aktivitu, tzv. ribozymy. Nejvýznamnějším zástupcem ribozymů je ribozom katalyzující peptidyltransferázovou reakci při vzniku proteinů.[13] Nejčastější reakcí, kterou ribozymy katalyzují, je ovšem štěpení cukr-fosfátové kostry ve vlastní molekule. Zajímavým příkladem ribozymů jsou uměle připravené peptidyltransferázy schopné katalyzovat tvorbu vazby mezi aminokyselinami[22] a umělé ribozymy schopné replikovat jiné molekuly RNA,[23] což slouží jako podpora hypotézy RNA světa, podle které byla pro živé organismy první nositelka genetické informace právě RNA.
Významné příklady ribozymů jsou:
- sebevystřihující introny, což jsou introny (nekódující oblasti) vyskytující se v mRNA, tRNA nebo rRNA schopné vyštěpit sebe sama i bez pomoci proteinů. I když jsou to z pohledu finální mRNA "nepřekládané oblasti", často kódují enzymy, které zajišťují jejich zpětnou integraci do genomu, a jedná se tedy o parazitické RNA elementy.
- RNáza P zodpovědná za zrání tRNA.
- hammerhead ribozymy štěpící u řady viroidů a virusoidů lineární molekulu RNA nesoucí několik násobků jejich genomu, což vzniká při jejich replikaci metodou valivé kružnice. Tento ribozym štěpí uvnitř své vlastní sekvence a de facto není katalyzátor, protože se v průběhu reakce spotřebuje. Existují ovšem i hammerhead ribozymy štěpící jiné molekuly RNA, v tomto případě se o katalyzátory jedná. Tento ribozym se vyskytuje u všech skupin pozemského života, u vyšších organismů je jejich funkce ovšem neznámá.[24]
Řízení modifikace RNA

Význam RNA pro buňku ilustruje také schopnost RNA modifikovat nebo řídit modifikaci jiných molekul RNA během jejich zrání. V rámci RNA zodpovědných za modifikace RNA je možno vyčlenit několik hlavních tříd nekódujících RNA:
- snRNA (small nuclear RNA, "malá jaderná RNA") je skupina RNA vyskytující se v jádře eukaryotních buněk, která se podílí na sestřihu v průběhu zrání prekurzorů mRNA. snRNA vytváří ribonukleoproteinové komplexy zvané spliceosom složené ze šesti různých molekul snRNA a 60 — 150 různých proteinů. snRNA v katalytickém místě spliceozomu je velmi podobná sebevystřihujícím intronům typu II a předpokládá se, že právě z nich spliceosom vznikl, v současnosti ale není jasné, jestli se jedná o ribozym, nebo má katalytickou aktivitu některý z proteinů.[25]
- snoRNA (small nucleolar RNA, "malá jadérková RNA") vyskytující se v jadérku (často se proto uvádí jako podtyp snRNA) řídí methylaci a pseudouridynylaci rRNA. Do takzvané H/ACA box rodiny snoRNA patří i RNA komponenta lidské telomerázy, která slouží jako templát pro syntézu DNA v oblasti telomer procesem reverzní transkripce.[26]
- RNáza P je ribozym nezbytný pro jeden z kroků maturace tRNA. Vyskytuje se v podobě ribonukleoproteinu u bakterií, archeí i eukaryot, u všech skupin organismů je ale RNA katalyzátorem štěpení.[27]
- gRNA (guide RNA) slouží k editaci RNA, což je proces posttranskripční modifikace mRNA, která probíhá v kinetoplastech bičivek (k zástupcům patří například trypanozomy). Při editaci podle gRNA dochází k přidání nebo odstranění uracilů z molekuly mRNA.
Tvorba jaderných struktur

Prakticky žádná RNA se v buňce nenachází volně, ale vyskytuje se v komplexu s proteiny, tedy jako ribonukleoproteiny. Proteiny vázající se na RNA mají řadu funkcí, ať už ochranu před degradací, slouží jako adaptér pro jaderný export nebo naopak udržení v jádře, případně pro skládání do složitějších ribonukleoproteinových komplexů.[28] Proteinů vázajících RNA je celá řada, RNA-recognition motif (motiv rozeznávající RNA) je dokonce jeden z nejčastějších strukturních motivů v lidských proteinech.[29] Kromě toho, že ribonukleoproteiny jsou často velmi složité samy o sobě (například ribozom), tak se u eukaryotních organismů tyto komplexy dále shlukují do vyšších útvarů (jako je například jadérko). Předpokládá se, že vznik těchto složitějších struktur souvisí s nezbytností fyzicky oddělit a tím zeefektivnit různé probíhající pochody u složitějších eukaryotních buněk[30] (podobně, jako je tomu u systému vnitřních váčků, které jsou ale odděleny membránami).
Kromě cytoplasmatických polyzomů a RNA granulí se celá řada buněčných struktur tvořených z podstatné části z RNA nachází v buněčném jádře. Ve všech případech se jedná o útvary bez vlastní membrány, což umožňuje snadnou výměnu molekul s prostředím. Je běžné, že se jednotlivé komponenty vyskytují v malé koncentraci v celém jádře a vytvářejí jaderná tělíska až tehdy, pokud buňka vyžaduje jejich větší aktivitu, v takovém případě jejich skládání řídí dlouhé nekódující RNA (lncRNA).[31][32]
Jadérko je místo, kde dochází k přepisu genů pro rRNA a skládání ribozomů. Jadérka se nachází u všech buněk, které se zrovna nedělí. Vyskytuje se jich v jádře většinou několik, vytváří se kolem organizátoru jadérka, což je úsek DNA na některých chromozomech, které nesou řadu kopií genů pro rRNA oddělených "nekódující" sekvencí. Tato "nekódující" sekvence dává vzniknout dlouhé nekódující RNA (lncRNA), která je zodpovědná za negativní zpětnou vazbu - její vlásenka je rozpoznána komplexem vytvářejícím heterochromatin a sama vytváří trojitý helix s oblastní promotoru a následně přivádí do blízkosti genů pro rRNA enzymy methylující DNA, v obou případech vzniká epigenetická značka pro ukončení transkripce.[31]
Cajalova tělíska jsou malá tělíska vyskytující se poblíž jadérka, a to především v buňkách, které intenzivně přepisují svou genetickou informaci (například rychle se dělící buňky). Kromě proteinů obsahují také malé jaderné RNA (snRNA) a malé jadérkové RNA (snoRNA), které se zde skládají do podoby ribonukleoproteinů a modifikují se, za což jsou zodpovědné RNA specifické pro Cajalova tělíska (scaRNA), které modifikace řídí. Kromě toho zde dochází ke skládání a zrání telomerázy, která je zodpovědná za prodlužování telomer; její RNA komponenta je příbuzná malým jadérkovým RNA.[31]
jaderné skvrny (speckles) slouží jako místo modifikace a uskladnění sestřihových faktorů, a to včetně malých jaderných ribonukleoproteinů, ze kterých se skládá funkční spliceosom. Vytváří se v okolí intenzivně přepisovaných genů a slouží jako centrum modifikace mRNA a řízení jejího exportu z jádra. Obsahují dlouhou nekódující RNA NEAT2, která ovšem není nezbytná pro jejich skládání, její funkce je pravděpodobně regulace aktivity proteinů zodpovědných za splicing.[32]
paraspeckles se vyskytují v bezprostřední blízkosti jaderných skvrn. Jejich strukturní součást je dlouhá nekódující RNA NEAT1, která na sebe váže proteiny zodpovědné za vyvazování mRNA, které jsou bohatě modifikované RNA editací adenosin -> inositol. Intenzivní editace A -> I probíhá v 3' nepřekládané oblasti některých mRNA kódující stresové proteiny. Ve stresových podmínkách se odštípne modifikovaná oblast, na 3' konci se doplní poly(A) konec a zachycené mRNA je umožněno opustit jádro.[32]
polycomb body je nahloučení proteinů komplexu polycomb, který je zodpovědný za epigenetické umlčení řady genů methylací histonů a provází inaktivaci chromozomu X. Asi pětina všech dlouhých nekódujích RNA interaguje s tímto komplexem a předpokládá se, že jsou nějakým způsobem zodpovědné za výběr genu, jehož přepis má být umlčený. [32]
Kromě tvorby tělísek, v jejichž skládání RNA hraje důležitou roli, pomáhají molekuly RNA organizovat vyšší úroveň organizace genomu a tím i regulovat funkci genů. Významná je dlouhá nekódující RNA nazvaná XIST vyvolávající u samic savců inaktivaci chromozomu X tím, že obalí jeden ze dvou chromozomů X a zastaví čtení jeho genetické informace; jako jedna z mála přepisovaných oblastí zůstává okolí gen XIST.
Sobecká RNA
Některé molekuly RNA je možné vnímat jako molekulární parazity. Jsou totiž přítomny v organismu hostitele, někdy jsou dokonce kódovány jeho vlastním genomem, a často se množí na jeho úkor. Jedná se o RNA viry a retroviry, retrotranspozony a sebevystřihující introny. V organismu často zabírají významnou část hostitelského genomu, u člověka zabírá nekódující DNA vniklá činností těchto elementů téměř polovinu jeho genomu.[33]
RNA viry v užším slova smyslu jsou zástupci virů, kterým RNA slouží jako nositelka genetické informace (viry způsobující chřipku, klíšťovou encefalitidu, SARS,...). Retroviry (např. HIV) mají ve svém genomu RNA, ale využívají zpětný přepis RNA→DNA, jsou schopny svůj genom vložit do genomu hostitele a u člověka tvoří jejich pozůstatky 5-8 % genomu.[33] Retroviry mohou ztratit schopnost se šířit mezi hostiteli a stát se endogenními retroviry. Lidské endogenní retroviry jsou téměř neaktivní, jsou pravděpodobně schopny se šířit pouze mezi pohlavními buňkami hostitele.[34] Zajímavý případ lidského endogenního retroviru je HERV-W kódující protein syncytin; tento protein původně sloužil viru pro vstup do buněk, lidský organismus jej ale převzal a využívá jej pro fúzování buněk (trofoblastů) v placentě.[35] Ještě jednodušší než endogenní retroviry jsou retrotranspozony, což jsou úseky DNA schopné se přepsat do RNA a pak zpětně přepsat do DNA; jejich činností vzniklo asi 42 % lidského genomu.[33]
Geny kódující proteiny často obsahují introny, nekódující oblasti, které musí být v průběhu zrání mRNA vystřihnuty. V některých případech je vystřihnutí katalyzováno samotným intronem, jedná se tedy o sebevystřihující introny. Ty velmi často kódují proteiny, které jim umožňuje šířit se genomem hostitele. Podle mechanismu sestřihu se rozlišují na typ I, který následně pro své množení zneužívá mechanismus opravy DNA tak, že "opraví" úsek hostitelské DNA podle své sekvence; typ II se většinou šíří zpětným přepisem RNA→DNA.[36] Díky tomu, že jsou schopny se z mRNA vystřihnout, tak většinou významně nepoškozují hostitele. Je zajímavé, že mechanismus vyštěpování sebevystřihujících intronů typu II je velmi podobný eukaryotnímu spliceozomu a je pravděpodobné, že eukaryotní buňky získaly své introny tak, že sebevystřihující introny typu II se rozšířily z předchůdce mitochondrie do buňky eukaryot.[37]
Další funkce

- IRES – vnitřní vazebné místo pro ribozom
- Riboswitch
- Například lyzinový riboswitch nacházející se v řadě bakteriálních mRNA regulujících metabolismus lyzinu. Vazba lyzinu do struktury tvořící riboswitch reguluje překlad molekuly mRNA.[38]
- Aptamery
Osudy RNA v buňce
Syntéza RNA a reverzní transkripce

RNA je syntetizovaná enzymy RNA polymerázami (RNA-poly, RNAP) podle matrice DNA, případně RNA (například u virů). RNA polymerázy s pomocí transkripčních faktorů rozpoznávají specifické úseky DNA (tzv. promotor), které označují počátek transkripce (přepis DNA na RNA). Zatímco v případě prokaryot a semiautonomních organel eukaryot jsou veškeré RNA syntetizovány jedinou RNA-polymerázou, u eukaryot se nachází více typů: RNA polymeráza I syntetizující rRNA, RNA polymeráza II syntetizující prekurzor mRNA a většinu snRNA a miRNA a RNA polymeráza III syntetizující tRNA a 5S rRNA. Kromě těchto tří polymeráz společných pro eukaryota jsou ještě známé RNA polymeráza IV a V, které syntetizují siRNA. RNA může být syntetizována i podle RNA templátu pomocí RNA dependentních RNA polymeráz, které jsou schopny replikovat viry, jejichž genom je tvořen právě RNA.
Po své syntéze je RNA často posttranskripčně modifikována. Dochází například k úpravě pre-mRNA na 5' a 3' konci, na které se přidává 5' čepička a 3' poly (A) konec.
Protože DNA polymeráza není schopna započít syntézu nového vlákna, speciální RNA dependentní RNA polymeráza zvaná primáza nasyntetizuje krátký úsek RNA komplementární s DNA (takzvaný primer), na který může DNA polymeráza navázat. RNA je následně z DNA odstraněna a nahrazena DNA.
RNA hraje také roli v případě syntézy DNA v procesu nazývaném reverzní transkripce, ve kterém slouží jako templát. Eukaryotní buňky využívají reverzní transkripci pro vytvoření svých telomer, což repetitivní oblasti chránící koncové oblasti chromozomů. Reverzní transkripci využívají také retroviry, které přepisují svůj genom kódovaný v RNA do DNA, která slouží pro integraci do hostitelského genomu; virový genom je následně vytvořen procesem transkripce.
Úpravy RNA a její lokalizace
Posttranskripční úpravy mRNA a nekódujících RNA syntetizovaných RNA polymerázou II jsou často úzce spjaty s její syntézou a v mnoha případech probíhají už v průběhu syntézy, jedná se vlastně o úpravy ko-transkripční. Hlavní úpravy jsou přidání 5'čepičky, polyadenylace a sestřih. Spřažení transkripce a úprav RNA zajišťuje fosforylace C-terminální domény RNA polymerázy II, která se liší během neaktivního stavu, začátku transkripce (signál pro připojení čepičky), v průběhu elongační fáze transkripce (vyhledávání míst sestřihu) a konce transkripce (rozštěpení rostoucí mRNA a signál pro polyadenylaci). mRNA, které chybí některá z potřebných modifikací nebo která stále obsahuje nevyštěpené introny, je degradována jadernými RNázami, ostatní mohou být exportovány na cílové místo, kde vykonávají svou funkci. Za samotný export jsou zodpovědné proteiny, které tvoří ribonukleoproteinové komplexy s přenášenou mRNA.[39]
RNA se v buňce často nenachází náhodně, ale často je směřována do místa, kde má vykovávat funkci, případně tam, kde se má nalézat protein, který je kódován mRNA. Tento jev je nejlépe pozorovatelný u velkých a složitých buněk, jako jsou vajíčka, raná embrya nebo neurony, ale je společný pro všechny typy buněk.[40]
Uskladnění a kontrola mRNA v RNA granulích
mRNA, která není buňkou překládána, je často uložena v podobě RNA granulí. Ty se v cytoplasmě eukaryotních buněk často vyskytují jako dobře rozlišitelná granula tvořená RNA a proteiny. RNA granule regulují translaci, stabilitu a určují lokalizaci mRNA, která je v nich obsažená. Kromě mRNA typicky obsahují ribozomální podjednotky, translační faktory, enzymy zodpovědné za degradaci RNA, helikázy, strukturní proteiny a další RNA-vazebné proteiny.[41] Mezi nejdůležitější patří:
Granule v zárodečných buňkách (germ cell granules), ve kterých se vyskytují především v průběhu jejich vývoje a následně zůstávají v oocytech. Nesou vybrané molekuly mRNA kódující proteiny nezbytné pro vývoj embrya, které jsou uloženy v neaktivním stavu do doby, než budou potřeba. Kromě toho také nesou aparát RNA interference, především z rodiny piRNA, které inaktivují transpozony a brání tak genom před poškozením.[41][42]
Stresová tělíska vznikají při vystavení buněk stresu a soustřeďují v sobě mRNA kódující běžné buněčné proteiny. Nesou ribozomy bezprostředně připravené překládat nesenou mRNA, které jsou ale po dobu trvání stresu uskladněné v neaktivní stavu tak, aby nedošlo k jejich poškození. Často fyzicky interagují s P-tělísky a předávají jim RNA určenou k degradaci.[43]
P-tělíska (processing bodies) se vyskytují v somatických buňkách, kde se účastní degradace mRNA a zprostředkovávají RNA silencing pomocí miRNA. Díky schopnosti degradovat RNA slouží také ke kontrole kvality buněčných mRNA.[41]
Neuronální granule slouží neuronům pro transport mRNA k jejich axonům. Nesou ribozomy a faktory pro zahájení translace, ale té je zabráněno, dokud tyto granule nejsou dopraveny na správné místo. Neuronální granule hrají významnou roli v regeneraci neuronů a poruchy v transportu mRNA jsou spojeny s neuronálními poruchami.[44]
Degradace RNA

Degradace RNA pomocí enzymů ribonukleáz (RNáz) slouží buňce jako regulační a kontrolní mechanismus pro odstranění RNA, která je poškozená, nebo nadále není potřeba, ale také pro maturaci RNA a jako obrana proti RNA virům. Je také základem složitějších obranných strategií, jako je RNA interference. Obecně proces degradace probíhá buď od konců RNA pomocí exonukleáz (které štěpí od 5' nebo 3' konce) RNA) nebo pomocí endonukleáz štěpících uvnitř vlákna. V buňkách existuje celá řada RNáz s překrývajícími se aktivitami a každá RNA, která není chráněna proti jejich účinkům, je degradována.
V případě bakterií navazuje transkripce DNA bezprostředně na translaci a poločas života mRNA je mezi vteřinou až hodinou. 5' konec RNA je u bakterií chráněn trifosfátovou skupinou na prvním nukleotidu a signálem pro degradaci je odštěpení dvou fosfátových zbytků a polyadenylace RNA[45] V buňkách eukaryot je poločas života mRNA delší, a to minuty až dny. Stabilita je zajištěna jednak úpravou konců — přidáním 5' čepičky a 3' polyadenylací, jednak vazbou ribonukleoproteinů bránících přístupu RNáz.
Hlavním komplexem zajišťujícím degradaci je u eukaryotní exosom a u bakterií podobný, ale jednodušší, degradosom.[46] Obsahují typicky exo- i endonukleázy a RNázy štěpící krátké fragmenty RNA, vzniklé činností endonukleáz, na nukleotidy. Degradaci napomáhají helikázy zodpovědné za rozplétání sekundárních struktur na RNA. Bakteriální degradosom navíc obsahuje poly(A) polymerázu a eukaryotické exosomy proteiny zodpovědné za rozpoznání destabilizujících oblastí v RNA, například ARE elementu.
Metody práce s RNA


Pro práci s RNA je nutné ji nejdříve izolovat z buněk či virových partikulí. Způsoby izolace jsou prakticky identické jako v případě izolace DNA, tedy rozbití buněk, rozrušení membrány a denaturace proteinů pomocí detergentů. Na rozdíl od izolace DNA, při které je možné inaktivovat DNázy pomocí jednoduchého vyvázání dvouvazebných iontů, RNázy musí být drženy neaktivní chlazením nebo velmi účinnými denaturačními činidly, jako je guanidium chlorid. Jedna z nejpoužívanějších metod je právě izolace celkové RNA z buněk pomocí fenol-chloroformové extrakce za přítomnosti guanidium chloridu.[47] RNázy tvoří značný problém pro izolace RNA, protože RNázy jsou schopny vydržet vaření i autoklávování díky své schopnosti refoldingu.
Po izolaci celkové RNA představuje až 98 % vzorku rRNA, což komplikuje analýzu méně zastoupených RNA. Nejvýznamnější metodou nabohacení vybraného podtypu RNA je izolace eukaryotní mRNA pomocí oligo(dT) kotvy, která specificky hybridizuje s poly(A) koncem mRNA, což ji umožňuje snadno izolovat a následně pomocí reverzní transkripce přepsat do komplementární DNA (cDNA). Ostatní typy RNA je možné izolovat například pomocí afinitní chromatografie, ultracentrifugací, nebo imunoprecipitací komplexu ribonukleoproteinu. Kromě toho je možné naopak vyvázat nebo specificky degradovat nežádoucí rRNA.[12]
Analýza RNA probíhá s použitím velmi podobných nebo stejných metod, jako v případě DNA. Ve většině případů analýza obsahuje krok přepsání z RNA do DNA pomocí reverzní transkripce. Důvodů je řada, například vyšší stabilita RNA a dále skutečnost, že enzymy pracující s DNA jsou efektivnější a méně chybují.
Analýza RNA:
- Kvantifikace podle množství: spektroskopická analýza při 260 nm podle Lambertova-Beerova zákona
- Elektroforéza, nejčastěji agarózová elektroforéza v přítomnosti denaturačních činidel, které rozrušují sekundární strukturu
- Ultracentrifugace
- Fluorescenční hybridizace in situ
- Northern blot
- Přímá sekvenace (relativně vzácně, většinou pouze velmi krátké molekuly)
Analýza RNA s využitím kroku přepsání do DNA pomocí reverzní transkripce a vytvoření komplementární DNA (cDNA):
- Kvantitativní RT-PCR určující absolutní počet kopií zkoumané RNA ve vzorku
- Analýza genové exprese podle krátkých úseků cDNA, tzv. expressed sequence tag
- Sériová analýza genové exprese
- Sekvenace získané cDNA
Odkazy
Reference
![]() Obrázky, zvuky či videa k tématu RNA na Wikimedia Commons
Obrázky, zvuky či videa k tématu RNA na Wikimedia Commons
- ↑ MIKKOLA, Satu, Stenman, Eeva; Nurmi, Kirsi; Yousefi-Salakdeh, Esmail; Strömberg, Roger; Lönnberg, Harri. The mechanism of the metal ion promoted cleavage of RNA phosphodiester bonds involves a general acid catalysis by the metal aquo ion on the departure of the leaving group. Journal of the Chemical Society, Perkin Transactions 2. 1999-01-01, čís. 8, s. 1619–1626. DOI 10.1039/a903691a.
- ↑ a b ZADRAŽIL, Stanislav. Ribonukleové kyseliny. Věčné „druhé“ mezi nukleovými kyselinami. Živa. 2007, čís. 3, s. 98. Dostupné online [cit. 2013-08-14].
- ↑ CANTARA, W. A., Crain, P. F.; Rozenski, J.; McCloskey, J. A.; Harris, K. A.; Zhang, X.; Vendeix, F. A. P.; Fabris, D.; Agris, P. F. The RNA modification database, RNAMDB: 2011 update. Nucleic Acids Research. 2010-11-10, roč. 39, čís. Database, s. D195–D201. DOI 10.1093/nar/gkq1028.
- ↑ CHARETTE, M.; GRAY, MW. Pseudouridine in RNA: what, where, how, and why.. IUBMB Life. May 2000, roč. 49, čís. 5, s. 341-51. DOI 10.1080/152165400410182. PMID 10902565.
- ↑ ZINSHTEYN, Boris, Nishikura, Kazuko. Adenosine-to-inosine RNA editing. Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 2009-09-01, roč. 1, čís. 2, s. 202–209. DOI 10.1002/wsbm.10.
- ↑ SQUIRES, JE.; PATEL, HR.; NOUSCH, M., et al. Widespread occurrence of 5-methylcytosine in human coding and non-coding RNA.. Nucleic Acids Res. Jun 2012, roč. 40, čís. 11, s. 5023-33. DOI 10.1093/nar/gks144. PMID 22344696.
- ↑ FELDEN, B.; HANAWA, K.; ATKINS, JF., et al. Presence and location of modified nucleotides in Escherichia coli tmRNA: structural mimicry with tRNA acceptor branches.. EMBO J. Jun 1998, roč. 17, čís. 11, s. 3188-96. DOI 10.1093/emboj/17.11.3188. PMID 9606200.
- ↑ KISS, T. NEW EMBO MEMBER'S REVIEW: Small nucleolar RNA-guided post-transcriptional modification of cellular RNAs. The EMBO Journal. 2001, roč. 20, čís. 14, s. 3617–3622. DOI 10.1093/emboj/20.14.3617.
- ↑ HALL, Kathleen B. RNA in motion. Current Opinion in Chemical Biology. 2008-12-01, roč. 12, čís. 6, s. 612–618. DOI 10.1016/j.cbpa.2008.09.033.
- ↑ MATTICK, J. S. Non-coding RNAs: the architects of eukaryotic complexity. EMBO Reports. 2001, roč. 2, čís. 11, s. 986–991. DOI 10.1093/embo-reports/kve230.
- ↑ JACKMAN, Jane E., Alfonzo, Juan D. Transfer RNA modifications: nature's combinatorial chemistry playground. Wiley Interdisciplinary Reviews: RNA. 2013-01-01, roč. 4, čís. 1, s. 35–48. DOI 10.1002/wrna.1144.
- ↑ a b PEANO, Clelia, Pietrelli, Alessandro; Consolandi, Clarissa; Rossi, Elio; Petiti, Luca; Tagliabue, Letizia; De Bellis, Gianluca; Landini, Paolo. An efficient rRNA removal method for RNA sequencing in GC-rich bacteria. Microbial Informatics and Experimentation. 2013-01-01, roč. 3, čís. 1, s. 1. DOI 10.1186/2042-5783-3-1.
- ↑ a b c CECH, TR. Structural biology. The ribosome is a ribozyme.. Science. Aug 2000, roč. 289, čís. 5481, s. 878-9. PMID 10960319.
- ↑ GUENEAU DE NOVOA, P.; WILLIAMS, KP. The tmRNA website: reductive evolution of tmRNA in plastids and other endosymbionts.. Nucleic Acids Res. Jan 2004, roč. 32, čís. Database issue, s. D104-8. DOI 10.1093/nar/gkh102. PMID 14681369.
- ↑ KEILER, KC. Biology of trans-translation.. Annu Rev Microbiol. 2008, roč. 62, s. 133-51. DOI 10.1146/annurev.micro.62.081307.162948. PMID 18557701.
- ↑ NAGAI, K. NEW EMBO MEMBER'S REVIEW: Structure, function and evolution of the signal recognition particle. The EMBO Journal. 2003-07-15, roč. 22, čís. 14, s. 3479–3485. DOI 10.1093/emboj/cdg337.
- ↑ FRIEDMAN, R. C., Farh, K. K.-H.; Burge, C. B.; Bartel, D. P. Most mammalian mRNAs are conserved targets of microRNAs. Genome Research. 2008-10-29, roč. 19, čís. 1, s. 92–105. DOI 10.1101/gr.082701.108.
- ↑ LI, Chunsheng, Feng, Yi; Coukos, George; Zhang, Lin. Therapeutic MicroRNA Strategies in Human Cancer. The AAPS Journal. 2009-10-29, roč. 11, čís. 4, s. 747–757. DOI 10.1208/s12248-009-9145-9.
- ↑ PADDISON, P. J. Short hairpin RNAs (shRNAs) induce sequence-specific silencing in mammalian cells. Genes & Development. 2002, roč. 16, čís. 8, s. 948–958. DOI 10.1101/gad.981002.
- ↑ HORVATH, P.; BARRANGOU, R. CRISPR/Cas, the immune system of bacteria and archaea.. Science. Jan 2010, roč. 327, čís. 5962, s. 167-70. DOI 10.1126/science.1179555. PMID 20056882.
- ↑ TOOR, N., Keating, K. S.; Fedorova, O.; Rajashankar, K.; Wang, J.; Pyle, A. M. Tertiary architecture of the Oceanobacillus iheyensis group II intron. RNA. 2009-12-01, roč. 16, čís. 1, s. 57–69. DOI 10.1261/rna.1844010.
- ↑ ZHANG, B.; CECH, TR. Peptide bond formation by in vitro selected ribozymes.. Nature. Nov 1997, roč. 390, čís. 6655, s. 96-100. DOI 10.1038/36375. PMID 9363898.
- ↑ WOCHNER, A., Attwater, J.; Coulson, A.; Holliger, P. Ribozyme-Catalyzed Transcription of an Active Ribozyme. Science. 2011-04-07, roč. 332, čís. 6026, s. 209–212. DOI 10.1126/science.1200752.
- ↑ HAMMANN, C., Luptak, A.; Perreault, J.; de la Pena, M. The ubiquitous hammerhead ribozyme. RNA. 2012-03-27, roč. 18, čís. 5, s. 871–885. DOI 10.1261/rna.031401.111.
- ↑ VALADKHAN, S. Role of the snRNAs in spliceosomal active site.. RNA Biol. Roč. 7, čís. 3, s. 345-53. PMID 20458185.
- ↑ TRAHAN, C., Dragon, F. Dyskeratosis congenita mutations in the H/ACA domain of human telomerase RNA affect its assembly into a pre-RNP. RNA. 2009-02-01, roč. 15, čís. 2, s. 235–243. DOI 10.1261/rna.1354009.
- ↑ KIKOVSKA, E.; SVÄRD, SG.; KIRSEBOM, LA. Eukaryotic RNase P RNA mediates cleavage in the absence of protein.. Proc Natl Acad Sci U S A. Feb 2007, roč. 104, čís. 7, s. 2062-7. DOI 10.1073/pnas.0607326104. PMID 17284611.
- ↑ ROUGEMAILLE, M.; VILLA, T.; GUDIPATI, RK., et al. mRNA journey to the cytoplasm: attire required.. Biol Cell. Jun 2008, roč. 100, čís. 6, s. 327-42. DOI 10.1042/BC20070143. PMID 18479253.
- ↑ CLÉRY, A.; BLATTER, M.; ALLAIN, FH. RNA recognition motifs: boring? Not quite.. Curr Opin Struct Biol. Jun 2008, roč. 18, čís. 3, s. 290-8. DOI 10.1016/j.sbi.2008.04.002. PMID 18515081.
- ↑ COLLINS, LJ.; KURLAND, CG.; BIGGS, P., et al. The modern RNP world of eukaryotes.. J Hered. Roč. 100, čís. 5, s. 597-604. DOI 10.1093/jhered/esp064. PMID 19643816.
- ↑ a b c MAO, YS.; ZHANG, B.; SPECTOR, DL. Biogenesis and function of nuclear bodies.. Trends Genet. Aug 2011, roč. 27, čís. 8, s. 295-306. DOI 10.1016/j.tig.2011.05.006. PMID 21680045.
- ↑ a b c d IP, JY.; NAKAGAWA, S. Long non-coding RNAs in nuclear bodies.. Dev Growth Differ. Jan 2012, roč. 54, čís. 1, s. 44-54. DOI 10.1111/j.1440-169X.2011.01303.x. PMID 22070123.
- ↑ a b c INTERNATIONAL HUMAN GENOME SEQUENCING CONSORTIUM. Initial sequencing and analysis of the human genome. Nature. 2001-02-15, roč. 409, čís. 6822, s. 860–921. DOI 10.1038/35057062.
- ↑ BELSHAW, R.; PEREIRA, V.; KATZOURAKIS, A., et al. Long-term reinfection of the human genome by endogenous retroviruses.. Proc Natl Acad Sci U S A. Apr 2004, roč. 101, čís. 14, s. 4894-9. DOI 10.1073/pnas.0307800101. PMID 15044706.
- ↑ DUPRESSOIR, A.; LAVIALLE, C.; HEIDMANN, T. From ancestral infectious retroviruses to bona fide cellular genes: role of the captured syncytins in placentation.. Placenta. Sep 2012, roč. 33, čís. 9, s. 663-71. DOI 10.1016/j.placenta.2012.05.005. PMID 22695103.
- ↑ EDGELL, DR.; CHALAMCHARLA, VR.; BELFORT, M. Learning to live together: mutualism between self-splicing introns and their hosts.. BMC Biol. 2011, roč. 9, s. 22. DOI 10.1186/1741-7007-9-22. PMID 21481283.
- ↑ ROGOZIN, IB.; CARMEL, L.; CSUROS, M., et al. Origin and evolution of spliceosomal introns.. Biol Direct. 2012, roč. 7, s. 11. DOI 10.1186/1745-6150-7-11. PMID 22507701.
- ↑ SERGANOV, Alexander, Huang, Lili; Patel, Dinshaw J. Structural insights into amino acid binding and gene control by a lysine riboswitch. Nature. 2008, roč. 455, čís. 7217, s. 1263–1267. DOI 10.1038/nature07326.
- ↑ HOCINE, S.; SINGER, RH.; GRÜNWALD, D. RNA processing and export.. Cold Spring Harb Perspect Biol. Dec 2010, roč. 2, čís. 12, s. a000752. DOI 10.1101/cshperspect.a000752. PMID 20961978.
- ↑ BLOWER, MD. Molecular insights into intracellular RNA localization.. Int Rev Cell Mol Biol. 2013, roč. 302, s. 1-39. DOI 10.1016/B978-0-12-407699-0.00001-7. PMID 23351709.
- ↑ a b c ANDERSON, P.; KEDERSHA, N. RNA granules.. J Cell Biol. Mar 2006, roč. 172, čís. 6, s. 803-8. DOI 10.1083/jcb.200512082. PMID 16520386.
- ↑ VORONINA, E.; SEYDOUX, G.; SASSONE-CORSI, P., et al. RNA granules in germ cells.. Cold Spring Harb Perspect Biol. Dec 2011, roč. 3, čís. 12. DOI 10.1101/cshperspect.a002774. PMID 21768607.
- ↑ KEDERSHA, N.; STOECKLIN, G.; AYODELE, M., et al. Stress granules and processing bodies are dynamically linked sites of mRNP remodeling.. J Cell Biol. Jun 2005, roč. 169, čís. 6, s. 871-84. DOI 10.1083/jcb.200502088. PMID 15967811.
- ↑ WANG, W.; VAN NIEKERK, E.; WILLIS, DE., et al. RNA transport and localized protein synthesis in neurological disorders and neural repair.. Dev Neurobiol. Aug 2007, roč. 67, čís. 9, s. 1166-82. DOI 10.1002/dneu.20511. PMID 17514714.
- ↑ KABERDIN, VR.; SINGH, D.; LIN-CHAO, S. Composition and conservation of the mRNA-degrading machinery in bacteria.. J Biomed Sci. 2011, roč. 18, s. 23. DOI 10.1186/1423-0127-18-23. PMID 21418661.
- ↑ CARPOUSIS, AJ. The RNA degradosome of Escherichia coli: an mRNA-degrading machine assembled on RNase E.. Annu Rev Microbiol. 2007, roč. 61, s. 71-87. DOI 10.1146/annurev.micro.61.080706.093440. PMID 17447862.
- ↑ CHOMCZYNSKI, P.; SACCHI, N. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction: twenty-something years on.. Nat Protoc. 2006, roč. 1, čís. 2, s. 581-5. DOI 10.1038/nprot.2006.83. PMID 17406285.
Literatura
- ZADRAŽIL, Stanislav. Ribonukleové kyseliny. Věčné „druhé“ mezi nukleovými kyselinami. Živa. 2007, čís. 3, s. 98. Dostupné online [cit. 2013-08-14].
- HARTMANN, Roland K. (Roland Karl). Handbook of RNA biochemistry. Weinheim: Wiley-VCH, 2005. ISBN 978-3-527-30826-2.
Související články
- Nukleová kyselina
- Molekulární biologie
- Centrální dogma molekulární biologie
- Genetický kód
- RNA-vazebný protein
- Ribonukleoprotein
Externí odkazy
Šablona:Link GA Šablona:Link GA Šablona:Link GA Šablona:Link GA