Fluorid plutoničitý
| Fluorid plutoničitý | |
|---|---|
![Vzorek fluoridu plutoničitého připraveného v Hanford Site během studené války[1][2]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/17/Plutonium_Tetrafluoride_PuF4_from_Hanford_Site_%28cropped%29.jpg/280px-Plutonium_Tetrafluoride_PuF4_from_Hanford_Site_%28cropped%29.jpg) | |
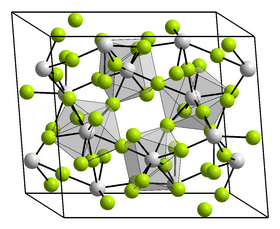 Krystalová struktura fluoridu plutoničitého | |
| Obecné | |
| Systematický název | Fluorid plutoničitý |
| Anglický název | Plutonium tetrafluoride |
| Německý název | Plutonium(IV)-fluorid |
| Sumární vzorec | PuF4 |
| Vzhled | červenohnědé krystaly |
| Identifikace | |
| Registrační číslo CAS | 13709-56-3 |
| PubChem | 139558 |
| SMILES | F[Pu](F)(F)F |
| InChI | InChI=1S/4FH.Pu/h4*1H;/q;;;;+4/p-4
Key: USCBBUFEOOSGAJ-UHFFFAOYSA-J |
| Vlastnosti | |
| Molární hmotnost | 320,09 g/mol |
| Teplota tání | 1037 °C (1898,6 °F; 1,310,15 K) |
| Teplota varu | 1277 °C (2330,6 °F; 1550,15 K) |
| Hustota | 7,1 g/cm3 |
| Rozpustnost ve vodě | 0,01 g/100 ml |
| Struktura | |
| Krystalová struktura | monoklinická |
| Hrana krystalové mřížky | a = 1261 pm, b = 1057 pm, c = 827 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −425 ± 8 kcal·mol−1 |
Některá data mohou pocházet z datové položky. | |
Fluorid plutoničitý je anorganická sloučenina s chemickým vzorcem PuF4. Fluorid plutoničitý je radioaktivní hnědá pevná látka, ale může mít různé barvy v závislosti na velikosti zrn, čistotě, vlhkosti, osvětlení a přítomnosti kontaminantů.[3][4] Hlavním aplikací fluoridu plutoničitého ve Spojených státech je výroba kovového plutonia pro využití v jaderných zbraních.[1]
Příprava
[editovat | editovat zdroj]Fluorid plutoničitý se vyrábí reakcí oxidu plutoničitého nebo fluoridu plutonitého s kyselinou fluorovodíkovou v proudu kyslíku při 450 až 600 °C. Hlavním účelem proudu kyslíku je zabránit redukci produktu plynným vodíkem, který se vyskytuje v kyselině fluorovodíkové:[5]
- PuO2 + O2 + 4 HF → PuF4 + O2 + 2 H2O
- 4 PuF3 + O2 + 4 HF → 4 PuF4 + 2 H2O
Laserovým ozařováním fluoridu plutoniového při vlnových délkách 520 nm jej lze rozložit na fluorid plutoničný a fluor, při pokračování rozkladu až na fluorid plutoničitý.[6]
Vlastnosti
[editovat | editovat zdroj]
Fluorid plutoničitý v pevném stavu tvoří osmi-koordinovaná Pu centra spojené dvojitými můstkovými fluoridovými ligandy.[7] Fluorid plutoničitý krystalizuje v monoklinické krystalové soustavě s prostorovou grupou C12/c1 (Číslo 15) a parametry mřížky a = 1261 pm, b = 1057 pm, c = 827 pm a β = 126,16°.[8]
Fluorid plutoničitý lze redukovat baryem, vápníkem nebo lithiem při teplotě 1200 °C na kovové plutonium:[1][3][4]
- PuF4 + 2 Ba → 2 BaF2 + Pu
- PuF4 + 2 Ca → 2 CaF2 + Pu
- PuF4 + 4 Li → 4 LiF + Pu
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byly použity překlady textů z článků Plutonium tetrafluoride na anglické Wikipedii a Plutonium(IV)-fluorid na německé Wikipedii.
- ↑ a b c United States Department of Energy. Linking Legacies: Connecting the Cold War Nuclear Weapons Production Processes to Their Environmental Consequences [PDF online]. United States Department of Energy, 1997-01 [cit. 2023-12-16]. S. 184. Dostupné online.
- ↑ a b PFEIFFER, Martin. Pfeiffer Nuclear Weapon and National Security Archive. osf.io. 2019-02-05. Dostupné online [cit. 2023-12-16]. DOI 10.17605/OSF.IO/46SFD. (anglicky)
- ↑ a b Plutonium Chemistry. Příprava vydání William T. Carnall, Gregory R. Choppin. Svazek 216. WASHINGTON, D.C.: AMERICAN CHEMICAL SOCIETY (ACS Symposium Series). Dostupné online. ISBN 978-0-8412-0772-1, ISBN 978-0-8412-1031-8. DOI 10.1021/bk-1983-0216.ch024. S. 369–380. (anglicky)
- ↑ a b Plutonium Chemistry. Příprava vydání William T. Carnall, Gregory R. Choppin. Svazek 216. WASHINGTON, D.C.: AMERICAN CHEMICAL SOCIETY (ACS Symposium Series). Dostupné online. ISBN 978-0-8412-0772-1, ISBN 978-0-8412-1031-8. DOI 10.1021/bk-1983-0216.ch023.. Kapitola Present Status and Future Directions of Plutonium Process Chemistry, s. 349–368. (anglicky)
- ↑ GMELIN, Leopold. Gmelins Handbuch der anorganischen Chemie. [s.l.]: Verlag Chemie GMBH 204 s. Dostupné online. ISBN 978-0-387-93410-5. Kapitola Transurane, s. 104–107. (německy)
- ↑ Photochemical preparation of plutonium pentafluoride. Původci vynálezu: Sherman W. RABIDEAU, George M. CAMPBELL. US. Patentový spis US4670239A. 1987-06-02. Dostupné: <online> [cit. 2023-12-16].
- ↑ GREENWOOD. Chemistry of the Elements. [s.l.]: Elsevier Science & Technology Books book s. Dostupné online. ISBN 978-0-08-037941-8. (anglicky)
- ↑ ZACHARIASEN, W. H. Crystal chemical studies of the 5f-series of elements. XII. New compounds representing known structure types. Acta Crystallographica. 1949-12-02, roč. 2, čís. 6, s. 388–390. Dostupné online [cit. 2023-12-16]. DOI 10.1107/S0365110X49001016.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Fluorid plutoničitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid plutoničitý na Wikimedia Commons
