Fluorid manganitý
| Fluorid manganitý | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Fluorid manganitý |
| Anglický název | Manganese(III) fluoride |
| Německý název | Mangan(III)-fluorid |
| Sumární vzorec | MnF3 |
| Vzhled | fialovo růžový prášek |
| Identifikace | |
| Registrační číslo CAS | 7783-53-1 |
| EC-no (EINECS/ELINCS/NLP) | 232-006-6 |
| PubChem | 82213 |
| SMILES | [Mn+3].[F-].[F-].[F-] |
| InChI | InChI=1S/3FH.Mn/h3*1H;/q;;;+3/p-3
Key: SRVINXWCFNHIQZ-UHFFFAOYSA-K |
| Číslo RTECS | OP0882600 |
| Vlastnosti | |
| Molární hmotnost | 111,938 g/mol |
| Teplota tání | > 600 °C (1,112 °F; 873 K) (rozkládá se) |
| Hustota | 3,54 g/cm3 |
| Rozpustnost ve vodě | hydrolyzuje |
| Struktura | |
| Krystalová struktura | jednoklonná |
| Hrana krystalové mřížky | a = 8,904 ± 0,003 Å
c = 13,448 ± 0,005 Å |
| Tvar molekuly | deformovaný oktaedr |
| Bezpečnost | |
| H-věty | H272, H301, H312, H332, H315, H319, H335 |
| P-věty | P210, P280, P301+310, P302+352+312, P304+340+312, P305+351+338[1] |
Některá data mohou pocházet z datové položky. | |
Fluorid manganitý je anorganická sloučenina s chemickým vzorcem MnF3.
Příprava
[editovat | editovat zdroj]Fluorid manganitý lze připravit reakcí roztoku fluorid manganatého s fluorem ve fluorovodíku:[2]
- 2 MnF2 + F2 → 2 MnF3
Fluorid manganitý lze také připravit fluorací manganu:[3]
- 2 Mn + 3 F2 → 2 MnF3
Také je možné připravit fluorid manganitý reakcí fluoru s jodidem manganatým při přibližně 250 °C:[4][5]
- 2 MnI2 + 13 F2 → 2 MnF3 + 4 IF5
Vlastnosti
[editovat | editovat zdroj]Fluorid manganitý je fialovo růžová sůl, která se ve vodě hydrolyzuje. Je stabilní až do teploty 600 °C, kdy se rozkládá na fluorid manganatý.[5][6][7]
Struktura
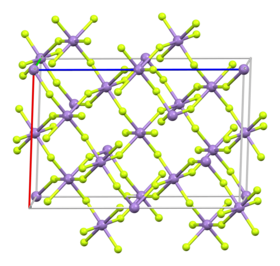
[editovat | editovat zdroj]Fluorid manganitý krystalizuje v jednoklonné krystalové soustavě s prostorovou grupou C2/c (Prostorová grupa číslo 15), která je tvořená protáhlými okraedry MnF6, které jsou deformované v důsledku Jahnova–Tellerova efektu, kdy délky vazby Mn-F jsou 1,79; 1,91 a 2,09 Å. Parametry mřížky jsou a = 8,904 ± 0,003 Å; b = 5,037 ± 0;002 Å; c = 13,448 ± 0,005 Å; β = 92,74 ± 0,04°.[8][9][10]
Trihydrát fluoridu manganitého se získává krystalizací fluoridu manganitého z kyseliny fluorovodíkové. Hydrát existuje ve dvou polymorfních prostorových grupách P21/c a P21/a. Každá z nich se skládá ze soli se vzorcem [Mn(H2O)4F2]+[Mn(H2O)2F4]−.[11]
Reakce
[editovat | editovat zdroj]Fluorid manganitý je lewisova kyselina a tvoří řadu derivátů. Příkladem může být K2MnF3(SO4).[12] Fluorid manganitý reaguje s fluoridem sodným:[4]
- 3NaF + MnF3 → Na3MnF6
Příbuzné reakce solí s anionty MnF52− nebo MnF4− , které zaujímají řetezcovou respektive vrstevnatou strukturu s můstky z fluoridů. Mangan zůstává šestikooridinovaný, oktaedrický a trojmocný.[4]
Fluorid manganitý fluoruje organické sloučeniny včetně aromatických uhlovodíků[13], cyklobutenů[14] a fullerenů.[15]
Fluorid manganitý je pomocí reakce s chloridem bismutitým zdrojem komplexů chloridu manganitého.[16]
Využití
[editovat | editovat zdroj]Fluorid manganitý se využívá jako fluorační činidlo.[17]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byly použity překlady textů z článků Manganese(III) fluoride na anglické Wikipedii a Mangan(III)-fluorid na německé Wikipedii.
- ↑ Manganese(III) fluoride [online]. Sigma-Aldrich [cit. 2023-10-13]. Dostupné online.
- ↑ MAZEJ, Z. Room temperature syntheses of MnF3, MnF4 and hexafluoromanganete(IV) salts of alkali cations. Journal of Fluorine Chemistry. 2002-03, roč. 114, čís. 1, s. 75–80. Dostupné online [cit. 2023-10-13]. DOI 10.1016/S0022-1139(01)00566-8. (anglicky)
- ↑ WebElements Periodic Table » Manganese » reactions of elements. www.webelements.com [online]. [cit. 2023-10-13]. Dostupné v archivu pořízeném z originálu dne 2020-06-25. (anglicky)
- ↑ a b c HOUSECROFT, Catherine E.; SHARPE, A. G. Inorganic Chemistry. [s.l.]: Pearson Prentice Hall 1140 s. Dostupné online. ISBN 978-0-13-175553-6. (anglicky)
- ↑ a b BRAUER, Georg. Handbuch der präparativen anorganischen Chemie. [s.l.]: F. Enke 626 s. Dostupné online. ISBN 978-3-432-02328-1. S. 268. (německy)
- ↑ Manganese. Svazek Volume 17. [s.l.]: [s.n.] Dostupné online.
- ↑ RAU, J. V; ALBERTINI, V. Rossi; CHILINGAROV, N. S. In situ time-resolved X-ray diffraction study of manganese trifluoride thermal decomposition. Journal of Fluorine Chemistry. 2001-05-01, roč. 108, čís. 2, s. 253–256. Dostupné online [cit. 2023-10-13]. ISSN 0022-1139. DOI 10.1016/S0022-1139(01)00368-2.
- ↑ RIEDEL, Erwin; JANIAK, Christoph. Anorganische Chemie. [s.l.]: Walter de Gruyter 980 s. Dostupné online. ISBN 978-3-11-022566-2. (německy)
- ↑ HEPWORTH, M. A.; JACK, K. H.; NYHOLM, R. S. Interatomic Bonding in Manganese Trifluoride. Nature. 1957-01, roč. 179, čís. 4552, s. 211–212. Dostupné online [cit. 2023-10-13]. ISSN 0028-0836. DOI 10.1038/179211b0. (anglicky)
- ↑ HEPWORTH, M. A.; JACK, K. H. The crystal structure of manganese trifluoride, MnF 3. Acta Crystallographica. 1957-05-01, roč. 10, čís. 5, s. 345–351. Dostupné online [cit. 2023-10-13]. ISSN 0365-110X. DOI 10.1107/S0365110X57001024.
- ↑ MOLINIER, Michel; MASSA, Werner. Structures of two polymorphs of MnF3·3H2O. Journal of Fluorine Chemistry. 1992-04, roč. 57, čís. 1–3, s. 139–146. Dostupné online [cit. 2023-10-13]. DOI 10.1016/S0022-1139(00)82825-0. (anglicky)
- ↑ BHATTACHARJEE, Manabendra N.; CHAUDHURI, Mihir K.; LI, Thomas. Dipotassium Trifluorosulfato‐Manganate(III). Příprava vydání Alvin P. Ginsberg. 1. vyd. Svazek 27. [s.l.]: Wiley Dostupné online. ISBN 978-0-471-50976-9, ISBN 978-0-470-13258-6. DOI 10.1002/9780470132586.ch61. S. 312–314. (anglicky)
- ↑ Volume # 1(1), January - February 1998 — "Fluorination of p-chlorobenzotrifluoride by manganese trifluoride.". notes.fluorine1.ru [online]. [cit. 2023-10-13]. Dostupné online. (anglicky)
- ↑ MIZUKADO, Junji; MATSUKAWA, Yasuhisa; QUAN, Heng-dao. Fluorination of fluoro-cyclobutene with high-valency metal fluoride. Journal of Fluorine Chemistry. 2006-01, roč. 127, čís. 1, s. 79–84. Dostupné online [cit. 2023-10-13]. DOI 10.1016/j.jfluchem.2005.10.007. (anglicky)
- ↑ ALESHINA, V. é.; BORSHCHEVSKII, A. Ya.; SKOKAN, E. V. Fluorination of the cubic and hexagonal C60 modifications by crystalline manganese trifluoride. Physics of the Solid State. 2002-04, roč. 44, čís. 4, s. 629–630. Dostupné online [cit. 2023-10-13]. ISSN 1063-7834. DOI 10.1134/1.1470543. (anglicky)
- ↑ NACHTIGALL, Olaf; PATAKI, Astrid; MOLSKI, Matthias. Solvates of Manganese Trichloride Revisited – Synthesis, Isolation, and Crystal Structure of MnCl 3 (THF) 3. Zeitschrift für anorganische und allgemeine Chemie. 2015-05, roč. 641, čís. 6, s. 1164–1168. Dostupné online [cit. 2023-10-13]. ISSN 0044-2313. DOI 10.1002/zaac.201500106. (anglicky)
- ↑ Moskow State University, M. Leskiv, N. Chilingarov, S. Abramov, J. Rau, a L. Sidorov. Investigation of Manganese Trifluoride Thermal Decomposition by Knudsen Cell Mass Spectrometry [PDF online]. [cit. 2023-10-13]. Dostupné online.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Fluorid manganitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid manganitý na Wikimedia Commons


