Fluorid curitý: Porovnání verzí
Založení článku: FLUORID CURITÝ, pracuje se značka: editor wikitextu 2017 |
dokončení založení článku: FLUORID CURITÝ značka: editace z Vizuálního editoru |
||
| Řádek 1: | Řádek 1: | ||
{{Pracuje se|2 dní|11. 10. 2023, 08:25 (CEST)|poznámky=překlad dewiki, enwiki}} |
|||
{{Infobox - chemická sloučenina |
{{Infobox - chemická sloučenina |
||
| obrázek = Kristallstruktur Lanthanfluorid.png |
| obrázek = Kristallstruktur Lanthanfluorid.png |
||
| Řádek 15: | Řádek 14: | ||
| teplota tání = 1406 ± 20 °C |
| teplota tání = 1406 ± 20 °C |
||
| rozpustnost = 10 mg·l<sup>−1</sup> |
| rozpustnost = 10 mg·l<sup>−1</sup> |
||
| krystalová struktura = |
| krystalová struktura = [[klencová soustava]] |
||
| hrana mřížky = a = 699,9 pm |
| hrana mřížky = a = 699,9 pm |
||
<br> c = 717,9 pm |
<br> c = 717,9 pm |
||
| standardní slučovací entalpie = −1660 kJ |
| standardní slučovací entalpie = −1660 kJ·mol<sup>−1</sup> |
||
| standardní molární entropie = 121 J |
| standardní molární entropie = 121 J·mol<sup>−1</sup>*K<sup>−1</sup> |
||
}} |
}} |
||
'''Fluorid curitý''' je [[anorganická sloučenina]] s [[Chemický vzorec|chemickým vzorcem]] CmF<sub>3</sub>. |
'''Fluorid curitý''' je [[anorganická sloučenina]] s [[Chemický vzorec|chemickým vzorcem]] CmF<sub>3</sub>. |
||
== Příprava == |
|||
[[Hydrát]] fluoridu curitého lze připravit [[Chemická reakce|reakcí]] [[Voda|vodného]] [[Roztok|roztoku]] [[Curium|curia]] s [[Ion|ionty]] [[Fluor|fluoru]] ve slabě [[Kyseliny|kyselém]] prostředí: |
|||
<chem>Cm^3+ (aq) + 3 F^- (aq) -> CmF3 (s) v</chem> |
|||
Další možností je reakce [[Hydroxid curitý|hydroxidu curitého]] s [[Kyselina fluorovodíková|kyselinou fluorovodíkovou]], čímž také vzniká hydrát. |
|||
[[Anhydrid|Bezvodou]] sůl lze pak získat vysoušením v [[Exsikátor|exsikátoru]] s [[Oxid fosforečný|oxidem fosforečným]] nebo sušením horkým [[Plyn|plynným]] [[Fluorovodík|fluorovodíkem]].<ref>{{Citace monografie |
|||
| příjmení = Lumetta |
|||
| jméno = Gregg J. |
|||
| příjmení2 = Thompson |
|||
| jméno2 = Major C. |
|||
| příjmení3 = Penneman |
|||
| jméno3 = Robert A. |
|||
| titul = Curium |
|||
| url = http://link.springer.com/10.1007/1-4020-3598-5_9 |
|||
| editoři = Lester R. Morss, Norman M. Edelstein, Jean Fuger |
|||
| vydavatel = Springer Netherlands |
|||
| místo = Dordrecht |
|||
| strany = 1397–1443 |
|||
| isbn = 978-1-4020-3555-5 |
|||
| isbn2 = 978-1-4020-3598-2 |
|||
| doi = 10.1007/1-4020-3598-5_9 |
|||
| poznámka = |
|||
| jazyk = en |
|||
}}</ref> |
|||
== Vlastnosti == |
|||
PRACUJE SE |
|||
Fluorid curitý je bezbarvá [[pevná látka]] s [[Teplota tání|teplotou tání]] přibližně 1406 [[Stupeň Celsia|°C]], která je téměř [[Rozpustnost|nerozpustná]] ve vodě. [[Krystalizace|Krystalizuje]] stejně jako [[fluorid lanthanitý]] v [[Klencová soustava|klencové soustavě]] s hranami mřížky ''a'' = 699,9 pm a ''c'' = 717,9 pm.<ref>{{Citace monografie |
|||
| příjmení = Maple |
|||
| jméno = T. G. |
|||
| titul = Gmelins Handbuch der Anorganischen Chemie |
|||
| url = http://dx.doi.org/10.1007/978-3-662-13294-4_1 |
|||
| vydavatel = Springer Berlin Heidelberg |
|||
| místo = Berlin, Heidelberg |
|||
| počet stran = 102 |
|||
| strany = |
|||
| isbn = 978-3-662-13295-1 |
|||
| isbn2 = 978-3-662-13294-4 |
|||
}}</ref> Fluorid curitý je [[Radioaktivita|radioaktivní]]. |
|||
== Využití == |
|||
Fluorid curitý lze [[Redukce (chemie)|redukovat]] na [[Kovy|kovové]] curium, reakcí s [[Atom|atomárním]] [[Baryum|baryem]] bez přístupu vody a [[Kyslík|kyslíku]] v reakční aparatuře z [[Tantal|tantalu]] a [[Wolfram|wolframu]].<ref>{{Citace periodika |
|||
| příjmení = Wallmann |
|||
| jméno = J. C. |
|||
| příjmení2 = Crane |
|||
| jméno2 = W. W. T. |
|||
| příjmení3 = Cunningham |
|||
| jméno3 = B. B. |
|||
| titul = The Preparation and Some Properties of Curium Metal |
|||
| periodikum = Journal of the American Chemical Society |
|||
| datum vydání = 1951-01 |
|||
| ročník = 73 |
|||
| číslo = 1 |
|||
| strany = 493–494 |
|||
| issn = 0002-7863 |
|||
| doi = 10.1021/ja01145a537 |
|||
| jazyk = en |
|||
| url = https://pubs.acs.org/doi/abs/10.1021/ja01145a537 |
|||
| datum přístupu = 2023-10-11 |
|||
}}</ref> |
|||
<chem>2CmF3 + 3Ba -> 2Cm + 3BaF2 |
|||
</chem> |
|||
== Reference == |
== Reference == |
||
Verze z 11. 10. 2023, 12:10
| Fluorid curitý | |
|---|---|
 | |
| Obecné | |
| Systematický název | Fluorid curitý |
| Anglický název | Curium(III) fluoride |
| Německý název | Curium(III)-fluorid |
| Sumární vzorec | CmF3 |
| Vzhled | bezbarvá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 13708-79-7 |
| PubChem | 101943145 |
| SMILES | F[Cm](F)F |
| InChI | InChI=1S/Cm.3FH/h;3*1H/p-3
Key: GBBPOGITEOLJJQ-UHFFFAOYSA-K |
| Vlastnosti | |
| Molární hmotnost | 304,06556 g/mol |
| Teplota tání | 1406 ± 20 °C |
| Rozpustnost ve vodě | 10 mg·l−1 |
| Struktura | |
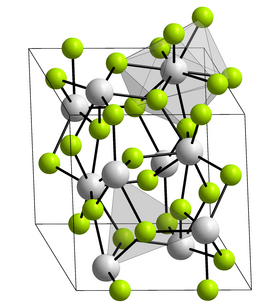
| Krystalová struktura | klencová soustava |
| Hrana krystalové mřížky | a = 699,9 pm
c = 717,9 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −1660 kJ·mol−1 |
| Standardní molární entropie S° | 121 J·mol−1*K−1 |
Některá data mohou pocházet z datové položky. | |
Fluorid curitý je anorganická sloučenina s chemickým vzorcem CmF3.
Příprava
Hydrát fluoridu curitého lze připravit reakcí vodného roztoku curia s ionty fluoru ve slabě kyselém prostředí:
Další možností je reakce hydroxidu curitého s kyselinou fluorovodíkovou, čímž také vzniká hydrát.
Bezvodou sůl lze pak získat vysoušením v exsikátoru s oxidem fosforečným nebo sušením horkým plynným fluorovodíkem.[1]
Vlastnosti
Fluorid curitý je bezbarvá pevná látka s teplotou tání přibližně 1406 °C, která je téměř nerozpustná ve vodě. Krystalizuje stejně jako fluorid lanthanitý v klencové soustavě s hranami mřížky a = 699,9 pm a c = 717,9 pm.[2] Fluorid curitý je radioaktivní.
Využití
Fluorid curitý lze redukovat na kovové curium, reakcí s atomárním baryem bez přístupu vody a kyslíku v reakční aparatuře z tantalu a wolframu.[3]
Reference
V tomto článku byly použity překlady textů z článků Curium(III) fluoride na anglické Wikipedii a Curium(III) fluoride na německé Wikipedii.
- ↑ LUMETTA, Gregg J.; THOMPSON, Major C.; PENNEMAN, Robert A. Curium. Příprava vydání Lester R. Morss, Norman M. Edelstein, Jean Fuger. Dordrecht: Springer Netherlands Dostupné online. ISBN 978-1-4020-3555-5, ISBN 978-1-4020-3598-2. DOI 10.1007/1-4020-3598-5_9. S. 1397–1443. (anglicky)
- ↑ MAPLE, T. G. Gmelins Handbuch der Anorganischen Chemie. Berlin, Heidelberg: Springer Berlin Heidelberg 102 s. Dostupné online. ISBN 978-3-662-13295-1, ISBN 978-3-662-13294-4.
- ↑ WALLMANN, J. C.; CRANE, W. W. T.; CUNNINGHAM, B. B. The Preparation and Some Properties of Curium Metal. Journal of the American Chemical Society. 1951-01, roč. 73, čís. 1, s. 493–494. Dostupné online [cit. 2023-10-11]. ISSN 0002-7863. DOI 10.1021/ja01145a537. (anglicky)


