Leucin: Porovnání verzí
doplněny reference, už se "nepracuje", ale hotové to taky ještě není |
éčko, rozpracovaný doplněk stravy |
||
| Řádek 115: | Řádek 115: | ||
"Repetice bohatá na leucin" ([[leucine-rich repeat]]) je další [[strukturní motiv]] bohatě využívající leucin, je složen z podjednotek (jeden list [[beta-list]]u–smyčka-[[alfa-helix]]), které se skládají do útvaru připomínajícího podkovu. Leucin je zde hluboce zabořen mezi beta-listy a alfa-helixy, které stabilizuje [[hydrofobní]]mi inferakcemi. Vnější strana tohoto strukturního motivu slouží pro interakce mezi proteiny, případně pro vazbu dalších molekul, vyskytuje se například v [[Toll-like receptor]]ech.<ref name="pmid18408889">{{Citace periodika | příjmení = Bella | jméno = J. | příjmení2 = Hindle | jméno2 = KL. | příjmení3 = McEwan | jméno3 = PA. | spoluautoři = et al. | titul = The leucine-rich repeat structure. | periodikum = Cell Mol Life Sci | ročník = 65 | číslo = 15 | strany = 2307-33 | měsíc = Aug | rok = 2008 | doi = 10.1007/s00018-008-8019-0 | pmid = 18408889 }}</ref> |
"Repetice bohatá na leucin" ([[leucine-rich repeat]]) je další [[strukturní motiv]] bohatě využívající leucin, je složen z podjednotek (jeden list [[beta-list]]u–smyčka-[[alfa-helix]]), které se skládají do útvaru připomínajícího podkovu. Leucin je zde hluboce zabořen mezi beta-listy a alfa-helixy, které stabilizuje [[hydrofobní]]mi inferakcemi. Vnější strana tohoto strukturního motivu slouží pro interakce mezi proteiny, případně pro vazbu dalších molekul, vyskytuje se například v [[Toll-like receptor]]ech.<ref name="pmid18408889">{{Citace periodika | příjmení = Bella | jméno = J. | příjmení2 = Hindle | jméno2 = KL. | příjmení3 = McEwan | jméno3 = PA. | spoluautoři = et al. | titul = The leucine-rich repeat structure. | periodikum = Cell Mol Life Sci | ročník = 65 | číslo = 15 | strany = 2307-33 | měsíc = Aug | rok = 2008 | doi = 10.1007/s00018-008-8019-0 | pmid = 18408889 }}</ref> |
||
=== Přídatná látka a doplněk stravy === |
|||
Leucin je klasifikován jako [[Přídatné látky|přídatná látka]] E641,<ref>{{Citace elektronické monografie | titul = E641 - Leucin | vydavatel = emulgatory.cz | datum_přístupu = 2015-01-01 | url = http://www.emulgatory.cz/seznam-ecek/E641 | jazyk = cz}}</ref> patří mezi látky zvýrazňující chuť a vůni. Komerčně je získáván z [[gluten]]u, [[kasein]]u nebo [[keratin]]u. Používá se také jako přídatná látka v umělém sladidle [[aspartam]]u.<ref>{{Citace monografie | příjmení = Winter | jméno = Ruth | titul = A Consumer's Dictionary of Food Additives | vydavatel = Harmony | počet_stran = 608 | isbn = 0307408922 | jazyk = en | vydání=7.}}</ref> |
|||
Leucin je jeden z nejčastěji používaných [[doplněk stravy|doplňků stravy]] v kulturistice.<ref name="pmid24864135">{{Citace periodika | příjmení = Helms | jméno = ER. | příjmení2 = Aragon | jméno2 = AA. | příjmení3 = Fitschen | jméno3 = PJ. | titul = Evidence-based recommendations for natural bodybuilding contest preparation: nutrition and supplementation. | periodikum = J Int Soc Sports Nutr | ročník = 11 | číslo = | strany = 20 | měsíc = | rok = 2014 | doi = 10.1186/1550-2783-11-20 | pmid = 24864135 }}</ref> |
|||
== Zdroje == |
== Zdroje == |
||
Verze z 1. 1. 2015, 23:06
Šablona:Infobox Chemická sloučenina Leucin (Leu, L) je proteinogenní aminokyselina, patřící mezi esenciální aminokyseliny a musí proto být lidmi přijímán v potravě. Spolu s valinem a izoleucinem tvoří skupinu aminokyselin s rozvětveným řetězcem. Díky svému alifatickému postrannímu řetězci se řadí mezi hydrofobní aminokyseliny, a v proteinech je jeho hlavní rolí právě tvorba hydrofobních interakcí, jako je tomu v případě tzv. leucinového zipu, kterými se propojují některé proteiny interagující s DNA.
Historie
Leucin poprvé izoloval Joseph Louis Proust roku 1819 při studiu, čemu vděčí různé druhy sýrů své chuti, kdy zjistil, že fermentací mléčného kaseinu a glutenu z pšeničné mouky lze získat kromě oxidu uhličitého, amoniaku a kyseliny octové i dvě další látky, které provizorně nazval jako kyselina (acide caséique, později určeno jako směs různých látek) a oxid (oxide caséeux, později určen jako leucin).[1][2] O rok později Henri Braconnot lépe přečistil nově získanou bílou krystalickou látku a zjistil, že se nejedná o oxid a že obsahuje dusík; pojmenoval ji leucin podle řeckého slova pro bílou (λευκό).[3]
Funkce a vlastnosti
Chemické vlastnosti
Postranní řetězec leucinu je tvořen rozvětvenou alifatickou isobutylovou skupinou: (CH3)2CH–CH2–, což zajišťuje jeho hydrofobní charakter. Protože isoleucin je isomer leucinu, mají velmi podobné vlastnosti a stejnou molekulovou hmotnost – při analýze proteinů hmotnostní spektrometrií je obtížné je navzájem odlišit, pokud se nezkoumá fragmentace jejich postranních řetězců, což pro náročnost provedení doposud není běžné.[4]
Funkce v proteinech
Leucin se pro svůj hydrofobní charakter vyskytuje především zabořený uvnitř proteinů, kde zprostředkovává hydrofobní interakce. Je málo reaktivní a většinou se proto neúčastní enzymatických reakcí přímo, ale může zajišťovat specifickou vazbu hydrofóbních ligandů, jako jsou například lipidy. Ve většině hydrofóbních interakcí může být snadno nahrazen jinými hydrofóbními aminokyselinami. Protože se větví až na svém γ-uhlíku, tedy poměrně daleko od peptidové kostry, má větší konformační volnost než jinak podobný izoleucin a valin, díky čemuž preferuje konformaci alfa-helix oproti beta-listu.[5] Leucin má významnou roli v řadě proteinových strukturních motivů.
Strukturní motivy proteinů

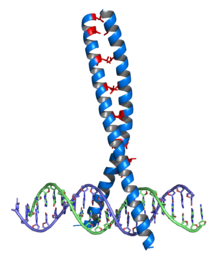
Leucin je významný v některých strukturních motivech, jako je leucinový zip nebo "repetice bohatá na leucin" (leucine-rich repeat), kde zajišťuje hydrofóbní interakce.
Leucinový zip se vyskytuje v řadě proteinů, které interagují s DNA (transkripční faktory), jedná se o dimerizační doménu, pomocí které spolu interagují dva proteiny: každý z nich nese alfa-helix bohatý na leucin (většinou každá sedmá aminokyselina[7]) Pravidelným opakováním leucinu vzniká na povrchu helixu hydrofobní pás, kterým se na sebe vážou. V dimerní formě jsou pak schopné interagovat se specifickými úseky DNA a např. ovlivňovat tak jejich transkripci (transkripční faktory).
"Repetice bohatá na leucin" (leucine-rich repeat) je další strukturní motiv bohatě využívající leucin, je složen z podjednotek (jeden list beta-listu–smyčka-alfa-helix), které se skládají do útvaru připomínajícího podkovu. Leucin je zde hluboce zabořen mezi beta-listy a alfa-helixy, které stabilizuje hydrofobními inferakcemi. Vnější strana tohoto strukturního motivu slouží pro interakce mezi proteiny, případně pro vazbu dalších molekul, vyskytuje se například v Toll-like receptorech.[8]
Přídatná látka a doplněk stravy
Leucin je klasifikován jako přídatná látka E641,[9] patří mezi látky zvýrazňující chuť a vůni. Komerčně je získáván z glutenu, kaseinu nebo keratinu. Používá se také jako přídatná látka v umělém sladidle aspartamu.[10]
Leucin je jeden z nejčastěji používaných doplňků stravy v kulturistice.[11]
Zdroje
Leucin je pro lidi esenciální aminokyselina, proto musí být přijímán v potravě.
Metabolismus
Odbourávání
Leucin je spolu s dalšími aminokyselinami s rozvětveným řetězcem odbouráván ve svalech, tukové tkáni, ledvinách a mozku, kde slouží jako zdroj energie, a ne v játrech, jak je běžné pro ostatní aminokyseliny. Za degradaci je zodpovědný dehydrogenázový komplex 2-ketokyselin s větveným řetězcem (BCKDC), rozklad postranní skupiny probíhá podobným postupem jako beta-oxidace mastných kyselin a výsledným produktem je acetylkoenzym A. Leucin je jednou ze dvou proteinogenních aminokyselin, které jsou výhradně ketogenní (druhá je lyzin), při odbourávání leucinu tedy nevzniká glukóza, ale ketolátka kyselina acetyloctová a jeho využívání jako zdroj energie vede ke ketóze.[12]
Při dědičné nemoci javorového sirupu (neboli leucinóze) nemá tělo funkční komplex (BCKDC) rozkládající aminokyseliny s rozvětveným řetězcem, tedy i leucin, takže při příjmu potravin bohatých na leucin a hladovění (kdy se odbourávají proteiny) se v těle hromadí toxické meziprodukty, jejichž projevem je zápach moči připomínající javorový sirup (případně karamel nebo sušené hrušky). Bez léčby je nemoc smrtelná, léčba spočívá v dietě limitující příjem leucinu.[13]
Reference
- ↑ PROUST, Joseph L. Recherches sur le Principe qui Assaisonne les Fromages. Ann Chim.. 1819, roč. 10, s. 29-49. (francouzsky)
- ↑ WISNIAK, Jaime. Joseph Louis Proust. R evista CENIC Ciencias Químicas [online]. 2012 [cit. 2014-12-30]. Roč. 43, čís. 1. Dostupné online. (anglicky)
- ↑ VICKERY, Hubert. The History of the Discovery of the Amino Acids. Chemical reviews. 1931, roč. 9, čís. 2, s. 169 -318.
- ↑ HURTADO, PP.; O'CONNOR, PB. Differentiation of isomeric amino acid residues in proteins and peptides using mass spectrometry.. Mass Spectrom Rev. 2012, roč. 31, čís. 6, s. 609-25. DOI 10.1002/mas.20357. PMID 22322410.
- ↑ BARNES, Michael R. Bioinformatics for Geneticists: A Bioinformatics Primer for the Analysis of Genetic Data. [s.l.]: Wiley, 2007. 576 s. ISBN 978-0470026205. Kapitola 14: Amino Acid Properties and Consequences of Substitutions, s. en. (anglicky)
- ↑ KOBE, B.; DEISENHOFER, J. Crystal structure of porcine ribonuclease inhibitor, a protein with leucine-rich repeats.. Nature. Roč. 366, čís. 6457, s. 751-6. DOI 10.1038/366751a0. PMID 8264799.
- ↑ Oxford dictionary of biochemistry and molecular biology; revised edition. Příprava vydání R. Cammack et al. New York: Oxford university press, 2006. ISBN 0-19-852917-1.
- ↑ BELLA, J.; HINDLE, KL.; MCEWAN, PA., et al. The leucine-rich repeat structure.. Cell Mol Life Sci. Aug 2008, roč. 65, čís. 15, s. 2307-33. DOI 10.1007/s00018-008-8019-0. PMID 18408889.
- ↑ E641 - Leucin [online]. emulgatory.cz [cit. 2015-01-01]. Dostupné online. (cz)
- ↑ WINTER, Ruth. A Consumer's Dictionary of Food Additives. 7.. vyd. [s.l.]: Harmony 608 s. ISBN 0307408922. (anglicky)
- ↑ HELMS, ER.; ARAGON, AA.; FITSCHEN, PJ. Evidence-based recommendations for natural bodybuilding contest preparation: nutrition and supplementation.. J Int Soc Sports Nutr. 2014, roč. 11, s. 20. DOI 10.1186/1550-2783-11-20. PMID 24864135.
- ↑ NELSON, David L.; COX, Michael M. Lehninger Principles of Biochemistry. [s.l.]: W.H. Freeman ISBN 978-1429234146. Kapitola 18: Amino Acid Oxidation and the Production of Urea. (anglicky)
- ↑ Leucinóza (MSUD) [online]. novorozeneckyscreening.cz [cit. 2014-12-31]. Dostupné online. (cz)
![]() Obrázky, zvuky či videa k tématu leucin na Wikimedia Commons
Obrázky, zvuky či videa k tématu leucin na Wikimedia Commons
