Chlorid ruthenitý
| Chlorid ruthenitý | |
|---|---|
 Model struktury | |
| Obecné | |
| Systematický název | chlorid ruthenitý |
| Sumární vzorec | RuCl3 |
| Identifikace | |
| Registrační číslo CAS | 10049-08-8 |
| PubChem | 82323 |
| SMILES | Cl[Ru](Cl)Cl |
| InChI | InChI=1S/3ClH.Ru/h3*1H;/q;;;+3/p-3 |
| Vlastnosti | |
| Molární hmotnost | 207,43 g/mol |
| Teplota rozkladu | >500 °C (>770 K) |
| Rozpustnost ve vodě | rozpustný hydrát, bezvodý nerozpustný |
Některá data mohou pocházet z datové položky. | |
Chlorid ruthenitý je anorganická sloučenina se vzorcem RuCl3, která často vytváří hydráty, RuCl3·xH2O; v bezvodé i hydratované podobě jde o hnědou až černou pevnou látku. Hydrát, jehož složení se může lišit, ale často bývá uváděno jako trihydrát, se používá na přípravu dalších sloučenin ruthenia.
Příprava a vlastnosti
[editovat | editovat zdroj]Bezvodý chlorid ruthenitý se připravuje zahříváním práškového ruthenia za přítomnosti chloru. Chlorace může probíhat v prostředí obsahujícím oxid uhelnatý, kdy je produkt odnášen proudem plynu a po ochlazení krystalizuje.[1][2]
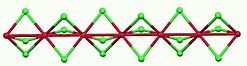
RuCl3 vytváří dva známé alotropy. Černý α-RuCl3 má strukturu podobnou chloridu chromitému (CrCl3), kde vzdálenosti mezi atomy Ru činí 346 pm. Tento alotrop obsahuje vrstvy Ru3+ obklopené oktaedrickými klecemi z aniontů Cl−. Základní stav je nízkospinový s úhlovým momentem L=1.[3][4]
Vrstvy α-RuCl3 jsou drženy Van der Waalsovými silami.[5]
Tmavě hnědý metastabilní β-RuCl3 vytváří hexagonální krystaly; ty se skládají z řetězců osmistěnů propojených vrcholy, kde mají vzdálenosti Ru-Ru hodnotu 283 pm, se strukturou podobající se chloridu zirkonitému. β-RuCl3 lze zahřátím na 450–600 °C nevratně převést na α-formu. β-forma je oproti paramagnetickému α-RuCl3 diamagnetická.[6]
Páry RuCl3 se za vysokých teplot rozkládají na prvky; změna entalpie při 750 °C (1020 K), ΔdissH1020, se odhaduje na +240 kJ/mol.
Koordinační chemie hydrátu
[editovat | editovat zdroj]Protože je RuCl3·xH2O nejběžnější sloučeninou ruthenia, tak se používá na přípravu mnoha dalších. Komplexy ruthenia, například chloridové, mohou mít více různých oxidačních čísel, přičemž v některých jsou nereaktivní. Ruthenium se vyznačuje stabilitou komplexů obsahujících Ru2+, Ru3+ (jako je RuCl3·xH2O) a Ru4+.
Příklady komplexů připravených z RuCl3
[editovat | editovat zdroj]- RuCl2(PPh3)3, hnědě zbarvená sloučenina rozpustná, v benzenu, také použitelná na přípravu dalších sloučenin. Vzniká touto reakcí:[7]
- 2 RuCl3·xH2O + 7 PPh3 → 2 RuCl2(PPh3)3 + OPPh3 + 5 H2O + 2 HCl
- Octan-chlorid ruthenato-ruthenitý, připravovaný redukcí chloridu ruthenitého v kyselině octové
- [RuCl2(C6H6)]2 se získává z cyklohexa-1,3-dienu nebo cyklohexa-1,4-dienu:[8][9]
- 2 RuCl3·xH2O + 2 C6H8 → [RuCl2(C6H6)]2 + 6 H2O + 2 HCl + H2
- Ru(bipy)3Cl2, luminescentní sůl, připravovaná podle této rovnice:[10]
- 2 RuCl3·xH2O + 6 bipy + CH3CH2OH → 2 [Ru(bipy)3]Cl2 + 6 H2O + CH3CHO + 2 HCl
Meziproduktem je cis-Ru(bipy)2Cl2.[10]
- 2 RuCl3·xH2O + 2 C5Me5H → [RuCl2(C5Me5)]2 + 6 H2O + 2 HCl
[RuCl2(C5Me5)]2 lze dále redukovat na [RuCl(C5Me5)]4.
- RuCl3·xH2O + 3 C5H8O2 → Ru(C5H7O2)3 + 3 H2O + 3 HCl
Některé z těchto sloučenin byly využity při výzkumech, za které byly uděleny dvě Nobelovy ceny; v roce 2001 získal Rjódži Nojori Nobelovu cenu za rozvoj [rutheniových katalyzátorů a roku 2005 obdržel Robert Grubbs Nobelovu cenu za rozvoj metatezí alkenů katalyzovaných alkylideny ruthenia.
Reakce s oxidem uhelnatým
[editovat | editovat zdroj]RuCl3(H2O)x reaguje s oxidem uhelnatým, a to i za mírných podmínek;[13] chlorid železitý oproti tomu s CO nereaguje. CO redukuje červenohnědé Ru3+ na světle žluté sloučeniny Ru2+; například vystavení ethanolového roztoku RuCl3(H2O)x oxidu uhelnatému o tlaku 100 kPa může, v závislosti na podmínkách, vést k [Ru2Cl4(CO)4], [Ru2Cl4(CO)4]2−, nebo [RuCl3(CO)3]−. Přidáním ligandů (L) k těmto roztokům vznikají sloučeniny typu Ru-Cl-CO-L (L = PR3). Jejich redukcemi zinkem se tvoří oranžový dodekakarbonyl triruthenia (Ru3(CO)12).
- 6 RuCl3·xH2O + 9 Zn + 24 CO → 2 Ru3(CO)12 + 6x H2O + 9 ZnCl2
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Ruthenium(III) chloride na anglické Wikipedii.
- ↑ H. Remy; M. Kühn. Beiträge zur Chemie der Platinmetalle. V. Thermischer Abbau des Ruthentrichlorids und des Ruthendioxyds. Zeitschrift für anorganische und allgemeine Chemie. 1924, s. 365–388. DOI 10.1002/zaac.19241370127.
- ↑ D. E. Bublitz; W. E. McEwen; J. Kleinberg. Ruthenocene. Organic Syntheses. 1961, s. 96. DOI 10.15227/orgsyn.041.0096.
- ↑ J. M. Fletcher; W. E. Gardner; E. W. Hooper; K. R. Hyde; F. H. Moore; J. L. Woodhead. Anhydrous Ruthenium Chlorides. Nature. 1963, s. 1089–1090. ISSN 0028-0836. DOI 10.1038/1991089a0. Bibcode 1963Natur.199.1089F.
- ↑ K. W. Plumb, J. P. Clancy, L. J. Sandilands, V. Vijay Shankar, Y. F. Hu, K. S. Burch, Hae-Young Kee, Young-June Kim. α−RuCl3: A Spin-Orbit Assisted Mott Insulator on a Honeycomb Lattice. Physical Review B. 2014-07-29, s. 041112. ISSN 1098-0121. DOI 10.1103/physrevb.90.041112. Bibcode 2014PhRvB..90d1112P.
- ↑ Boyi Zhou, Yiping Wang, Gavin B. Osterhoudt, Paula Lampen-Kelley, David Mandrus, Kenneth S. Burch, Erik A. Henriksen. Possible Structural Transformation and Enhanced Magnetic Fluctuations in Exfoliated αRuCl3. Journal of Physics and Chemistry of Solids. 2019, s. 291–295. ISSN 0022-3697. DOI 10.1016/j.jpcs.2018.01.026. Bibcode 2019JPCS..128..291Z.
- ↑ J. M. Fletcher; W. E. Gardner; A. C. Fox; G. Topping. X-Ray, infrared, and magnetic studies of α- and β-ruthenium trichloride. Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1967, s. 1038–1045. DOI 10.1039/J19670001038.
- ↑ P. S. Hallman, T. A. Stephenson, G. Wilkinson „Tetrakis(Triphenylphosphine)Dichloro-Ruthenium(II) and Tris(Triphenylphosphine)-Dichlororuthenium(II)“ Inorganic Syntheses, 1970 volume 12 DOI:10.1002/9780470132432.ch40
- ↑ Martin A. Bennett; Anthony K. Smith. Arene ruthenium(II) complexes formed by dehydrogenation of cyclohexadienes with ruthenium(III) trichloride. Journal of the Chemical Society, Dalton Transactions. 1974, s. 233–241. Dostupné online. ISSN 1364-5447. DOI 10.1039/dt9740000233.
- ↑ M. A. Bennett; T. N. Huang; T. W. Matheson; A. K. Smith. (η6-Hexamethylbenzene)ruthenium Complexes. Inorganic Syntheses. 1982, s. 74–78. ISBN 9780470132524. DOI 10.1002/9780470132524.ch16.
- ↑ a b J. A. Broomhead; C. G. Young. Tris(2,2'-bipyridine)Ruthenium(II) Dichloride Hexahydrate. Inorganic Syntheses. 1990, s. 338–340. ISBN 9780470132593. DOI 10.1002/9780470132593.ch86.
- ↑ Urich Kölle; Janusz Kossakowski. Di-μ-Chloro-Bis[(η5-Pentamethylcyclopentadienyl) Chlororuthenium(III)], [Cp*RuCl2]2 and Di-μ-methoxo-Bis(η5-Pentamethylcyclopentadienyl)diruthenium(II), [Cp*RuOMe]2. Inorganic Syntheses. 1992, s. 225–228. ISBN 9780470132609. DOI 10.1002/9780470132609.ch52.
- ↑ A. Gupta. Improved synthesis and reactivity of tris(acetylacetonato)ruthenium(III). Indian Journal of Chemistry, Section A. 2000, s. 457. ISSN 0376-4710. DOI 10.1002/9780470132609.ch52.
- ↑ A. F. Hill. Simple Ruthenium Carbonyls of Ruthenium: New Avenues from the Hieber Base Reaction. Angewandte Chemie International Edition. 2000, s. 130–134. DOI 10.1002/(SICI)1521-3773(20000103)39:1<130::AID-ANIE130>3.0.CO;2-6. PMID 10649352.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Chlorid ruthenitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Chlorid ruthenitý na Wikimedia Commons
Literatura
[editovat | editovat zdroj]- BECKER, Ramona; HARTWIG, Helga; KÖPPE, Herbert; VANECEK, Hans; VELIĆ, Paul; WARNCKE, Rudolf; ZELLE, Anna. Gmelin Handbuch der Anorganischen Chemie. Redakce Warncke Rudolf. [s.l.]: [s.n.], 1978. ISBN 978-3-662-06226-5. DOI 10.1007/978-3-662-06224-1.
- CARLSEN, P. H. J.; MARTIN, Victor S.; SHARPLESS, K. Barry. A greatly improved procedure for ruthenium tetroxide catalyzed oxidations of organic compounds. The Journal of Organic Chemistry. 1981, s. 3936. DOI 10.1021/jo00332a045.
- COTTON, S. A. Chemistry of Precious Metals. [s.l.]: [s.n.], 1997. ISBN 0-7514-0413-6. DOI 10.1007/978-94-009-1463-6.
- IKARIYA, Takao; MURATA, Kunihiko; NOYORI, Ryoji. Bifunctional transition metal-based molecular catalysts for asymmetric syntheses. Organic and Biomolecular Chemistry. 2006, s. 393–406. DOI 10.1039/B513564H. PMID 16446796.
