Manganistan vápenatý
| Manganistan vápenatý | |
|---|---|
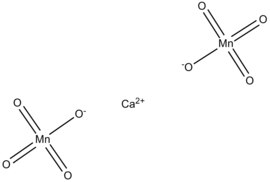 Vzorec | |
| Obecné | |
| Systematický název | Manganistan vápenatý |
| Sumární vzorec | CaMn2O8 |
| Vzhled | Fialová krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 10118-76-0 |
| Vlastnosti | |
| Molární hmotnost | 277,949 9 g/mol (bezvodý); 350,011 2 g/mol (tetrahydrát) |
| Teplota rozkladu | 140 °C; tj. 413 K |
| Hustota | 2,49 g/cm³ (bezvodý) |
| Rozpustnost ve vodě | Pro tetrahydrát:
331 g/100 g (H2O) (14 °C) 338 g/100 g (H2O) (25 °C) |
| Rozpustnost v polárních rozpouštědlech | Rozpustný v kapalném amoniaku; reaguje s ketony, aldehydy a alkoholy |
| Struktura | |
| Krystalová struktura | Kosočtverečná |
| Bezpečnost | |
| R-věty | R8, R22, R50/53 |
| S-věty | S2, S60, S61 |
| NFPA 704 |  0
2
0
OX
|
Některá data mohou pocházet z datové položky. | |
Manganistan vápenatý je fialová, anorganická sloučenina se vzorcem Ca(MnO4)2. Tato látka sama o sobě je poměrně stabilní, v kombinaci s organickými materiály či silnými kyselinami se však stává nebezpečnou.
Výroba
[editovat | editovat zdroj]Tuto látku je možno v laboratorních podmínkách vyrábět reakcí manganistanu draselného a chloridu vápenatého, vzniká manganistan vápenatý, ale vzniká i chlorid draselný, který je ve vodě docela dobře rozpustný, proto je to těžko odstranitelná kontaminace.Rovnice probíhá následně:
2KMnO4 + CaCl2 → Ca(MnO4)2 + 2KCl
Oddělení těchto látek se provádí při snížené teplotě, kolem 0 °C, kdy je rozpustnost chloridu draselného nejnižší, cca 28 g/100 g (H2O).
Další možností výroby jest reakce manganistanu hlinitého a oxidu vápenatého. Při reakci vzniká jako vedlejší produkt oxid hlinitý a malé množství hydroxidu hlinitého, které jsou nerozpustné, a dají se tedy jednoduše oddělit od manganistanu vápenatého. Reakce probíhá za zvýšené teploty, a bez přítomnosti vody. Probíhá dle rovnice:
2 Al(MnO4)3 + 3 CaO → 3 Ca(MnO4)2 + 2 Al2O3
Nakonec se produkty oddělují rozpuštěním ve vodě a filtrací.
Reakce
[editovat | editovat zdroj]Tato látka se při zahřívání na cca 140 °C rozpadá na oxid manganičitý, oxid vápenatý a kyslík, dle rovnice:
2Ca(MnO4)2 —t→ 2 CaO + 4 MnO2 + 3 O2
Proto je tato látka oxidačním činidlem (podstatně slabším, než kupříkladu manganistan draselný). Při kontaktu s organickými materiály (alkoholy, ketony, aldehydy, sulfid uhličitý, benzen, benzín, estery a ethery) se může vznítit, popřípadě explodovat, někdy je potřeba mírné zahřátí.
Reaguje s kyselinou sírovou za vzniku kyseliny manganisté, a následně oxidu manganistého, který je rovněž explozivní:
Ca(MnO4)2 + H2SO4 → CaSO4 + 2HMnO4 → CaSO4 + Mn2O7 + H2O
Nereaguje tak se všemi, kyselinami kupříkladu s kyselinou chlorovodíkovou uvolňuje plynný chlór:
Ca(MnO4)2 + 22HCl → CaCl2 + 8Cl2 + 2MnCl2 + 8H2O + 3H2
Využití
[editovat | editovat zdroj]Tato látka se experimentálně používá na bělení zubů, dále tato látka má dezinfekční účinky, nepoužívá se však příliš často.
Bezpečnost
[editovat | editovat zdroj]Při kontaktu roztoku látky s kůží vzniká na místě hnědo-černá skvrna, která po čase zmizí. Zmizení této skvrny se dá urychlit kupříkladu použitím kyseliny octové, stejně tak se dá vzniká skvrna odstranit z oblečení. V případě kontaktu této látky s očima často dochází k poškození zraku, či až oslepnutí.



