Radiokarbonová metoda datování
Radiokarbonová metoda datování (též uhlíková nebo radiouhlíková metoda) je chemicko-fyzikální metoda určená pro zjištění stáří biologického materiálu. Je založena na výpočtu stáří z poklesu počtu atomů radioaktivního izotopu uhlíku 14C v původně živých objektech. Radiokarbonová metoda byla objevena roku 1940 a používá se především v archeologii, ale taky ve vědách etnobotanických.
Historie[editovat | editovat zdroj]
Vynálezcem radiouhlíkové metody je americký chemik Willard Frank Libby (1908–1980), který svůj nápad určovat stáří organického materiálu pomocí měření obsahu radioaktivního uhlíku publikoval v roce 1947.[1] V roce 1960 dostal za vytvoření této metody Nobelovu cenu za chemii.[2] Na počátku stálo zjištění z roku 1939, že spršky neutronů sekundárního kosmického záření interagují s atomy prvků zastoupených v zemské atmosféře, mj. tedy i s atomy dusíku 14N, čímž vznikají radioaktivní izotopy uhlíku 14C. Libbyho tyto poznatky vedly k závěru, že se malá množství tohoto radioaktivního izotopu musejí nacházet i v molekulách atmosférického oxidu uhličitého – plynu, který se přirozeně dostává do živých organizmů – a že měřením jeho zastoupení ve zbytcích mrtvých těl lze odhadnout jejich stáří.[1]
Sám Libby na počátku ověřoval přesnost své metody srovnáváním jejích výsledků s výsledky dosaženými na stejných či podobných organických vzorcích pomocí jiných metod. Určoval např. stáří vzorků jedlí a sekvojí a srovnával to s výsledky získanými dendrochronologií – počítáním a bližším zkoumáním letokruhů.[1] Dále se Libby zabýval závislostí obsahu radioaktivního izotopu uhlíku na zeměpisné šířce, přičemž ukázal, že se koncentrace izotopu v tělech organizmů s místem na planetě zásadně nemění. Po několika letech zkoumání možností nové metody sepsal knihu Radiocarbon dating, která je dodnes považována za základní informaci o radiouhlíkové metodě.[1] Současná přesnost měření ale ukazuje lokální závislost datování.[3]
Vznik izotopu uhlíku 14C[editovat | editovat zdroj]
Zemská atmosféra je z vesmíru bombardována částicemi primárního kosmického záření. Záření se sráží s částicemi v atmosféře, čímž vzniká sekundární kosmického záření, jež dopadá až na zemský povrch. Interakcemi sekundárního kosmického záření s molekulami vzduchu neustále vznikají nejrůznější radioaktivní nuklidy prvků zastoupených v atmosféře. Srážkou neutronu sekundárního kosmického záření s atomem dusíku 14N vzniká radioaktivní izotop uhlíku 14C,[4] k čemuž dochází v horních vrstvách atmosféry, převážně ve výšce kolem 15 kilometrů. Izotop dále oxiduje na oxid uhličitý, jenž se poté promíchává se svou neaktivní formou tvořenou izotopy 12C a 13C, které nejsou radioaktivní. Tato směs je pak fotosyntézou vstřebávána rostlinami a jejich prostřednictvím se dostává i do těl živočichů.[5]
Princip metody[editovat | editovat zdroj]
Uhlík se pro zjišťování stáří využívá proto, že je z velké části zastoupen v každém živém organismu. V přírodě se izotop 14C vyskytuje jako 0,000 000 000 1 % veškerého uhlíku (na každých 1012 atomů 12C se vyskytuje jeden atom 14C).[4] Zároveň však v živých organizmech, stejně jako kdekoliv jinde, dochází k jeho rozpadu. Změřením poměru jeho koncentrace k stabilnímu 12C je pak možné vypočíst dobu, kdy byl vzorek vyřazen z koloběhu v přírodě (kdy organizmus zemřel).
Podrobněji vychází princip radiouhlíkového datování z faktu, že se v atmosféře zachovává rovnováha mezi tvorbou 14C dopadem kosmického záření a jeho přirozeným radioaktivním rozpadem.[4] Tím pádem panuje i rovnováha mezi koncentracemi 14C a ostatních (neradioaktivních) izotopů 12C a 13C. Poměr těchto koncentrací je tedy v čase konstantní a to platí i pro uhlík, který se dostane do těl živých organizmů. Tato situace trvá do té doby, než organizmus zemře.[2] Tehdy už do mrtvého těla nový uhlík nevstupuje a nelze tak kompenzovat úbytek uhlíku 14C nacházejícího se v těle v okamžiku smrti a rozpadajícího se přirozeným radioaktivním rozpadem, který vytváří zase zpětně dusík:[5]
.
Množství 14C tak počínaje smrtí organizmu začne sledovat křivku zákona radioaktivního rozpadu. Jeho pomocí je již možné spočíst, jak dlouhá doba uplynula mezi proměřením (organického) vzorku a jeho uhynutím, víme-li, jaká byla koncentrace 14C v době úmrtí. Tu lze zjistit (odhadnout) změřením koncentrace tohoto izotopu v současných živých organizmech.
Zákon radioaktivního rozpadu je vyjádřen vzorcem, který určuje časovou závislost koncentrace radioaktivního uhlíku ve zkoumaném vzorku:
,
kde značí rovnovážnou koncentraci 14C v organizmu v okamžiku jeho smrti, koncentraci po čase uplynulém od úmrtí a označuje přeměnovou konstantu izotopu 14C, kterou lze nezávisle experimentálně určit. Počáteční koncentraci dokážeme určit proměřením obsahu 14C u současných živých organizmů. Známe tak všechny konstanty vyskytující se ve vzorci výše a je už jen otázkou elementárního výpočtu vyjádřit proměnnou jako funkci aktuální koncentrace a sice
,
kde symbol nyní představuje nezávislou proměnnou (naměřenou koncentraci) a proměnnou závislou na hodnotě . Dosazením aktuální změřené koncentrace do tohoto vzorce tak spočteme dobu , po kterou se vzorek radioaktivně rozpadal. V následující sekci lze nalézt konkrétní hodnoty doby rozpadu odpovídající danému poměru konečné a původní koncentrace.
Změna obsahu izotopu 14C ve vzorku[editovat | editovat zdroj]
Poločas rozpadu 14C je 5730 let,[4] což znamená, že za tuto dobu poklesne jeho relativní obsah ve vzorku na polovinu. Následující tabulka zobrazuje dobu, za kterou se rozpadne dané procento původního množství 14C v organickém vzorku.
| Doba rozpadu | Procento rozpadnuvšího se uhlíku 14C |
|---|---|
| 5730 let | 50 % |
| 11460 let | 75 % |
| 17190 let | 87,5 % |
| 22920 let | 93,75 % |
| 28650 let | 96,875 % |
| 34380 let | 98,4375 % |
| 40110 let | 99,21875 % |
| 45840 let | 99,609375 % |
| 51570 let | 99,8046875 % |
Pro delší časové úseky se již používají argon nebo uran, protože koncentrace 14C jsou už příliš nízké, než aby mohly být jejich rozdíly změřeny.
Nevýhody[editovat | editovat zdroj]
Nevýhodou této metody je to, že jí lze určit stáří pouze u organických materiálů – živočichů, jídla nebo dřeva. Metoda také určuje stáří materiálu – desky jako podkladu pro malbu (kdy byl poražený strom, ne stáří namalování malby), papíru, pergamenu (kdy zemřelo zvíře, z jehož kůže byl pergamen připraven, ne kdy byl text napsán).
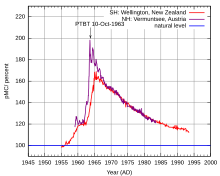
Měření je také omezeno stářím vzorků – nelze přesně určovat vzorky, jejichž reálné stáří přesahuje 50 000 let[6] (v extrémních případech 100 000 let, ale s menší přesností), protože obsah 14C poklesne na příliš nízkou úroveň. Není také možné spolehlivě určit vzorky mladší než 100–200 let,[4] protože v té době se díky spalování uhlí a ropy dostalo do ovzduší velké množství uhlíku pocházejícího z pozůstatků prastarých organizmů, který neobsahuje radioaktivní izotop. V druhé polovině 20. století se naopak množství radioaktivního uhlíku v ovzduší dočasně zvýšilo vlivem jaderných pokusů v atmosféře.
Další nevýhodou je obtížná detekce obsahu uhlíku 14C, protože jeho koncentrace ve vzorku je velmi nízká a zároveň jde o beta zářič s nízkou energií. Proto je jeho měření velmi náročné na kvalitní přístrojové vybavení a tedy i drahé.[5]
Chyba metody dosahuje v optimálním případě 1 %,[5] často však více. Statistický rozptyl, v jakém vychází datace podle této metody, je podle toho v řádech desítek až padesáti let.
Další nevýhodou radiokarbonové metody je, že je to metoda destruktivní,[5] vzorek kosti se spálí (na čistý uhlík) a zjišťuje se aktivita vzorku – ke kolika radioaktivním rozpadům dojde (měření trvá řádově 10 a více h).[4]
Původní metoda vychází z předpokladu, že koncentrace 14C je stálá. Ve skutečnosti však tato koncentrace kolísá. Později byla proto metoda korigována a průměrována zejména pomocí dendrochronologie, ale i dalších metod. Je proto třeba kontrolovat, jestli údaje uvedené u vzorků představují syrová data (obvykle označovaná jako BP – before present, definováno jako „před rokem 1950“), nebo data už přepočtená na běžný letopočet (označována jako BC - před Kristem, nebo AC - po Kristu). Data z druhé poloviny 20. století jsou silně ovlivněna jadernými testy, které výrazně zvýšily dočasně obsah 14C. Naopak vzorky z míst, kde je do organismů vestavěn uhlík z fosilních zdrojů (CO2 vzniklý spálením uhlí nebo ropy), se mohou jevit jako starší.
Využití v archeologii[editovat | editovat zdroj]
Pomocí radiokarbonového datování lze v archeologii relativně přesně stanovit stáří daného archeologického předmětu či nálezu. Metoda je vázána na přítomnost určitého množství organického materiálu ve zkoumaném nálezu, na který se váže 14C (tzv. datovatelná forma uhlíku). S její pomocí tedy můžeme určit stáří např. kosterních pozůstatků a zubů, dřeva, uhlí, rašeliny, papíru nebo kůže a textilních látek. V neposlední řadě pak lze pomocí datování stanovit stáří ulit měkkýšů nebo také nálezů keramiky a keramických úlomků.[7] Pro provedení samotného měření postačí izolovat z nálezu jen stopové množství vzorku (hmotnost až v řádech miligramů). Změřit stáří lze s odpovídající přesností u vzorků až 50 000 let starých. Starší vzorky jsou měřitelné též, ale významně se u nich snižuje přesnost datování a zvyšuje riziko chyby.[8][9]
Příklad[editovat | editovat zdroj]
Archeologové nalezli kostru, která podle měření v laboratoři obsahuje 78,6 % izotopu 14C. V jaké době osoba zemřela? Pro řešení si uvědomíme, že úbytek izotopu znamená opakovanou aplikaci poločasu rozpadu, což je matematicky mocnina se základem 0,5 (jedna polovina). Za jeden rok je to 0,51 (zbyde polovina množství), za dva roky 0,52=0,25 (zbyde čtvrtina) atd. Pokud víme, kolik izotopu v kostře zbylo, stačí najít exponent této mocniny. Dále že v exponentu této mocniny budeme mít zlomek, který má v čitateli počet let a ve jmenovateli poločas rozpadu (aby pro 5730 let byl exponent jedna, pro 10460 byl dva atd.). Procenta pak vyjádříme jako desetinné číslo. Z toho vyplývá následující postup řešení:
- rovnice pro rovnost stáří vzorku a výsledek měření:
- obě strany rovnice zlogaritmujeme:
- odstraníme mocninu uvnitř logaritmu podle pravidla pro počítání s logaritmy:
- ponecháme na jedné straně pouze výraz s neznámou:
- vyjádříme neznámou:
- a vypočteme:
Stáří nalezeného vzorku je tedy 1991 let, což znamená že dotyčná osoba zemřela asi v roce 33 našeho letopočtu (viz Kristus). Chyba měření bude v nejlepším případě 1 %, tedy ±20 let.
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
- ↑ a b c d Radiouhlíkové datování: jak funguje nejrozšířenější datovací metoda [online]. Atom, 2012-11-19 [cit. 2014-07-16]. Dostupné online.
- ↑ a b KLUIBER, Zdeněk, a kol. Moderní směry ve fyzice. Praha: ARCI, 2003. Dostupné online. ISBN 80-86078-28-0. Kapitola 6. Ionizující záření v archeometrii a dějinách umění, s. 33–37.
- ↑ Cornell University. Fine-tuning radiocarbon dating could 'rewrite' ancient events. phys.org [online]. 2020-03-18 [cit. 2023-03-24]. Dostupné online. (anglicky)
- ↑ a b c d e f WAGNER, Vladimír. Jaderná fyzika a kulturní dědictví [online]. Osel, s.r.o., 2008-03-15 [cit. 2014-07-15]. Kapitola Určování stáří. Dostupné online.
- ↑ a b c d e ŠIŇOR, Milan. Radiouhlíková metoda určování stáří [online]. Fakulta jaderná a fyzikálně inženýrská, ČVUT, 1998-02-23 [cit. 2014-07-16]. Dostupné v archivu pořízeném dne 2013-12-25.
- ↑ CHENG, Hai; EDWARDS, R. Lawrence; SOUTHON, John; MATSUMOTO, Katsumi; FEINBERG, Joshua M.; SINHA, Ashish; ZHOU, Weijian. Atmospheric 14C/ 12C changes during the last glacial period from Hulu Cave. S. 1293–1297. Science [online]. 2018-12-14. Roč. 362, čís. 6420, s. 1293–1297. Dostupné online. DOI 10.1126/science.aau0747. (anglicky)
- ↑ Zpracování vzorků - CRL. crl.odz.ujf.cas.cz [online]. [cit. 2018-11-18]. Dostupné v archivu pořízeném z originálu dne 2018-11-19.
- ↑ Radiouhlíkové datování: jak funguje nejrozšířenější datovací metoda – Atominfo.cz. atominfo.cz [online]. [cit. 2018-11-18]. Dostupné online.
- ↑ Dosah metody - CRL. crl.odz.ujf.cas.cz [online]. [cit. 2018-11-18]. Dostupné v archivu pořízeném z originálu dne 2018-11-19.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu radiokarbonová metoda datování na Wikimedia Commons
Obrázky, zvuky či videa k tématu radiokarbonová metoda datování na Wikimedia Commons - Jaderná fyzika a kulturní dědictví Archivováno 25. 12. 2013 na Wayback Machine.
- Ionizující záření v archeometrii a dějinách umění
- Radiouhlíkové datování: jak funguje nejrozšířenější datovací metoda
- An illustrated guide to measuring radiocarbon from archaeological samples – názorný princip metody (anglicky)
- Radiouhlíková metoda určování stáří Archivováno 25. 12. 2013 na Wayback Machine.
- Radiocarbon Dating (anglicky)














