Fluorid neptunitý: Porovnání verzí
Založení článku: FLUORID NEPTUNITÝ, pracuje se značka: editace z Vizuálního editoru |
dokončení založení článku: FLUORID NEPTUNITÝ značka: editor wikitextu 2017 |
||
| Řádek 1: | Řádek 1: | ||
{{Pracuje se|2 dní|14. 10. 2023, 11:12 (CEST)|poznámky=překlad enwiki, dewiki}} |
|||
{{Infobox - chemická sloučenina |
{{Infobox - chemická sloučenina |
||
| obrázek = Kristallstruktur Lanthanfluorid.png |
| obrázek = Kristallstruktur Lanthanfluorid.png |
||
| Řádek 6: | Řádek 5: | ||
| německý název = Neptunium(III)-fluorid |
| německý název = Neptunium(III)-fluorid |
||
| sumární vzorec = NpF<sub>3</sub> |
| sumární vzorec = NpF<sub>3</sub> |
||
| vzhled = fialová pevná látka |
| vzhled = fialová pevná látka<ref>{{Citace monografie |
||
| příjmení = Holleman |
|||
| jméno = Arnold F. |
|||
| příjmení2 = Wiberg |
|||
| jméno2 = Egon |
|||
| příjmení3 = Wiberg |
|||
| jméno3 = Nils |
|||
| titul = Lehrbuch der anorganischen Chemie |
|||
| url = https://books.google.com/books?id=4YbLwAEACAAJ&newbks=0&hl=cs |
|||
| vydavatel = Walter de Gruyter |
|||
| počet stran = 2149 |
|||
| isbn = 978-3-11-017770-1 |
|||
| strany = 1969 |
|||
| jazyk = de |
|||
}}</ref> |
|||
| číslo CAS = 16852-37-2 |
| číslo CAS = 16852-37-2 |
||
| PubChem = 13751216 |
| PubChem = 13751216 |
||
| Řádek 13: | Řádek 26: | ||
| SMILES = F[Np](F)F |
| SMILES = F[Np](F)F |
||
| molární hmotnost = 294,04 g/mol |
| molární hmotnost = 294,04 g/mol |
||
| teplota tání = 1425 °C (2597 °F; 1698,15 K) |
| teplota tání = 1425 °C (2597 °F; 1698,15 K)<ref>{{Citace elektronického periodika |
||
| titul = WebElements Periodic Table » Neptunium » neptunium trifluoride |
|||
| periodikum = www.webelements.com |
|||
| url = https://https://www.webelements.com/compounds/neptunium/neptunium_trifluoride.html |
|||
| datum přístupu = 2023-10-14 |
|||
}}</ref> |
|||
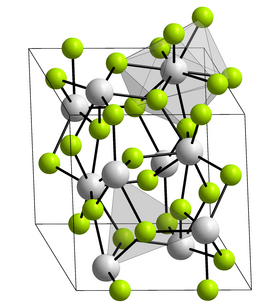
| krystalová struktura = [[Klencová soustava|trigonální]] |
| krystalová struktura = [[Klencová soustava|trigonální]] |
||
| hrana mřížky = a = 712,9 pm |
| hrana mřížky = a = 712,9 pm |
||
| Řádek 58: | Řádek 76: | ||
Může být také připraven reakcí vodného roztoku [[Neptunium|neptunia]] s [[fluoridy]] ve slabé [[Kyseliny|kyselině]]: |
Může být také připraven reakcí vodného roztoku [[Neptunium|neptunia]] s [[fluoridy]] ve slabé [[Kyseliny|kyselině]]: |
||
:Np<sup>3+</sup>(aq) + 3 F<sup>-</sup>(aq) → NpF< |
:Np<sup>3+</sup>(aq) + 3 F<sup>-</sup>(aq) → NpF<sub>3</sub>(s) |
||
Lze jej také připravit redukcí [[Fluorid neptuničitý|fluoridu neptuničitého]] v proudu vodíku:<ref name=":0" /> |
Lze jej také připravit redukcí [[Fluorid neptuničitý|fluoridu neptuničitého]] v proudu vodíku:<ref name=":0" /> |
||
| Řádek 65: | Řádek 83: | ||
== Vlastnosti == |
== Vlastnosti == |
||
Fluorid neptunitý je fialová radioaktivní pevná látka s teplotou tání 1425 °C. Krastalizuje ve struktuře fluoridu lanthanitého v prostorové grupě P6<sub>3</sub>/mmc (číslo 194) s parametry mřížky ''a'' = 712,9 pm a ''c'' = 728,8 pm.<ref name=":1">{{Citace monografie |
|||
| příjmení = Maple |
|||
| jméno = T. G. |
|||
| titul = Gmelins Handbuch der Anorganischen Chemie |
|||
| url = http://dx.doi.org/10.1007/978-3-662-13294-4_1 |
|||
| vydavatel = Springer Berlin Heidelberg |
|||
| místo = Berlin, Heidelberg |
|||
| strany = 515–804 |
|||
| isbn = 978-3-662-13295-1 |
|||
| isbn2 = 978-3-662-13294-4 |
|||
}}</ref><ref>{{Citace periodika |
|||
| příjmení = Zachariasen |
|||
| jméno = W. H. |
|||
| titul = Crystal chemical studies of the 5f-series of elements. XII. New compounds representing known structure types |
|||
| periodikum = Acta Crystallographica |
|||
| datum vydání = 1949-12-02 |
|||
| ročník = 2 |
|||
| číslo = 6 |
|||
| strany = 388–390 |
|||
| doi = 10.1107/S0365110X49001016 |
|||
| url = https://scripts.iucr.org/cgi-bin/paper?S0365110X49001016 |
|||
| datum přístupu = 2023-10-14 |
|||
}}</ref> Každý atom neptunia je obklopen devíti jádry fluoru v deformované trojboké trigonálně prizmatické struktuře. |
|||
== Reakce == |
|||
Fluorid neptunitý se přeměňuje na těkavý [[fluorid neptuniový]] v proudu plynného fluoru při 500 °C:<ref>{{Citace periodika |
|||
| příjmení = Malm |
|||
| jméno = John G. |
|||
| příjmení2 = Weinstock |
|||
| jméno2 = Bernard |
|||
| příjmení3 = Weaver |
|||
| jméno3 = E. Eugene |
|||
| titul = The Preparation and Properties of NpF 5 ; a Comparison with PuF 5 |
|||
| periodikum = The Journal of Physical Chemistry |
|||
| datum vydání = 1958-12 |
|||
| ročník = 62 |
|||
| číslo = 12 |
|||
| strany = 1506–1508 |
|||
| issn = 0022-3654 |
|||
| doi = 10.1021/j150570a009 |
|||
| jazyk = en |
|||
| url = https://pubs.acs.org/doi/abs/10.1021/j150570a009 |
|||
| datum přístupu = 2023-10-14 |
|||
}}</ref> |
|||
2 NpF, + 3 F<sub>2</sub> → 2 NpF<sub>6</sub> |
|||
[[Oxidace|Oxidací]] fluoridu neptunitého směsí kyslíku a fluorovodíku vzniká fluorid neptuničitý:<ref>{{Citace elektronického periodika |
|||
| titul = Neptuniumverbindungen |
|||
| periodikum = www.spektrum.de |
|||
| url = https://www.spektrum.de/lexikon/chemie/neptuniumverbindungen/6220 |
|||
| jazyk = de |
|||
| datum přístupu = 2023-10-14 |
|||
}}</ref> |
|||
4 NpF<sub>3</sub> + O<sub>2</sub> + 4 HF → 4 NpF<sub>4</sub> + 2 H<sub>2</sub>O |
|||
Při reakci s kyslíkem vzniká fluorid neptuničitý a oxid neptuničitý:<ref name=":1" /> |
|||
4 NpF<sub>3</sub> + O<sub>2</sub> → 3 NpF<sub>4</sub> + NpO<sub>2</sub> |
|||
[[Kovy|Kovové]] neptunium lze získat [[Redukce (chemie)|redukcí]]. Fluorid neptunitý reaguje s kovovým [[Baryum|baryem]] nebo [[Lithium|lithiem]] při 1200 °C: |
|||
2 NpF<sub>3</sub> + 3 Ba → 2 Np + 3 [[Fluorid barnatý|BaF<sub>2</sub>]] |
|||
== Bezpečnost == |
|||
== Reference == |
== Reference == |
||
Verze z 14. 10. 2023, 12:18
| Fluorid neptunitý | |
|---|---|
 | |
| Obecné | |
| Systematický název | Fluorid neptunitý |
| Anglický název | Neptunium(III) fluoride |
| Německý název | Neptunium(III)-fluorid |
| Sumární vzorec | NpF3 |
| Vzhled | fialová pevná látka[1] |
| Identifikace | |
| Registrační číslo CAS | 16852-37-2 |
| PubChem | 13751216 |
| SMILES | F[Np](F)F |
| InChI | InChI=InChI=1S/Np.3FH/h;3*1H/q+3;;;/p-3
Key: ZBOLUSKWQLLYDC-UHFFFAOYSA-K |
| Vlastnosti | |
| Molární hmotnost | 294,04 g/mol |
| Teplota tání | 1425 °C (2597 °F; 1698,15 K)[2] |
| Struktura | |
| Krystalová struktura | trigonální |
| Hrana krystalové mřížky | a = 712,9 pm
c = 728,8 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −1529 ± 8 kJ·mol−1 |
| Standardní molární entropie S° | 131 ± 3 J·mol−1·K−1 |
| Standardní slučovací Gibbsova energie ΔGf° | -1461 ± 8 kJ·mol−1 |
| Měrné teplo | 94 ± 3 J·mol−1·K−1 |
Některá data mohou pocházet z datové položky. | |
Fluorid neptunitý je anorganická sloučenina s chemickým vzorcem NpF3.
Příprava
Fluorid neptunitý lze připravit reakcí oxidu neptuničitého s plynnou směsí vodíku a fluorovodíku při 500 °C:[3][4]
- 2 NpO2 + H2 + 6 HF → 2 NpF3 + 4 H2O
Může být také připraven reakcí vodného roztoku neptunia s fluoridy ve slabé kyselině:
- Np3+(aq) + 3 F-(aq) → NpF3(s)
Lze jej také připravit redukcí fluoridu neptuničitého v proudu vodíku:[4]
- 2 NpF4 + H2 → 2 HpF3 + 2 HF
Vlastnosti
Fluorid neptunitý je fialová radioaktivní pevná látka s teplotou tání 1425 °C. Krastalizuje ve struktuře fluoridu lanthanitého v prostorové grupě P63/mmc (číslo 194) s parametry mřížky a = 712,9 pm a c = 728,8 pm.[5][6] Každý atom neptunia je obklopen devíti jádry fluoru v deformované trojboké trigonálně prizmatické struktuře.
Reakce
Fluorid neptunitý se přeměňuje na těkavý fluorid neptuniový v proudu plynného fluoru při 500 °C:[7]
2 NpF, + 3 F2 → 2 NpF6
Oxidací fluoridu neptunitého směsí kyslíku a fluorovodíku vzniká fluorid neptuničitý:[8]
4 NpF3 + O2 + 4 HF → 4 NpF4 + 2 H2O
Při reakci s kyslíkem vzniká fluorid neptuničitý a oxid neptuničitý:[5]
4 NpF3 + O2 → 3 NpF4 + NpO2
Kovové neptunium lze získat redukcí. Fluorid neptunitý reaguje s kovovým baryem nebo lithiem při 1200 °C:
2 NpF3 + 3 Ba → 2 Np + 3 BaF2
Reference
V tomto článku byly použity překlady textů z článků Neptunium(III) fluoride na anglické Wikipedii a Neptunium(III)-fluorid na německé Wikipedii.
- ↑ HOLLEMAN, Arnold F.; WIBERG, Egon; WIBERG, Nils. Lehrbuch der anorganischen Chemie. [s.l.]: Walter de Gruyter 2149 s. Dostupné online. ISBN 978-3-11-017770-1. S. 1969. (německy)
- ↑ WebElements Periodic Table » Neptunium » neptunium trifluoride. www.webelements.com [online]. [cit. 2023-10-14]. Dostupné online.
- ↑ YOSHIDA, Zenko; JOHNSON, Stephen G.; KIMURA, Takaumi. Neptunium. Příprava vydání Lester R. Morss, Norman M. Edelstein, Jean Fuger. Dordrecht: Springer Netherlands Dostupné online. ISBN 978-1-4020-3598-2. DOI 10.1007/1-4020-3598-5_6. S. 699–812. (anglicky)
- ↑ a b KELLER, C. Die Chemie des Neptuniums. Berlin/Heidelberg: Springer-Verlag 1–124 s. Dostupné online. ISBN 3-540-04488-4. S. 63.
- ↑ a b MAPLE, T. G. Gmelins Handbuch der Anorganischen Chemie. Berlin, Heidelberg: Springer Berlin Heidelberg Dostupné online. ISBN 978-3-662-13295-1, ISBN 978-3-662-13294-4. S. 515–804.
- ↑ ZACHARIASEN, W. H. Crystal chemical studies of the 5f-series of elements. XII. New compounds representing known structure types. Acta Crystallographica. 1949-12-02, roč. 2, čís. 6, s. 388–390. Dostupné online [cit. 2023-10-14]. DOI 10.1107/S0365110X49001016.
- ↑ MALM, John G.; WEINSTOCK, Bernard; WEAVER, E. Eugene. The Preparation and Properties of NpF 5 ; a Comparison with PuF 5. The Journal of Physical Chemistry. 1958-12, roč. 62, čís. 12, s. 1506–1508. Dostupné online [cit. 2023-10-14]. ISSN 0022-3654. DOI 10.1021/j150570a009. (anglicky)
- ↑ Neptuniumverbindungen. www.spektrum.de [online]. [cit. 2023-10-14]. Dostupné online. (německy)
