Mukaijamova totální syntéza taxolu

Mukaijamova totální syntéza taxolu je totální syntéza taxolu, kterou vyvinul Teruaki Mukaijama v letech 1997 až 1999.
Jedná se o lineární syntézu, při níž se cykly vytváří v pořadí C, B, A, D. Na rozdíl od ostatních popsaných postupů se zde vedlejší řetězec vytváří jedinečným způsobem. Součástí této syntézy je 5 aldolových reakcí a jsou do ní také zahrnuty pinakolové párování a Reformatského reakce. 20uhlíkatý řetězec se vytváří z L-serinu (C3), kyseliny isomáselné (C4), kyseliny glykolové (C2), brommethanu (C1), jodmethanu (C1), 2,3-dibrompropenu (C3), kyseliny octové (C2) a homoallylbromidu (C4).
Syntéza kruhu C
[editovat | editovat zdroj]Spodní část cyklooktanového kruhu B zahrnuje prvních 5 atomů uhlíku připojených v částečné syntéze; jako výchozí materiál byl použit L-serin (obrázek 1). Na začátku byla převedena aminová skupina serinu na methylester (1) a následně ester diolu 2 diazotací za použití dusitanu sodného a kyseliny sírové). Po navázání chránicí skupiny (TBS, pomocí TBSCl a imidazolu) na primární alkohol a benzyletherové na sekundární alkohol (za použití benzylimidátu a kyseliny trifluormethansulfonové) reagoval aldehyd 3 s methylesterem kyseliny isomáselné (4) v aldolové adici za vzniku alkoholu 5 s 65% stereoselektivitou. Tato skupina byla ochráněna PMB (p-methoxybenzyl)etherem (znovu přes imidát) v kroku 6, čímž byla umožněna redukce esteru na aldehyd 7 s použitím diisobutylaluminiumhydridu.
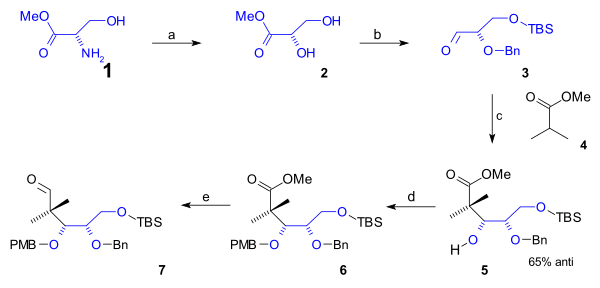 |
| Obrázek 1 |
|---|
K dokončení tvorby cyklooktanu bylo potřeba přidat další 3 atomy uhlíku pomocí dvouuhlíkatého fragmentu aldolovou adicí a jednouhlíkatého Grignardova činidla (obrázek 2). Následovala Mukaijamova aldolová adice aldehydu 7 a ketensilylacetalu za přítomnosti bromidu hořečnatého a toluenu 8, kterou se se 71% stereoselektivitou tvořil alkohol 9; ten byl následně ochráněn převedením na TBS ether 10 s využitím TBSOTf a 2,6-lutidinu). Esterová skupina se redukovala disobutylaluminiumhydridem na alkohol a pak byla Swernovou oxidací převedena zpět na aldehyd 11. Alkylací na alkohol 12 pomocí methylmagnesiumbromidu a další Swernovou oxidací se vytvořil keton 13. Tato skupina se působením bis(trimethylsilyl)amidu lithného a TMSCl přeměnila na silylenolether 14, vzniklý produkt se zapojil do reakce s N-bromsukcinimidem (NBS) za vzniku alkylbromidu 15. Na C20 se navázala methylová skupina nukleofilní substituční reakcí s jodmethanem za přítomnosti silné zásady ([bis(trimethylsilyl)amidu lithného v hexamethylfosforamidu, HMPA) a vznikl bromid 16. Poté byla provedena příprava na uzavření kruhu, spočívající v odstranění TBS etherové skupinykyselinou chlorovodíkovou s tetrahydrofuranem (THF) a alkohol prošel Swernovou oxidací na aldehyd 17. Uzavření kruhu bylo uskutečněno prostřednictvím Reformatského reakce s jodidem samarnatým a kyselinou octovou za vzniku sloučeniny 18. Stereochemie tohoto kroku nebyla podstatná, protože acetátová skupina byla 1,8-diazabicyklo[5.4.0]undec-7-enem (DBU) v benzenu dehydratována na alken 19.
 |
| Obrázek 2 |
|---|
Syntéza kruhu B
[editovat | editovat zdroj]Pětiuhlíkatý fragment 24 nutný pro syntézu C kruhu (obrázek 3) vznikl z 2,3-dibrompropenu (20)[1] reakcí s ethylacetátem (21), n-butyllithiem a solí mědi, po níž následovala redukce acetátu 22 na alkohol 23 hydridem lithnohlinitým a následnou TES silylací. Michaelova reakce 24 s cyklooktanem a t-butyllithiem 19 za vzniku 25 byla katalyzována kyanidem měďným. Po odstranění TES skupiny pomocí HCl a THF byl alkohol 26 zoxidován na aldehyd 27 ruthenistanem tetrapropylamonným (TPAP) za přítomnosti N-methylmorfolin-N-oxidu (NMO), což umožnilo provést vnitromolekulární aldolovou reakci a tvorbu bicyklické sloučeniny 28.
 |
| Obrázek 3 |
|---|
Syntéza kruhu A
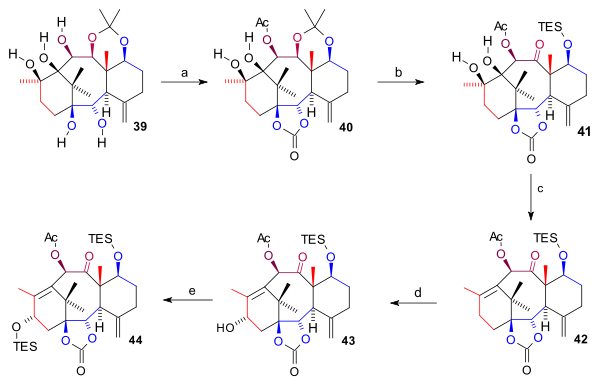
[editovat | editovat zdroj]Syntéza kruhu A (obrázek 4) začíná redukcí devítiuhlíkatého ketonu 28 na diol 29 roztokem hydridu hlinitého v toluenu, následovalo navázání chránicí skupiny, karbonátu, na diol 30. Tímto byla umožněna selektivní oxidace alkoholu 2,3-dichlor-5,6-dikyano-1,4-benzochinonem (DDQ) po odstranění chránicí skupiny z ketonu 31. Vzniklá sloučenina byla alkylována Grignardovým činidlem (homoallylmagnesiumbromidem) na 32 a zbavena chránicí skupiny na C11 tetra-n-butylamoniumfluoridem za tvorby diolu 33. Reakcí s cyklohexylmethylsilyldichloridem vytvořily obě alkoholové skupiny cyklický silylether (34), jenž vstoupil do reakce s methyllithiem a vznikl tak 11uhlíkatý alkohol 35. Uzavření kruhu A vyžadovalo dvě ketonové skupiny zapojené do pinakolového párování, které se vytvořily oxidací tohoto alkoholu ruthenistanem tetrapropylamonia (TPAP) za přítomnosti N-methylmorfolin-N-oxidu (NMO) na 36 a Wackerovou oxidací allylu na diketon 37. Po vytvoření pinakolu 38 byly odstraněny benzylové skupiny sodíkem a amoniakem a po odštěpení trialkylsilylů tetra-n-butylamoniumfluoridem vznikl pentaol 39.
 |
| Obrázek 4 |
|---|
Na pentaol 39 byly dvakrát navázány chránicí skupiny: dva hydroxyly jako estery kyseliny uhličité pomocí bis(trichlormethyl)karbonátu v pyridinu a navíc se C10 hydroxyl přeměnil na acetát; vznikl tak produkt 40. Byl odstraněn acetonid kyselinou chlorovodíkovou a tetrahydrofuranem, poté se C7 hydroxyl přeměnil na TES silylether a C11 hydroxyl se ruthenistanem tetrapropylamonia za přítomnosti NMO zoxidoval na keton 41. Odstranění diolu bylo provedeno kombinací eliminační reakce s Bartonovou–McCombieovou deoxygenací thiokarbonyldiimidazolem za vzniku alkenu 42. Nakonec byla do struktury zavedena C15 hydroxylová skupina dvoukrokovou oxidací allylu 4-fenyl-4-(1-piperidinyl)cyklohexanolem (PPC) a octanem sodným na enon, jenž působením K-selektridu vytvořil alkohol 43; ten byl ochráněn jako TES ether (44).
 |
| Obrázek 5 |
|---|
Syntéza kruhu D
[editovat | editovat zdroj]Při syntéze kruhu D (obrázek 6) byla prvním krokem allylová bromace sloučeniny 44 bromidem měďným a benzoyl-terc-butylperoxidu, jejímž produktem byl bromid 45. Další bromací se vytvořil bromid 46 (obě molekuly vytváří rovnováhu s atomem bromu v axiální poloze. Následně posloužil oxid osmičelý k tvorbě hydroxylových skupin na exocyklické dvojné vazbě diolu 47 a proběhlo uzavření oxetanového kruhu za vzniku 48 pomocí nukleofilní substituční reakce s 1,8-diazabicykloundec-7-enem (DBU). Poté byla provedena acylace C4 hydroxylu anhydridem kyseliny octové v 4-dimethylaminopyridinu (DMAP) a pyridinu a vznikl acetát 49. Nakonec byla s využitím fenyllithia otevřena esterová skupina, čímž se utvořil hydroxykarbonát 50 a obě TES skupiny byly odstraněny kyselinou fluorovodíkovou, čímž vznikl triol 51 (baccatin III) a C7 hydroxyl byl znovu ochráněn (52).
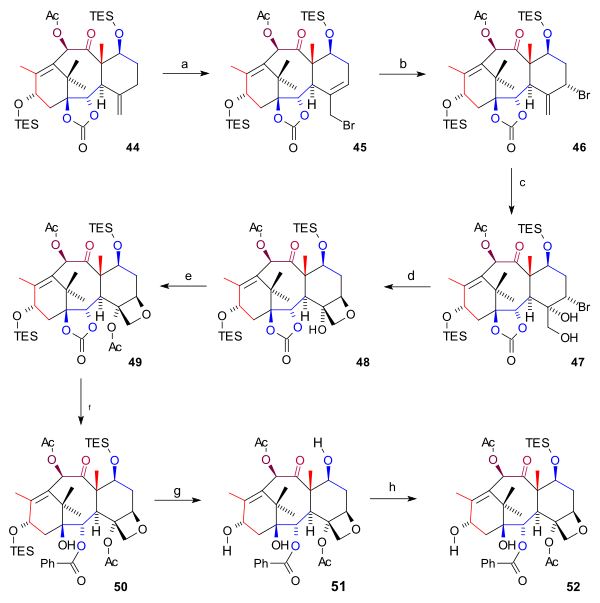 |
| Obrázek 6 |
|---|
Syntéza postranního řetězce
[editovat | editovat zdroj]Syntéza amidového postranního řetězce (obrázek 7) byla založena na asymetrické aldolové reakci. Výchozí látkou byla kyselina benzyloxyoctová 53, která byla přeměněna na thioester 55 přes acylchlorid 54 (reakcí s chloridem thionylu). Poté silylenolether 56 vytvořený reakcí s n-butyllithiem a trimethylsilylchloridem v diisopropylaminu, reagoval v Mukaijamově aldolové adici s benzaldehydem a vytvořil alkohol 59 s 99% anti-selektivitou a 96% enantiomerním přebytkem. V následujícím kroku byl alkohol převeden na amin 60 Micunobovou reakcí (s azidovodíkem a diethylazodikarboxylátem za vzniku azidu a redukcí tohoto azidu trifenylfosfinem na amin. Pak následovaly benzoylace aminové skupiny benzoylchloridem (61) a hydrolytické oddělení thioetheru 62.
 |
| Obrázek 7 |
|---|
Navázání postranního řetězce
[editovat | editovat zdroj]V závěrečných krocích (obrázek 8) došlo k navázání amidového řetězce 62 na ABCD kruh 52 esterifikací katalyzovanou o,o'-di(2-pyridyl)thiokarbonátem (DPTC) a 4-dimethylaminopyridinem (DMAP), čímž byl získán ester 63. Benzylová chránící skupina byla odštěpena hydrogenací hydroxidem palladnatým na uhlíku (64) a TES reakcí s kyselinou fluorovodíkovou a pyridinem, čímž vznikl konečný produkt, taxol 65.
 |
| Obrázek 8 |
|---|
Odkazy
[editovat | editovat zdroj]Související články
[editovat | editovat zdroj]- Totální syntéza taxolu
- Danishefského totální syntéza taxolu
- Holtonova totální syntéza taxolu
- Kuwadžimova totální syntéza taxolu
- Nicolaouova totální syntéza taxolu
- Wenderova totální syntéza taxolu
- Takahašiova totální syntéza taxolu
Externí odkazy
[editovat | editovat zdroj]Literatura
[editovat | editovat zdroj]- Teruaki Mukaiyama. Asymmetric Total Synthesis of Taxol Teruaki Mukaiyama , Isamu Shiina, Hayato Iwadare, Masahiro Saitoh, Toshihiro Nishimura, Naoto Ohkawa, Hiroki Sakoh, Koji Nishimura, Yu-ichirou Tani, Masatoshi Hasegawa, Koji Yamada , Katsuyuki Saitoh. Chemistry—A European Journal. 1999, s. 121–161. DOI 10.1002/(SICI)1521-3765(19990104)5:1<121::AID-CHEM121>3.0.CO;2-O.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Mukaiyama Taxol total synthesis na anglické Wikipedii.
- ↑ R. LESPIEAU AND M. BOURGUE. 2,3-Dibromopropene. Org. Synth.. 1941. Dostupné online.; Coll. Vol.. S. 209.
