Bis(trimethylsilyl)amid lithný
| Bis(trimethylsilyl)amid lithný | |
|---|---|
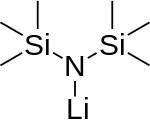 Strukturní vzorec monomeru | |
 Strukturní vzorec cyklického trimeru | |
 Model molekuly cyklického trimeru | |
| Obecné | |
| Systematický název | 1,1,1-trimethyl-N-(trimethylsilyl)silanaminid lithný |
| Ostatní názvy | hexamethyldisilazid lithný |
| Sumární vzorec | C6H18LiNSi2 |
| Vzhled | bílá pevná látka ? |
| Identifikace | |
| Registrační číslo CAS | 4039-32-1 |
| PubChem | 2733832 |
| SMILES | C[Si](C)(C)[N-][Si](C)(C)C.[Li+] (iontový monomer) C[Si](C)(C)[N+]0([Si](C)(C)C)[Li-][N+]([Si](C)(C)C)([Si](C)(C)C)[Li-][N+]([Si](C)(C)C)([Si](C)(C)C)[Li-]0 (cyklický trimer) |
| InChI | InChI=1S/C6H18NSi2.Li/c1-8(2,3)7-9(4,5)6;/h1-6H3;/q-1;+1 |
| Vlastnosti | |
| Molární hmotnost | 167,33 g/mol |
| Teplota tání | 71 až 72 °C (344 až 345 K) |
| Teplota varu | 80 až 84 °C (353 až 357 K) |
| Hustota | 0,86 g/cm3 |
| Disociační konstanta pKa | 26 |
| Rozpustnost ve vodě | rozkládá se |
| Rozpustnost v polárních rozpouštědlech | rozpustný v tetrahydrofuranu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v hexanu a toluenu |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H228 H314[1] |
| P-věty | P210 P240 P241 P260 P264 P280 P301+330+331 P303+361+353 P304+340 P305+351+338 P310 P321 P363 P370+378 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Bis(trimethylsilyl)amid lithný (zkráceně LiHMDS) je lithiovaná organická sloučenina křemíku se vzorcem LiN[Si(CH3)3]2. Používá se jako nenukleofilní zásada a jako ligand. Podobně jako mnoho dalších organolithných sloučenin se shlukuje a vytváří za nepřítomnosti koordinujících látek cyklický trimer.
Příprava
[editovat | editovat zdroj]LiHMDS se dá zakoupit, ovšem také jej lze připravit deprotonací bis(trimethylsilyl)aminu n-butyllithiem.[2][3]
- HN[Si(CH3)3]2 + C4H9Li → LiN[Si(CH3)3]2 + C4H10
Přečištění lze provést sublimací nebo destilací.
Struktura
[editovat | editovat zdroj]Podobně jako řada jiných organolithných sloučenin může bis(trimethylsilyl)amid lithný v roztocích tvořit shluky; jejich velikost závisí na použitém rozpouštědle. V koordinujících rozpouštědlech, jako jsou ethery[4] a amidy[5] převažuje monomerní a dimerní forma, ve kterých se váže jedna nebo dvě molekuly rozpouštědla na kovové centrum. Při přidání amoniaku vytváří trisolvatovaný monomer, který je stabilizován mezimolekulovými vodíkovými vazbami.[6][7] V nekoordinujících rozpouštědlech, například pentanu a aromatických uhlovodících, vznikají oligomery, například trimer.[5] V pevném skupenství má bis(trimethylsilyl)amid lithný trimerní strukturu.[8]

| ||||
 Adukt LiHMDS a TMEDA |
 dimer solvatovaný v tetrahydrofuranu: (LiHMDS)2•THF2 |
 Trimer v pevném skupenství: (LiHMDS)3 | ||
Reakce a použití
[editovat | editovat zdroj]Jako zásada
[editovat | editovat zdroj]LiHMDS se často používá v organické chemii jako silná nenukleofilní zásada.[9] Jeho konjugovaná kyselina má pKa 26,[10] je tak slabší zásadou než jiné organolithné sloučeniny (například u diisopropylamidu lithného je pKa konjugované kyseliny kolem 36), má ovšem silnější sterické působení a tak je mnohem slabším nukleofilem. Lze z něj připravit řadu dalších sloučenin, jako jsou acetylidy[9] a enolátů.[3]

Díky tomu se používá při řadě reakcí v organické syntéze, nejčastěji při tvorbě vazeb uhlík-uhlík, jako jsou smíšené Claisenovy kondenzace.
Při alternativní syntéze tetranitridu tetrasíry se používá {[(CH3)3Si]2N}2S jako prekurzor vazeb S–N. {[(CH3)3Si]2N}2S se připravuje reakcí bis(trimethylsilyl)amidu lithného s chloridem sirnatým.
- 2 [(CH3)3Si]2NLi + SCl2 → [((CH3)3Si)2N]2S + 2 LiCl
[((CH3)3Si)2N]2S reaguje se směsí SCL2 a SO2Cl2 za vzniku S4N4, trimethylsilylchloridu a oxidu siřičitého:[11]
- 2[((CH3)3Si)2N]2S + 2SCl2 + 2SO2Cl2 → S4N4 + 8 (CH3)3SiCl + 2SO2
Jako ligand
[editovat | editovat zdroj]LiHMDS může reagovat s halogenidy kovů za tvorby bis(trimethylsilyl)amidovým komplexů:
- MXx + x Li(hmds) → M(hmds)x + x LiX
- (X může být Cl, Br a I a někdy také F)
Tyto komplexy jsou v důsledku vlastností ligandu lipofilní a tak rozpustné v řadě nepolárních rozpouštědelm diky čemuž jsou často reaktivnější než samotné halogenidy kovů, které se rozpouštějí obtížně. Kvůli výrazným sterickým efektům jsou tyto komplexy monomerní, což vede k dalšímu navýšení reaktivity. Díky zásadité funkční skupině mohou reagovat s běžnými prekurzory ligandů a tak se používají k přípravě složitějších komplexních sloučenin.[12]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Lithium bis(trimethylsilyl)amide na anglické Wikipedii.
- ↑ a b c d Lithium bis(trimethylsilyl)amide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ E. H. Amonoo-Neizer; R. A. Shaw; D. O. Skovlin; B. C. Smith. Lithium Bis(Trimethylsilyl)Amide and Tris(Trimethylsilyl)Amine. Inorganic Syntheses. 1966, s. 19–22. ISBN 978-0-470-13239-5. DOI 10.1002/9780470132395.ch6.
- ↑ a b DANHEISER, R. L.; MILLER, R. F.; BRISBOIS, R. G. Detrifluoroacetylative Diazo Group Transfer: (E)-1-Diazo-4-phenyl-3-buten-2-one. Org. Synth.. 1990, s. 134. Dostupné online.; Coll. Vol.. S. 197.
- ↑ Brett L. Lucht; David B. Collum. Ethereal Solvation of Lithium Hexamethyldisilazide: Unexpected Relationships of Solvation Number, Solvation Energy, and Aggregation State. Journal of the American Chemical Society. 1995, s. 9863–9874. DOI 10.1021/ja00144a012.
- ↑ a b Brett L. Lucht; David B. Collum. Lithium Ion Solvation: Amine and Unsaturated Hydrocarbon Solvates of Lithium Hexamethyldisilazide (LiHMDS). Journal of the American Chemical Society. 1996, s. 2217–2225. DOI 10.1021/ja953029p.
- ↑ R. Neufeld; R. Collum; R. Herbst-Irmer; R. Schöne; E. Stalke. Introducing a Hydrogen-Bond Donor into a Weakly Nucleophilic Brønsted Base: Alkali Metal Hexamethyldisilazides (MHMDS, M = Li, Na, K, Rb and Cs) with Ammonia. Chemistry—A European Journal. 2016, s. 12340–12346. DOI 10.1002/chem.201600833. PMID 27457218.
- ↑ Neufeld, R.: DOSY External Calibration Curve Molecular Weight Determination as a Valuable Methodology in Characterizing Reactive Intermediates in Solution. In: eDiss, Georg-August-Universität Göttingen. 2016.
- ↑ Robin D. Rogers; Jerry L. Atwood; Rainer Grüning. The crystal structure of N-lithiohexamethyldisilazane, [LiN(SiMe3)2]3. Journal of Organometallic Chemistry. 1978, s. 229–237. DOI 10.1016/S0022-328X(00)92291-5.
- ↑ a b George Wu; Mingsheng Huang. Organolithium Reagents in Pharmaceutical Asymmetric Processes. Chemical Reviews. 2006, s. 2596–2616. DOI 10.1021/cr040694k. PMID 16836294.
- ↑ Robert R. Fraser; Tarek S. Mansour; Sylvain Savard. Acidity measurements on pyridines in tetrahydrofuran using lithiated silylamines. The Journal of Organic Chemistry. 1985, s. 3232–3234. DOI 10.1021/jo00217a050.
- ↑ A. Maaninen; J. Shvari; R. S. Laitinen; T. Chivers. Compounds of General Interest. Inorganic Syntheses. 2002, s. 196–199. DOI 10.1002/0471224502.ch4.
- ↑ Michael Lappert; Andrey Protchenko; Philip Power; Alexandra Seeber. Metal Amide Chemistry. Weinheim: Wiley-VCH, 2009. Dostupné online. DOI 10.1002/9780470740385. S. 196–199.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Bis(trimethylsilyl)amid lithný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Bis(trimethylsilyl)amid lithný na Wikimedia Commons



