Tetramethylethylendiamin
| Tetramethylethylendiamin | |
|---|---|
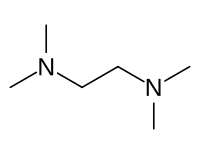 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | N,N,N′,N′-tetramethylethan-1,2-diamin |
| Ostatní názvy | TMEDA, TEMED |
| Funkční vzorec | (CH3)2NCH2CH2N(CH3)2 |
| Sumární vzorec | C6H16N2 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 110-18-9 |
| EC-no (EINECS/ELINCS/NLP) | 203-744-6 |
| PubChem | 8037 |
| SMILES | CN(C)CCN(C)C |
| InChI | InChI=1/C6H16N2/c1-7(2)5-6-8(3)4/h5-6H2,1-4H3 |
| Vlastnosti | |
| Molární hmotnost | 116,20 g/mol |
| Teplota tání | −55,1 °C (218,0 K)[1] |
| Teplota varu | 121 °C (394 K)[1] |
| Hustota | 0,7765 g/cm3 (20 °C)[1] |
| Index lomu | 1,4179 (20 °C)[1] |
| Rozpustnost ve vodě | rozpustný[1] |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H225 H302 H314 H332[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P260 P261 P264 P270 P271 P280 P301+312 P301+330+331 P303+361+353 P304+312 P304+340 P305+351+338 P310 P312 P321 P330 P363 P370+378 P403+235 P405 P501[1] |
| Teplota vzplanutí | 10 °C (283 K)[1] |
Některá data mohou pocházet z datové položky. | |
Tetramethylethylendiamin (zkráceně TMEDA nebo TEMED) je organická sloučenina se vzorcem (CH3)2NCH2CH2N(CH3)2.
Použití
[editovat | editovat zdroj]Jako reaktant
[editovat | editovat zdroj]TMEDA je častým ligandem kovových iontů. Tvoří stabilní komplexy s halogenidy mnoha kovů, například chloridem zinečnatým a měďným, které jsou rozpustné v organických rozpouštědlech. TMEDA zde funguje jako bidentátní ligand.
TMEDA na sebe dobře váže lithné kationty.[2] Ve směsi s n-butyllithiem se atom dusíku z této látky naváže na lithium, čímž vytvoří shluk, který je reaktivnější než obvyklý tetramer či hexamer, který n-butyllithium vytváří. Tento komplex může metalovat, někdy i dvojnásobně, řadu různých substrátů, jako jsou benzen, furan, thiofen, N-alkylpyrroly a ferrocen.[2]
Každý aniontový organokovový komplex lze izolovat ve formě [Li(tmeda)2]+ komplexu.[3] [Li(tmeda)2]+ se zde chová jako kvartérní amoniová sloučenina, jako například [N(C2H5)4]+.

Komplex trimethylethylendiaminu a bis(trimethylsilyl)amidu lithného[4]
V organické syntéze se také používá komplex trimethylethylendiaminu s s-butyllithiem. Tento komplex je vhodný v případech, kdy by n-butyllithný anion reagoval s výchozími látkami.
Ostatní použití
[editovat | editovat zdroj]TEMED se používá společně s peroxodisíranem amonným jako katalyzátor polymerizace akrylamidu při přípravě polyakrylamidových gelů pro SDS-PAGE, metodu používanou pro oddělování bílkovin a nukleových kyselin; TEMED obvykle tvoří 0,1 až 0,2 % těchto gelů.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Tetramethylethylenediamine na anglické Wikipedii.
- ↑ a b c d e f g h i j k N,N,N',N'-Tetramethylethylenediamine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b R. K. Haynes; S. C. Vonwiller; M. R. Vonwiller. Encyclopedia of Reagents for Organic Synthesis. New York: J. Wiley & Sons, 2006. ISBN 0471936235. DOI 10.1002/047084289X.rt064.pub2. Kapitola N,N,N′,N′-Tetramethylethylenediamine.
- ↑ P. M. Morse; G. S. Girolami. Are d0 ML6 Complexes Always Octahedral? The X-ray Structure of Trigonal Prismatic [Li(tmed)]2[ZrMe6]. Journal of the American Chemical Society. 1989, s. 4114–4116.
- ↑ K. W. Henderson; A. E. Dorigo; Q.-L. Liu; P. G. Williard. Effect of Polydentate Donor Molecules on Lithium Hexamethyldisilazide Aggregation: An X-ray Crystallographic and a Combination Semiempirical PM3/Single Point ab Initio Theoretical Study. Journal of the American Chemical Society. 1997, s. 11855.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Tetramethylethylendiamin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Tetramethylethylendiamin na Wikimedia Commons




