Totální syntéza taxolu


Totální syntéza taxolu je souhrnné označení pro postupy využívající k získání taxolu totální syntézu. Tento diterpenoid je důležitý při léčbě nádorů, ovšem také drahý, protože se ze zdroje, kterým je tis západoamerický (Taxus brevifolia). Velký význam má nejen samotná syntéza této sloučeniny, ale také i možnost vytvářet její deriváty nevyskytující se v přírodě, které však také mohou být potenciálně využity.
Molekula obsahuje tetracyklické jádro nazývané baccatin III a amidový vedlejší řetězec. Jednotlivé cykly vytvářející jádro se, zleva doprava, označují kruh A (odvozený od cyklohexenu), kruh B (odvozený od cyklooktanu), kruh C (cyklohexanový) a kruh D (oxetanový).
Vývoj taxolu trval kolem 40 let. Protinádorové účinky kůry tisu západoamerického byly objeveny v roce 1963. Aktivní látka zodpovědná za tuto aktivitu byla nalezena roku 1969 a její strukturu se podařilo určit v roce 1971. Totální syntézu jako první provedl Robert A. Holton v roce 1994 v projektu zahájeném v roce 1982; roku 1989 také vyvinul částečnou syntézu z 10-deacetylbaccatinu III, sloučeniny použité jako biosyntetický prekurzor nacházející se, v množstvích větších než samotný taxol, v tisu červeném (Taxus baccata).
Totální syntéza
[editovat | editovat zdroj]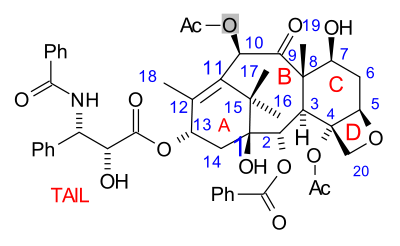

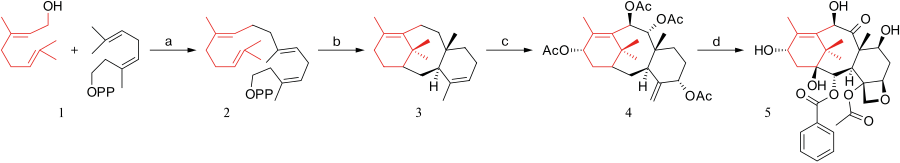
Možnosti totální syntézy taxolu byly nejvíce zkoumány v 90. letech 20. století,[1] v roce 1992 se jimi zabývalo kolem 30 výzkumných skupin, nalézt ji dokázalo pouze 10, přičemž první byly těsně po sobě skupiny vedené Robertem A. Holtonem a K. C. Nicolaouem.
Některé z těchto postupů byly plně syntetické, zatímco jiné zahrnovaly molekuly vyskytující se v přírodě. Všechny mají společné to, že při nich byla nejprve vytvořena molekula baccatinu a následně se provedlo připojení vedlejšího řetězce; toto připojení bylo až na jednu výjimku zprostředkováno Odžimovým laktamem.
- Holtonova totální syntéza taxolu (1994) - prekurzor: patchoulol - postup: lineární syntéza AB, poté C, pak D[2][3]
- Nicolaouova totální syntéza taxolu (1994) - prekurzor: kyselina slizová postup: konvergentní syntéza A a C, spojení do ABC, poté syntéza D[4]
- Danishefského totální syntéza taxolu (1996) - prekurzor: Wielandův–Miescherův keton postup: lonvergentní syntéza C, spojení s D a poté s A za vzniku ABCD (viz příslušný článek)
- Wenderova totální syntéza taxolu (1997) - prekurzor: pinen postup: lineární syntéza AB, pak C, pak D[5][6]
- Kuwadžimova totální syntéza taxolu (1998) - prekurzor:propargylalkohol postup: lineární syntéza A, B, C a nakonec D[7][8]
- Mukaijamova totální syntéza taxolu (1998)[9] Prekurzor: L-serin postup: lineární syntéza B, C, A a D. Viz příslušný článek.
- Takahašiova totální syntéza taxolu(2006)[10] Prekurzor: geraniol postup: konvergentní syntéza A a C, spojení do ABC a poté syntéza D
- Satóova-Čidaova syntéza (2015), formální syntéza s využitím Takahašiova meziproduktu[11][12][13]
- Nakadova syntéza (2015) formální syntéza s využitím Takahašiova meziproduktu[14]
- Baranova syntéza (2020), totální syntéza dvoufázovým divergentním postupem[15]
Další výzkum se zaměřuje na syntézy taxadienu a taxadienonu. Byly i popsány syntézy podobných taxanů, decinnamoyltaxininu E a taxabaccatinu III.[16]
Částečná syntéza
[editovat | editovat zdroj]Průmyslová částečná syntéza taxolu začíná u 10-deacetylbaccatinu III a spočívá v navázání Odžimova laktamu na jeho volný hydroxyl:

Jiná průmyslová výroba spočívá v izolaci několika derivátů taxolu, které mají podobnou strukturu, lišící se pouze organickým zbytkem R na koncové skupině amidového řetězce, což může být mimo jiné fenyl, propyl nebo pentyl, zatímco u taxolu jde vždy o fenyl. Při samotné syntéze se amid přeměňuje na amin pomocí Schwartzova činidla přes iminový meziprodukt, následuje okyselení a benzoylace.
Biosyntéza
[editovat | editovat zdroj]Biosyntéza taxolu se skládá z 20 enzymatických reakcí; dosud nebyla plně objasněna. Popsané části jsou velmi odlišné od popsaných umělých syntéz (viz obrázek výše). Výchozí látkou je geranylgeranylpyrofosfát 2,[17] dimer geraniolu 1. Tato sloučenina již obsahuje 20 atomů uhlíku potřebných pro tvorbu základního řetězce taxolu. Další uzavírání kruhu přes meziprodukt 3 (taxadien) dává vzniknout taxusinu 4.
Dvěma hlavními důvody, proč tuto syntézu nelze provést v laboratoři jsou, že u přírodních procesů je lépe řízena stereochemie a také se zde lépe aktivuje uhlíkový řetězec s kyslíkatými substituenty, kde některé oxygenace provádí cytochrom P450. Meziproduktem 5 je 10-deacetylbaccatin III.
V roce 2011 byla popsána biochemická syntéza taxadienu v kilogramových množstvích pomocí geneticky upravené bakterie Escherichia coli.[18]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Paclitaxel total synthesis na anglické Wikipedii.
- ↑ Nina Hall (2003) "Creating complexity–the beauty and logic of synthesis" [Chemical Communications 2003 (6), 661-664. DOI:10.1039/b212248k
- ↑ Robert A. Holton; CARMEN SOMOZA; HYEONG BAIK KIM; FENG LIANG; RONALD J. BIEDIGER; P. DOUGLAS BOATMAN; MITSURU SHINDO. First total synthesis of taxol. 1. Functionalization of the B ring. Journal of the American Chemical Society. 1994, s. 1597–1598. DOI 10.1021/ja00083a066.
- ↑ Robert A. Holton; HYEONG-BAIK KIM; CARMEN SOMOZA; FENG LIANG; RONALD J. BIEDIGER; P. DOUGLAS BOATMAN; MITSURU SHINDO. First Total Synthesis of Taxol. 2. Completion of the C and D Rings. Journal of the American Chemical Society. 1994, s. 1599–1600. DOI 10.1021/ja00083a067.
- ↑ NICOLAOU, K.C.; YANG, Z.; LIU, J. J.; UENO, H.; NANTERMET, P. G.; GUY, R. K.; CLAIBORNE, C. F. Total synthesis of taxol. Nature. 1994, s. 630–634. DOI 10.1038/367630a0. PMID 7906395. Bibcode 1994Natur.367..630N.
- ↑ Paul A. Wender, Neil F. Badham, Simon P. Conway, Paul E. Floreancig, Timothy E. Glass, Christian Gränicher, Jonathan B. Houze, Jan Jänichen, Daesung Lee, Daniel G. Marquess, Paul L. McGrane, Wei Meng, Thomas P. Mucciaro, Michel Mühlebach, Michael G. Natchus, Holger Paulsen, David B. Rawlins, Jeffrey Satkofsky, Anthony J. Shuker, James C. Sutton, Richard E. Taylor, Katsuhiko Tomooka (1997) "The Pinene Path to Taxanes. 5. Stereocontrolled Synthesis of a Versatile Taxane Precursor" Journal of the American Chemical Society 119 (11), 2755-2756 DOI:10.1021/ja9635387
- ↑ Paul A. Wender, Neil F. Badham, Simon P. Conway, Paul E. Floreancig, Timothy E. Glass, Jonathan B. Houze, Nancy E. Krauss, Daesung Lee, Daniel G. Marquess, Paul L. McGrane, Wei Meng, Michael G. Natchus, Anthony J. Shuker, James C. Sutton, and Richard E. Taylor (1997) "The Pinene Path to Taxanes. 6. A Concise Stereocontrolled Synthesis of Taxol" Journal of the American Chemical Society 119 (11), 2757-2758 DOI:10.1021/ja963539z
- ↑ Koichiro Morihira, Ryoma Hara, Shigeru Kawahara, Toshiyuki Nishimori, Nobuhito Nakamura, Hiroyuki Kusama, and Isao Kuwajima (1998) "Enantioselective Total Synthesis of Taxol" Journal of the American Chemical Society 120 (49), 12980-12981 DOI:10.1021/ja9824932
- ↑ Hiroyuki Kusama, Ryoma Hara, Shigeru Kawahara, Toshiyuki Nishimori, Hajime Kashima, Nobuhito Nakamura, Koichiro Morihira and Isao Kuwajima (2000) "Enantioselective Total Synthesis of (−)-Taxol" Journal of the American Chemical Society 122 (16) 3811-3820. DOI:10.1021/ja9939439
- ↑ Isamu Shiina, Hayato Iwadare, Hiroki Sakoh, Masatoshi Hasegawa, Yu-ichirou Tani, and Teruaki Mukaiyama "A New Method for the Synthesis of Baccatin III" Chemistry Letters 27 (1), 1-2 DOI:10.1246/cl.1998.1
- ↑ Takayuki Doi, Shinichiro Fuse, Shigeru Miyamoto, Kazuoki Nakai, Daisuke Sasuga and Takashi Takahashi (2006) "A Formal Total Synthesis of Taxol Aided by an Automated Synthesizer" Chemistry: An Asian Journal 1 (3), 370-383. DOI:10.1002/asia.200600156
- ↑ Keisuke Fukaya, Yuta Tanaka, Ayako C. Sato, Keisuke Kodama, Hirohisa Yamazaki, Takeru Ishimoto, Yasuyoshi Nozaki, Yuki M. Iwaki, Yohei Yuki, Kentaro Umei, Tomoya Sugai, Yu Yamaguchi, Ami Watanabe, Takeshi Oishi, Takaaki Sato, and Noritaka Chida (2015) "Synthesis of Paclitaxel. 1. Synthesis of the ABC Ring of Paclitaxel by SmI2-Mediated cyclization" Organic Letters 17 (11), 2570-2573 DOI:10.1021/acs.orglett.5b01173
- ↑ Keisuke Fukaya, Keisuke Kodama, Yuta Tanaka, Hirohisa Yamazaki, Tomoya Sugai, Yu Yamaguchi, Ami Watanabe, Takeshi Oishi, Takaaki Sato, and Noritaka Chida (2015) "Synthesis of Paclitaxel. 2. Construction of the ABCD Ring and Formal Synthesis" Organic Letters 17 (11), 2574-2577 DOI:10.1021/acs.orglett.5b01174
- ↑ D. F. Taber (October 5, 2015) [1] Organic Chemistry Highlights (www.organic-chemistry.org)
- ↑ Sho Hirai, Masayuki Utsugi, Mitsuhiro Iwamoto, Masahisa Nakada (2015), "Formal Total Synthesis of (−)-Taxol through Pd-Catalyzed Eight-Membered Carbocyclic Ring Formation" Chemistry: A European Journal 21 (1), 355–359 DOI:10.1002/chem.201404295
- ↑ Yuzuru Kanda, Hugh Nakamura, Shigenobu Umemiya, Ravi Kumar Puthukanoori, Venkata Ramana Murthy Appala, Gopi Krishna Gaddamanugu, Bheema Rao Paraselli and Phil Baran (2020), "Two-Phase Synthesis of Taxol" DOI:10.1021/jacs.0c03592
- ↑ Changxia Yuan, Yehua Jin, Nathan C. Wilde, Phil S. Baran (2016) "Short, Enantioselective Total Synthesis of Highly Oxidized Taxanes" Angewandte Chemie International Edition 55 (29), 8280-8284 DOI:10.1002/anie.201602235
- ↑ MyDoanh Chau, Stefan Jennewein, Kevin Walker, and Rodney Croteau (2004) Taxol Biosynthesis: Molecular Cloning and Characterization of a Cytochrome P450 Taxoid 7β-Hydroxylase Chemistry & Biology, 11 (5), 663-672, DOI:10.1016/j.chembiol.2004.02.025
- ↑ AJIKUMAR, Parayil Kumaran; XIAO, Wen-Hai; TYO, Keith E. J.; WANG, Yong; SIMEON, Fritz; LEONARD, Effendi; MUCHA, Oliver. Isoprenoid Pathway Optimization for Taxol Precursor Overproduction in Escherichia coli. Science. 2010, s. 70–74. DOI 10.1126/science.1191652. PMID 20929806. Bibcode 2010Sci...330...70A.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Totální syntéza taxolu na Wikimedia Commons
Obrázky, zvuky či videa k tématu Totální syntéza taxolu na Wikimedia Commons - Totální syntézy taxolu na SynArchive.com
- Historie syntéz taxolu