Acetylaceton
| Acetylaceton | |
|---|---|
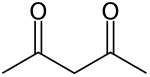 strukturní vzorec | |
 model molekuly (enolforma) | |
 model molekuly (ketoforma) | |
| Obecné | |
| Systematický název | pentan-2,4-dion |
| Anglický název | acetylacetone |
| Německý název | Acetylaceton |
| Funkční vzorec | CH3COCH2COCH3 (keto forma) |
| Sumární vzorec | C5H8O2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 123-54-6 |
| SMILES | O=C(C)CC(=O)C CC(=O)CC(=O)C |
| InChI | 1S/C5H8O2/c1-4(6)3-5(2)7/h3H2,1-2H3 |
| Vlastnosti | |
| Molární hmotnost | 100,12 g/mol |
| Teplota tání | -23 °C (250 K) |
| Teplota varu | 140 °C (413 K) |
| Hustota | 0,975 g/cm3 |
| Rozpustnost ve vodě | 16 g/100 ml |
| Měrná magnetická susceptibilita | 5,48×105 μm3/g |
| Bezpečnost | |
| R-věty | R10 R22 |
| S-věty | S2 S21 S23 S24/25 |
| Teplota vzplanutí | 34 °C |
| Teplota vznícení | 340 °C |
| Meze výbušnosti | 2,4 %-11,6 % |
Některá data mohou pocházet z datové položky. | |
Acetylaceton (systematický název pentan-2,4-dion) je organická sloučenina, která vytváří dva tautomery. Ketoforma má vzorec CH3COCH2COCH3.
Přestože je sloučenina nazvána podle diketonové formy, enolová forma je významnou složkou látky[1] a v mnoha rozpouštědlech převažuje.
Tato látka je prekurzorem acetylacetonátu (acac), běžného bidentátního ligandu. Je také základem pro syntézu heterocyklických sloučenin.
Vlastnosti
Tautomerie
Keto- a enolforma existují společně; jedná se o tautomery. Enolforma má symetrii C2v, což znamená, že vodíkový atom je rovnoměrně sdílen mezi oběma kyslíkovými atomy.[2] V plynném skupenství je rovnovážná konstanta Kketo→enol 11,7 (ve prospěch enolformy). Oba tautomery se dají snadno rozlišit pomocí NMR spektroskopie, infračervené spektroskopie a dalších metod.[3][4]
| Rozpouštědlo | Kketo→enol |
|---|---|
| Plynné skupenství | 11,7 |
| Cyklohexan | 42 |
| Toluen | 10 |
| THF | 7,2 |
| DMSO | 2 |
| Voda | 0,23 |
Rovnovážná konstanta je vysoká v nepolárních rozpouštědlech; ketoforma má větší zastoupení v polárních rozpouštědlech s přítomností vodíkových vazeb, například ve vodě. [5]
Kyselost/zásaditost
Acetylaceton je slabá kyselina:
| rozpouštědlo | T/°C | pKa[6] |
|---|---|---|
| 40% ethanol/voda | 30 | 9,8 |
| 70% 1,4-dioxan/voda | 28 | 12,5 |
| 80% DMSO/voda | 25 | 10,16 |
| DMSO | 25 | 13,41 |
| voda | 25 | 8,99±0,04 |
Velmi silné zásady, například organolithné sloučeniny, způsobují dvojnásobnou deprotonaci acetylacetonu. Vzniklé produkty mohou být alkylovány.
Příprava a výroba
Acetylaceton se průmyslově vyrábí tepelným přesmykem isopropenylacetátu[7]: CH2(CH3)COC(O)Me → MeC(O)CH2C(O)Me
Metody laboratorní přípravy začínají acetonem. Prvním způsobem je reakce acetonu s acetanhydridem za přítomnosti BF3 jako katalyzátoru:
(CH3CO)2O + CH3C(O)CH3 → CH3C(O)CH2C(O)CH3
Druhý způsob spočívá v kondenzaci acetonu a ethylacetátu následované reakcí s kyselinou:
NaOEt + EtO2CCH3 + CH3C(O)CH3 → NaCH3C(O)CHC(O)CH3 + 2 EtOH
NaCH3C(O)CHC(O)CH3 + HCl → CH3C(O)CH2C(O)CH3 + NaCl
Díky jednoduchosti uvedených postupů je známo mnoho acetylacetonátů, tedy solí a esterů acetylacetonu, například C6H5C(O)CH2C(O)C6H5 (dbaH) a (CH3)3CC(O)CH2C(O)CC(CH3)3.
Reakce
Kondenzace
Acetylaceton je všestranným prekurzorem heterocyklických sloučenin, jelikož obě ketoskupiny mohou podstoupit kondenzační reakce. Reakcí s hydrazinem vznikají pyrazoly, s močovinou pyrimidiny.
Koordinační chemie
Acetylacetonátový aniont, acac-, vytváří komplexy s mnoha ionty přechodných kovů. Hlavním způsobem jejich přípravy je reakce příslušného iontu s acetylacetonem za přítomnosti zásady (B):
MBz + z Hacac ⇌ M(acac)z + z BH
Zásada umožňuje odstranění protonů z acetylacetonu a posouvá rovnováhu reakce ve prospěch komplexu. Oba kyslíkové atomy se naváží na kov za vzniku šestičlenného chelátového kruhu. V některých případech je chelatační efekt tak silný, že k tvorbě komplexu není třeba přítomnost zásady. Jelikož takový komplex nemá elektrický náboj, je nerozpustný ve vodě ale rozpustný v nepolárních organických rozpouštědlech.
Biologická rozložitelnost
Acetylaceton se rozkládá působením enzymu acetylacetondioxygenázy, který štěpí vazbu C-C v molekule za vzniku acetátu a 2-oxopropanalu. Enzym k činnosti potřebuje železnaté nebo zinečnaté kationty, které slouží jako prostetická skupina. Biologický rozklad acetylacetonu byl pozorován u bakterie Acinetobacter johnsonii.[8]
C5H8O2 + O2 → C2H4O2 + C3H4O2
Reference
V tomto článku byl použit překlad textu z článku Acetylacetone na anglické Wikipedii.
- ↑ O'BRIEN, Brian. Co(tfa)3 & Co(acac)3 handout [online]. Gustavus Adolphus College. Dostupné online.
- ↑ CAMINATI, W.; GRABOW, J.-U. The C2v Structure of Enolic Acetylacetone. Journal of the American Chemical Society. 2006, s. 854–857. DOI 10.1021/ja055333g. PMID 16417375.
- ↑ MANBECK, Kimberly A.; BOAZ, Nicholas C.; BAIR, Nathaniel C.; SANDERS, Allix M. S.; MARSH, Anderson L. Substituent Effects on Keto–Enol Equilibria Using NMR Spectroscopy. Journal of Chemical Education. 2011, s. 1444–1445. DOI 10.1021/ed1010932.
- ↑ YOSHIDA, Z.; OGOSHI, H.; TOKUMITSU, T. Intramolecular hydrogen bond in enol form of 3-substituted-2,4-pentanedione. Tetrahedron. 1970, s. 5691–5697. DOI 10.1016/0040-4020(70)80005-9.
- ↑ REICHARDT, Christian. Solvents and Solvent Effects in Organic Chemistry. 3rd. vyd. [s.l.]: Wiley-VCH, 2003. ISBN 3-527-30618-8.
- ↑ IUPAC SC-Database A comprehensive database of published data on equilibrium constants of metal complexes and ligands
- ↑ SIEGEL, Hardo; EGGERSDORFER, Manfred. Ullmann's Encyclopedia of Industrial Chemistry. Ketones. Weinheim: Wiley-VCH, 2002. DOI 10.1002/14356007.a15_077.
- ↑ STRAGANZ, G.D.; GLIEDER, A.; BRECKER, L.; RIBBONS, D.W.; STEINER, W. Acetylacetone-cleaving enzyme Dke1: a novel C–C-bond-cleaving enzyme from Acinetobacter johnsonii. Biochem. J.. 2003, s. 573–581. DOI 10.1042/BJ20021047. PMID 12379146.



