Hexan-2,5-dion
| Hexan-2,5-dion | |
|---|---|
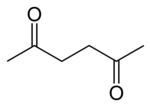 strukturní vzorec | |
| Obecné | |
| Systematický název | Hexan-2,5-dion |
| Ostatní názvy | acetonylaceton, 1,2-diacetylethan, diacetonyl, 2,5-dioxohexan, 2,5-diketohexan |
| Anglický název | hexane-2,5-dione |
| Německý název | 2,5-Hexandion |
| Funkční vzorec | H3CCO(CH2)2COCH3 |
| Sumární vzorec | C6H10O2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 110-13-4 |
| PubChem | 8035 |
| SMILES | O=C(C)CCC(=O)C |
| InChI | 1S/C6H10O2/c1-5(7)3-4-6(2)8/h3-4H2,1-2H3 |
| Číslo RTECS | MO3150000 |
| Vlastnosti | |
| Molární hmotnost | 114,143 8 g/mol |
| Teplota tání | −5,5 °C (267,6 K) |
| Teplota varu | 191,4 °C (564,6 K) |
| Hustota | 0,973 g/cm3 |
| Rozpustnost ve vodě | ≥10 g/100 ml (22 °C) |
| Měrná magnetická susceptibilita | −5,48×105 μm3/g |
| Bezpečnost | |
| [1] Varování[1] | |
| Teplota vzplanutí | 78 °C |
Některá data mohou pocházet z datové položky. | |
Hexan-2,5-dion je alifatický diketon a toxický metabolit hexanu a hexan-2-onu u člověka.
Příznaky otravy[editovat | editovat zdroj]
Chronická toxicita hexanu je způsobena jeho metabolizováním na hexan-2,5-dion. Příznaky otravy jsou brnění a křeče v rukách a nohách, následované celkovou svalovou slabostí. V některých případech byla pozorována atrofie kosterních svalů spolu se ztrátou koordinace a zrakovými problémy.[2]
Podobné příznaky byly pozorovány u zvířat. Jsou spojené s degenerací periferních nervů (a také centrálního nervstva).
Mechanismus účinku[editovat | editovat zdroj]
Předpokládá se, že neurotoxicita hexan-2,5-dionu vyplývá z jeho γ-diketonové struktury, neboť hexan-2,3-dion, hexan-2,4-dion a heptan-2,6-dion nejsou neurotoxické, ovšem heptan-2,5-dion, oktan-3,6-dion a ostatní γ-diketony jsou.[3] Vyšší α-diketony, jako pentan-2,3-dion a hexan-2,3-dion, se dokonce v malých množstvích nacházejí v různých potravinách a používají se jako atromatické přísady do nealkoholických nápojů a pečiva.[4]
Hexan-2,5-dion reaguje s pozůstatky lysinu v axonových bílkovinách za tvorby Schiffových bází následovanou cyklizací za vzniku pyrrolů. Oxidace pyrrolů má za následek síťování mezi dvěma n-hexanem modifikovanými proteiny. Výsledná denaturace proteinů naruší axonální transport a způsobí poškození nervových buněk.[5]
Výroba[editovat | editovat zdroj]
Byl popsán proces výroby hexan-2,5-dionu.[6]
Použití[editovat | editovat zdroj]
Acetonylaceton může být použit v syntéze isokarboxazidu, rolgamidinu a mopidralazinu.
Odkazy[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Hexan-2,5-dion na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hexan-2,5-dion na Wikimedia Commons
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Hexane-2,5-dione na anglické Wikipedii.
- ↑ a b 2,5-Hexanedione. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Couri D, Milks M. "Toxicity and metabolism of the neurotoxic hexacarbons n-hexane, 2-hexanone, and 2,5-hexanedione" Annu. Rev. Pharmacol. Toxicol. 1982;22:145-66.
- ↑ Stephen R. Clough; LEYNA MULHOLLAND. Encyclopedia of Toxicology. 2nd. vyd. [s.l.]: Elsevier, 2005. Kapitola Hexane, s. 522–525.
- ↑ Hardo Siegel; MANFRED EGGERSDORFER. Ullmann's Encyclopedia of Industrial Chemistry. 7th. vyd. [s.l.]: Wiley, 2007. Kapitola Ketones, s. 16.
- ↑ Wolfgang Dekant; SPIRIDON VAMVAKAS. Ullmann's Encyclopedia of Industrial Chemistry. 7th. vyd. [s.l.]: Wiley, 2007. Kapitola Toxicology, s. 23.
- ↑ http://www.prepchem.com/synthesis-of-2-5-hexanedione/ Primary: Systematic organic chemistry, by W. M. Cumming, 194, 1937.


