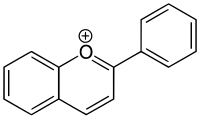
Pyryliové soli
| Pyrylium | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | pyrylium |
| Ostatní názvy | pyranium |
| Sumární vzorec | C5H5O+ |
| Identifikace | |
| Registrační číslo CAS | 289-67-8 |
| PubChem | 9548819 |
| ChEBI | 36120 |
| SMILES | [o+]1ccccc1 |
| InChI | InChI=1/C5H5O/c1-2-4-6-5-3-1/h1-5H/q+1 |
| Vlastnosti | |
| Molární hmotnost | 81,092 g/mol |
Některá data mohou pocházet z datové položky. | |
Pyrylium je kation se vzorcem C5H5O+, skládající se z šestičlenného cyklu tvořeného pěti atomy uhlíku, kde je na každý navázán jeden vodík, a jeden kladně nabitý trojvazný atom kyslíku. Vazby v uzavřeném řetězci vytvářejí konjugovaný systém, podobný jako u benzenu, čímž se ion stává aromatickým. Pyrilium patří mezi oniové ionty.
Soli
[editovat | editovat zdroj]Pyrylium a jeho deriváty tvoří stabilní soli s mnoha různými anionty.[1][2][3][4][5]
Chloristan pyrylia je rozpustný v acetonitrilu.
Chloristan trimethylpyrylia má teplotu tání 246-247 °C.
Tetrafluorboritan 2,4,6-trifenylpyrylia je žlutá pevná látka tající při 214 až 215 °C.
Stejné zbarvení vykazuje též chlorid 2-methyl-4,6-difenylpyryla, jenž má teplotu tání 125 až 126 °C.
Deriváty
[editovat | editovat zdroj]Mnoho významných kationtů je odvozeno od pyrylia nahrazením jednoho či více vodíkových atomů organickými funkčními skupinami. 2,4,6-trifenylpyrilium, nazývané také jako Katritzkého sůl, je součástí katalyzátorů řady překřížených párovacích reakcí.[6]
Chemické vlastnosti
[editovat | editovat zdroj]Podobně jako jiné oniové ionty je pyrylium v neutrálních vodných roztocích nestálé. Vyznačuje se ovšem výrazně nižší reaktivitou než běžné oxoniové ionty, což způsobuje aromatická stabilizace. 2,4,6-trifenylpyrylium často reaguje s alifatickými aminy za vzniku pyridiniových solí, čímž aminy aktivuje vůči oxidačním adičním reakcím s komplexy kovů, jako je nikl.[7]
Pyryliové kationty rovněž vstupují do reakcí s nukleofily v pozicích 2, 4, a 6, čímž spouštějí řadu dalších reakcí. Vysoká elektronegativita kyslíku způsobuje silné narušení cyklického řetězce.
Příprava
[editovat | editovat zdroj]Pyryliové soli lze snadno připravit kondenzačními reakcemi.
Soli obsahující aromatické substituenty, například tetrafluorboritan 2,4,6-trifenylpyrylia, je možné získat reakcemi dvou ekvivalentů acetofenonu s jedním ekvivalentem benzaldehydu za přítomnosti kyseliny tetrafluorborité a oxidačního činidla (tento postup se nazývá Diltheyova syntéza). Pyryliové soli s alkylovými skupinami, například ty odvozené od 2,4,6-trimethylpyrylia, se nejsnadněji připravují Balabanovou-Nenitzescuovou-Praillovou syntézou z terc-butanolu a acetanhydridu za přítomnosti kyseliny tetrafluorborité, chloristé nebo trifluormethansulfonové.[8][9] 2,4,6-trifenylpyryliové soli mohou být zásadami přeměněny na stabilní 1,5-endiony, ovšem obdobné produkty reakcí 2,4,6-trimethylpyryliových solí v horkých roztocích alkalických hydroxidů jsou nestabilní a dále se přeměňují vnitromolekulárními kondenzacemi na 3,5-dimethylfenoly. V teplé těžké vodě probíhá u 2,4,6-trimethylpyryliových solí izotopová výměna 4-methylových vodíků rychleji než na pozicích 2- a 6-, což dovoluje regioselektivně připravovat deuterované sloučeniny.
Reakce pyryliových solí s nukleofily z nich činí vhodné prekurzory dalších látek, které jsou více aromatické. Reakcemi s amoniakem vznikají pyridiny,[10] s primárními aminy pyridiniové soli, s hydroxylaminem pyridin-N-oxidy, s fosfiny fosforiny. Se sulfanem tvoří thiopyryliové soli a za přítomnosti acetonitrilu či nitromethanu dávají pyriliové soli deriváty benzenu.
Pyrony
[editovat | editovat zdroj]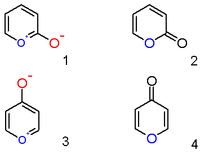
Pyriliový kation s navázaným hydroxylovým aniontem v pozici 2 není zwitteriontovou organickou sloučeninou (1), nýbrž neutrálním nenasyceným laktonem nebo 2-pyronem (pyran-2-onem) (2). Významnými zástupci této skupiny sloučenin jsou lumariny.
Obdobně jsou 4-hydroxylpyryliové sloučeniny 4-pyrony (pyran-4-ony) (4); sem patří například maltol.
Chemické vlastnosti
[editovat | editovat zdroj]
2-pyrony reagují s alkyny v Dielsových–Alderových reakcích za tvorby arenů a odštěpení oxidu uhličitého:[11]
Polycyklické pyryliové ionty
[editovat | editovat zdroj]Chromenyliové ionty
[editovat | editovat zdroj]Jeden bicyklický pyryliový ion se nazývá benzopyrylium (systematicky chromenylium), vzorec má C9H7O+. Lze ji považovat za nabitý derivát 2H-1-benzopyranu (2H-chromenu, C9H8O), nebo za nabitý substituovaný heterocyklický derivát naftalenu C10H8).
Flavyliové ionty
[editovat | editovat zdroj]V biologii se 2-fenylbenzopyryliový ion často nazývá flavylium. Ke sloučeninám odvozeným od tohoto iontu patří antokyanidiny a antokyaniny, barviva vytvářející barvy mnoha květů.
Naftoxanthenový kation
[editovat | editovat zdroj]Existují i vyšší polycyklické deriváty pyrylia, například naftoxantheniový kation. Jedná se o barvivo, které je velmi stabilní a jeho molekuly jsou aromatické. Absorbuje v oblasti ultrafialového záření a modrého světla a má neobvyklé fotofyzikální vlastnosti. Může být připraven chemickými nebo fotochemickými reakcemi.[12]
-
Benzopyryliumchlorid (chromenyliumchlorid), sůl chromenylia s chloridovým aniontem
-
Flavyliový kation
-
Naftoxanteniový kation
Odkazy
[editovat | editovat zdroj]Související články
[editovat | editovat zdroj]- Šestičlenné aromatické kruhy s jedním atomem uhlíku nahrazeným jinou skupinou: borabenzen, silabenzen, germabenzen, stannabenzen, pyridin, fosforin, arsabenzen, stibabenzen, bismabenzen, pyrylium, thiopyrylium, selenopyrylium, telluropyrylium
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Pyryliové soli na Wikimedia Commons
Obrázky, zvuky či videa k tématu Pyryliové soli na Wikimedia Commons
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Pyrylium salt na anglické Wikipedii.
- ↑ T. L. Gilchrist. Heterocyclic Chemistry. [s.l.]: [s.n.] ISBN 0-582-27843-0.
- ↑ A. T. Balaban; W. Schroth; G. Fischer. Pyrylium Salts. I. Synthesis. Advances in Heterocyclic Chemistry. 1969. DOI 10.1016/S0065-2725(08)60499-7.
- ↑ A. T. Balaban. New Trends in Heterocyclic Chemistry. [s.l.]: Elsevier, 1979. Dostupné online. ISBN 978-0-444-41737-4. Kapitola The Pyrylium Cation as a Synthon in Organic Chemistry, s. 79–111.
- ↑ A. T. Balaban. Organic Synthesis: Modern Trends. [s.l.]: Blackwell, 1987. Dostupné online. ISBN 0-632-02014-8. Kapitola Pyrylium Salts as Useful Synthons, s. 263–274.
- ↑ T. S. Balaban; A. T. Balaban. Hetarenes and Related Ring Systems, Six-membered Hetarenes with one Chalcogen. Stuttgart: Georg Thieme Verlag, 2003. ISBN 978-3-13-118641-6. Kapitola Pyrylium Salts, s. 11–200.
- ↑ A. T. Balaban; V. Wray. 13C n.m.r. spectra of some pyrylium salts and related compounds. Organic Magnetic Resonance. 1977. DOI 10.1002/mrc.1270090105.
- ↑ Yue Pang; Daniel Moser; Josep Cornella. Pyrylium Salts: Selective Reagents for the Activation of Primary Amino Groups in Organic Synthesis. Synthesis. 2020, s. 489. Dostupné online. DOI 10.1002/mrc.1270090105.
- ↑ BALABAN, A. T.; BOULTON, A. J. 2,4,6-Trimethyl-Pyrylium Tetrafluoroborate. Org. Synth.. 1973. Dostupné online.; Coll. Vol.. S. 1112–1113.
- ↑ BALABAN, A. T.; BOULTON, A. J. 2,4,6-Trimethyl-Pyrylium Trifluoromethanesulfonate. Org. Synth.. 1973. Dostupné online.; Coll. Vol.. S. 1114–1116.
- ↑ ANDERSON, A. G.; STANG, P. J. 2,6-Di-tert-Butyl-4-Methylpyridine. Org. Synth.. 1981, s. 34. Dostupné online.; Coll. Vol.. S. 144.
- ↑ P. M. Delaney; J. E. Moore; J. P. A. Harrity. An Alkynylboronic Ester Cycloaddition Route to Functionalised Aromatic Boronic Esters. Chemical Communications. 2006, s. 3323–3325. DOI 10.1039/b607322k.
- ↑ G. Bucher; R. Bresolí-Obach; C. Brosa; C. Flors; J. L. Luis; T. A. Grillo; S. Nonell. β-Phenyl quenching of 9-phenylphenalenones: a novel photocyclisation reaction with biological implications. Physical Chemistry Chemical Physics. 2014, s. 18813–18820. DOI 10.1039/C4CP02783C. Bibcode 2014PCCP...1618813B.