Fosfiny
Fosfiny jsou organické sloučeniny fosforu s obecným vzorcem PRnH3−n, kde R je organická skupina; jedná se o organické deriváty fosfanu (PH3).[1] Podle počtu organických substituentů n se dělí na primární (n = 1), sekundární (n = 2) a terciární fosfiny (n = 3). Všechny tyto skupiny zaujímají pyramidální struktury.[2]
Obecně jde o bezbarvé a lipofilní kapaliny či pevné látky.[3]
Rozdělení
[editovat | editovat zdroj]Fosfiny se dělí na skupiny podle počtu organických substituentů.
Primární fosfiny
[editovat | editovat zdroj]Primární fosfiny, RPH2, se obvykle připravují alkylacemi fosfanu. Jednoduché alkylové deriváty, jako například methylfosfin (CH3PH2), se získávají alkylacemi pomocí příslušných alkylů alkalických kovů, MPH2 (M = Li, Na nebo K). Dalším možným způsobem je reakce odpovídajícího chlorfosfinu s hydridem, například redukcí dichlorfenylfosfinu hydridem lithnohlinitým vzniká fenylfosfin (PhPH2).[4]

Primární (RPH2) a sekundární fosfiny (RRPH a R2PH) se za přítomnosti silných zásad (například hydroxidu draselného v dimethylsulfoxidu vážou na alkeny, přičemž tyto reakce probíhají podle Markovnikovova pravidla. Podobné reakce probíhají i u alkynů.[5]
Zásada není potřeba u alkenů a alkynů s nedostatkem elektronů, jako jsou deriváty akrylonitrilu.
Sekundární fosfiny
[editovat | editovat zdroj]Sekundární fosfiny, R2PH, se připravují podobně jako primární. Také je lze vytvořit redukčním štěpením triarylfosfinů pomocí alkalických kovů a následnou hydrolýzou vzniklého fosfidu; tímto způsobem se připravuje difenylfosfin (Ph2PH). Jiný postup spočívá v redukci difosfinových kyselin, R2P(O)OH, diisobutylaluminiumhydridem.
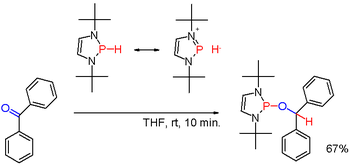
Sekundární fosfiny obvykle bývají protické, navázáním vhodných skupin, například u některých diazafosfolenů (viz obrázek 3), lze však polaritu vazby P-H obrátit a vzniklý fosfinhydrid může redukovat karbonylové skupiny, například u benzofenonu.[6]
Sekundární fosfiny se často vyskytují v cyklické podobě, jako tříčlenné (fosfirany a nenasycené (fosfireny), pětičlenné (fosfolany a nenasycené fosfoly a šestičlenné kruhy (fosfinany a fosforiny).
Terciární fosfiny
[editovat | editovat zdroj]Terciární fosfiny, R3P, se zpravidla připravují alkylacemi chloridu fosforitého Grignardovými a organolithnými činidly:
- 3 RMgX + PCl3 → PR3 + 3 MgX2
Při přípravě trimethylfosfinu se používá trifenylfosfit namísto silně elektrofilního PCl3:[7]
3 CH3MgBr + P(OC6H5)3 → P(CH3)3 + 3 C6H5OMgBr
Nesymetrické terciární fosfiny, R2R'P, se získávají jinými postupy, převážně prostřednictvím organofosforových nukleofilů; například difenylfosfid lithný se lehce methyluje jodmethanem na methyldifenylfosfin:
- LiP(C6H5)2 + CH3I → CH3P(C6H5)2 + LiI
Fosfan lze použít jako prekurzor některých terciárních fosfinů, získávaných z něj hydrofosfinačními reakcemi s alkeny, například za přítomnosti zásad jako katalyzátorů se PH3 navazuje na Michaelovy akceptory, jako je akrylonitril:[8]
- PH3 + 3 CH2=CHZ → P(CH2CH2Z)3 (Z = NO2, CN, C(O)NH2)
Terciární fosfiny typu PRR′R″ jsou P-chirální.
Z průmyslového lediska je nejvýznamnějším fosfinem trifenylfosfin, kterého se ročně vyrobí tisíce tun. Získává se reakcí chlorobenzenu s chloridem fosforitým a sodíkem.[9]
Fosfiny s určitými speciálními vlastnostmi se většinou připravují jinými způsoby.[10]
Di- a tripfosfiny
[editovat | editovat zdroj]
Difosfiny a trifosfiny také mohou být primární, sekundární či terciární.
Struktura
[editovat | editovat zdroj]Fosfiny mají, podobně jako fosfan, mají trigonálně pyramidové molekuly se symetrií přibližně typu C3v. Úhly vazeb C–P–C jsou přibližně 98,6°.[1] Velikost těchto úhlů odpovídá tomu, že fosfor vytváří vazby převážně prostřednictvím 3p orbitalů a jeho sp hybridizace je tak omezena. Volný elektronový pár trimethylfosfinu je tak převážně typu s, podobně jako u fosfanu, PH3.[11]
Pokud jsou organické substituenty terciárních fosfinů rozdílné, tak je příslušný fosfin chirální a konfiguračně stabilní (na rozdíl od NRR'R"). Komplexy chirálních fosfinů mohou katalyzovat enantioselektivní reakce.
Srovnání fosfinů a aminů
[editovat | editovat zdroj]Fosfiny jsou fosforovými analogy aminů, atom fosforu v nich má oxidační číslo −3 (σ3λ3). Podobně jako aminy mají fosfiny trigonálně pyramidální molekuly, pouze úhly C-E-C (E = N, P), přinejmenším za nepřítomnosti sterických efektů, jsou menší. Vazebný úhel C-P-C činí 98,6° u trimethylfosfinu a 109,7° při nahrazení methylových skupin terc-butylovými. Míru sterických efektů u terciárních fosfinových ligandů lze vyjádřit Tolmanovým úhlem. Bariéra pyramidální inverze je u fosfinů mnohem větší než u aminů a fosfiny se třemi různými substituenty tak lze rozdělit na tepelně stálé optické izomery. Fosfiny bývají slabšími zásadami než odpovídající aminy, například fosfoniový kation má pKa −14 a amonný kation 9,21; u trimethylfosfonia činí pKa 8,65 a u trimethylamonia 9,76. Trifenylfosfin (pKa 2,73) je ovšem zásaditější než trifenylamin (pKa −5), protože volný elektronový pár na dusíku NPh3 je částečně delokalizovaný mezi fenylové kruhy. Přestože je u pyrrolu volný pár dusíku delokalizován, tak u atomu fosforu ve fosfolu není. Reaktivita fosfinů je podobná jako u aminů , s ohledem na nukleofilitu ipři tvorbě fosfoniových solí (PR4+X−). Tato vlastnost se využívá v Appelových reakcích k přeměně alkoholů na halogenalkany. Fosfiny se snadno oxidují na fosfinoxidy, zatímco obdobné oxidace aminů jsou obtížnější. Tato reaktivita je jednou z příčin vzácnosti fosfinů v přírodě.
Reakce
[editovat | editovat zdroj]Tvorba komplexů
[editovat | editovat zdroj]Terciární fosfiny se často používají jako ligandy v koordinační chemii. Fosfiny se navazují na kovy, které přitom slouží jako Lewisovy kyseliny, například chlorid stříbrný reaguje s trifenylfosfinem za vzniku 1:1 a 1:2 komplexů:
- PPh3 + AgCl → ClAgPPh3
- PPh3 + ClAgPPh3 → ClAg(PPh3)2
Produkty reakcí fosfinů s borany mají využití jako reaktanty, které jsou na vzduchu stálé, ale boranové chránicí skupiny lze odstranit působením aminů.[12][13]
Kvaternizace
[editovat | editovat zdroj]Fosfiny se snadno alkylují, například brommethan přeměňuje trifenylfosfin na kvartérní sůl methyltrifenylfosfoniumbromid:
- PPh3 + CH3Br → [CH3PPh3+]Br−
Fosfiny fungují jako nukleofilní katalyzátory v některých organických syntézách, jako jsou Rauhutova–Currierova a Baylisova-Hillmanova reakce.
Protonace a deprotonace
[editovat | editovat zdroj]Fosfiny mohou být, snadněji než fosfan, protonovány; reakce jsou vratné. Zatímco fosfiny jsou citlivé na přítomnost kyslíku, tak jejich protonované obdoby nejsou.
Primární a sekundární fosfiny lze deprotonovat silnými zásadami na fosfidy. Difenylfosfin reaguje s organolithními sloučeninami za tvorby difenylfosfidu lithného:
- HPPh2 + RLi → LiPPh2 + RH
Oxidace a sulfidace
[editovat | editovat zdroj]Terciární fosfiny se oxidují na fosfinoxidy, R3PO. Reakce s kyslíkem je brzděna spinem, ovšem stále probíhá dostatečně rychle a vzorky terciárních fosfinů tak obsahují příměsi fosfinoxidů. U trialkylových fosfinů je oxidace rychlejší než u triarylových. Oxidaci je možné urychlit peroxidem vodíku. Primární a sekundární fosfiny se také oxidují, ovšem produkty podléhají tautomerizaci a další oxidaci.
Terciární fosfiny také mohou vytvářet fosfinsulfidy.
Redukční vlastnosti organofosfinů se také projevují ve Staudingerových reakcích, přeměňujících organické azidy na aminy, a v Micunobovových reakcích, kde se mění alkoholy na estery. V těchto procesech se trojmocný fosfor v molekule fosfinu oxiduje na pětimocný. Fosfiny mohou být také použity na redukce aktivovaných karbonylových sloučenin, například α-ketoesterů na α-hydroxyester (viz obrázek 2).[14]
V předpokládaném reakčním mechanismu se na začátku odštěpuje proton z methylové skupiny trimethylfosfinu (trifenylfosfin nereaguje).

Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Organophosphine na anglické Wikipedii.
- ↑ a b Annette Schier and Hubert Schmidbaur"P-Donor Ligands" in Encyclopedia of Inorganic Chemistry 2006, Wiley-VCH, Weinheim. DOI:10.1002/0470862106.ia177
- ↑ Paul C. J. Kamer; Piet W. N. M. van Leeuwen. Phosphorus(III)Ligands in Homogeneous Catalysis: Design and Synthesis. [s.l.]: [s.n.], 2012. ISBN 978-0-470-66627-2.
- ↑ G. M. Kosolapoff; L. Maier. Organic Phosphorus Compounds, Volume 1. New York: John Wiley, 1972.
- ↑ Rachel M. Hiney; Lee J. Higham; Helge Müller-Bunz; Declan G. Gilheany. Taming a Functional Group: Creating Air-Stable, Chiral Primary Phosphanes. Angewandte Chemie International Edition. 2006, s. 7248–7251. DOI 10.1002/anie.200602143. PMID 17022105.
- ↑ S. N. Arbuzova; N. K. Gusarova; B. A. Trofimov. Nucleophilic and free-radical additions of phosphines and phosphine chalcogenides to alkenes and alkynes. Arkivoc. 2006, s. 12–36. DOI 10.3998/ark.5550190.0007.503.
- ↑ S. Burck; D. Gudat; M. Nieger; W.-W. Du Mont. P-Hydrogen-Substituted 1,3,2-Diazaphospholenes: Molecular Hydrides. Journal of the American Chemical Society. 2006, s. 3946–3955. DOI 10.1021/ja057827j. PMID 16551102.
- ↑ M. L. Leutkens; A. P. Sattelberger; H. H. Murray; J. D. Basil; J. P. Fackler. Trimethylphosphine. Inorganic Syntheses. 1990, s. 305–310. ISBN 9780470132593. DOI 10.1002/9780470132593.ch76.
- ↑ Boris A. Trofimov; Svetlana N. Arbuzova; Nina K. Gusarova. Phosphine in the Synthesis of Organophosphorus Compounds. Russian Chemical Reviews. 1999, s. 215–227. DOI 10.1070/RC1999v068n03ABEH000464. Bibcode 1999RuCRv..68..215T.
- ↑ Jürgen Svara; Norbert Weferling; Thomas Hofmann. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2006. ISBN 978-3527306732. DOI 10.1002/14356007.a19_545.pub2. Kapitola Phosphorus Compounds, Organic.
- ↑ J. H. Downing; M. B. Smith. Phosphorus Ligands. Comprehensive Coordination Chemistry II. 2003, s. 253–296. ISBN 9780080437484. DOI 10.1016/B0-08-043748-6/01049-5.
- ↑ E. Fluck, The Chemistry of Phosphine, Topics in Current Chemistry Vol. 35, 64 pp, 1973.
- ↑ Carole Alayrac; Sami Lakhdar; Ibrahim Abdellah; Annie-Claude Gaumont. Recent Advances in Synthesis of P-BH3 Compounds. Topics in Current Chemistry. 2014, s. 1–82. ISBN 978-3-319-15511-1. DOI 10.1007/128_2014_565.
- ↑ Jean Michel Brunel; Bruno Faure; Michel Maffei. Phosphane–Boranes: Synthesis, Characterization and Synthetic Applications. Coordination Chemistry Reviews. 1998, s. 665–698. DOI 10.1016/S0010-8545(98)00072-1.
- ↑ W. Zhang; M. Shi. Reduction of activated carbonyl groups by alkyl phosphines: formation of α-hydroxy esters and ketones. Chemical Communications. 2006, s. 1218–1220. DOI 10.1039/b516467b. PMID 16518496.

