Hybridizace orbitalů

Hybridizace orbitalů je proces energetického sjednocení původně energeticky nerovnocenných atomových orbitalů. Celková energetická hladina orbitalů se však po hybridizaci nezmění a je tedy zachováno energetické těžiště orbitalů. Tyto orbitaly se nazývají hybridní orbitaly.
Obvykle hybridní orbitaly vznikají z atomových orbitalů srovnatelných energií. Proto přednostně do hybridizace vstupují ty orbitaly (s,p,d,f), které jsou na nižší energetické hladině, ale na stejné elektronové vrstvě (n).
Většinou se do hybridizace zapojují pouze elektrony z valenční vrstvy, které poskytují své elektrony k vytvoření kovalentních σ-vazeb. Například u atomu uhlíku, který má čtyři valenční elektrony umístěné v orbitalech 2s a 2p, může dojít ke třem typům hybridizace sp, sp2 nebo sp3. Teorie hybridizace tak vysvětluje vazbu v alkanech, alkenech a alkynech. Každá z těchto hybridizací má jiné geometrické uspořádání:
- sp - lineární
- sp2 - trigonální
- sp3 - tetraedrické
Historie[editovat | editovat zdroj]

V roce 1931 Linus Pauling (1901 -1994) vyvinul teorii hybridizace orbitalů, aby vysvětlil strukturu jednoduchých molekul pomocí atomových orbitalů. Zabýval se nejjednodušší sloučeninou uhlíku - methanem CH4. Věděl, že atom uhlíku tvoří čtyři vazby pomocí jednoho s a tří p orbitalů. Předpokládal tedy, že atom uhlíku vytvoří tři vazby v pravém úhlu (pomocí p orbitalů) a čtvrtou slabší vazbu (pomocí orbitalu s) v jiném směru. Ve skutečnosti má methan čtyři stejné vazby C-H a mezi nimi je čtyřstěnný vazebný úhel 109,5°. Pauling z toho usoudil, že v přítomnosti čtyř atomů vodíku se z orbitalů uhlíku s a p vytvoří čtyři stejné hybridní orbitaly, které označil sp3. Podle něj hybridní orbital vzniká lineární kombinací vlnových funkcí základních atomových orbitalů.
Tento koncept byl vyvinut pro jednoduché sloučeniny, ale později byl aplikován i na složitější organické struktury. Poskytuje tak jednoduchý orbitální obraz, který je ekvivalentní Lewisovým strukturám, jejichž objevitelem je Gilbert Newton Lewis (1875 -1946). Jack Edward Baldwin (1938 - 2020) formuloval na základě teorie hybridizace Baldwinova pravidla pro organické cyklické sloučeniny. Pomocí teorie hybridizace orbitalů lze vysvětlit geometrii vzniklé molekuly a její vazebné vlastnosti. Tvar molekuly totiž odpovídá tvaru hybridních atomových orbitalů. V současnosti je teorie hybridizace orbitalů součástí teorie valenčních vazeb a nedílnou součástí organické chemie.
Postup hybridizace orbitalů[editovat | editovat zdroj]
Pro vznik hybridizace je důležitá excitace atomu, ke které může dojít například srážkou s jinou částicí, ozářením nebo teplem. Rozdíl mezi základním a excitovaným stavem atomu:
- Atom je v základním stavu, pokud se elektrony v elektronovém obalu nacházejí v orbitalech ve stavu s nejnižší možnou energií.
- Atom je v excitovaném stavu, pokud se jeden nebo více elektronů nacházejí v orbitalech s vyšší energií, než mají v základním stavu.
Například elektronová konfigurace sp3 excitovaného stavu atomu uhlíku znamená, že obsahuje 4 excitované elektrony - 1 nespárovaný valenční elektron v orbitalu 2s a tři nespárované valenční elektrony v orbitalu 2p. Tyto elektrony jsou navíc rovnocenné, neboť po excitaci dojde k energetickému sjednocení orbitalů - hybridizaci orbitalů. To mimo jiné vysvětluje, proč uhlík vytváří 4 chemické vazby ve sloučeninách.
| Hybridizace sp3 atomu uhlíku | ||
|---|---|---|
| Základní stav atomu uhlíku C | V základním stavu má atom uhlíku C pouze 2 nepárové elektrony. | |
| Excitovaný stav atomu uhlíku C | Pohlcením energie přejde elektron z orbitalu 2s do energeticky vyššího orbitalu 2p. | |
| Hybridizovaný stav atomu uhlíku C | Energie orbitalů 2s a 2p je blízká a dovoluje sjednocení – hybridizaci. Místo jednoho orbitalu s a tří orbitalů p vznikají čtyři sp³ hybridní orbitaly. | |
| Tvar hybridizovaných orbitalů sp3 |  |
Hybridizací se změní tvar orbitalů uhlíku. Vznikne čtyřstěn (tetraedr) s rovnocennými orbitaly sp3. |
| Tvar molekuly methanu | 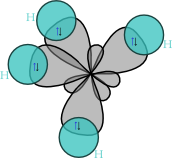
|
Při reakci uhlíku s vodíkem dochází k překryvu orbitalů sp3 (C) a 1s (H) za vzniku kovalentní vazby σ. Vzniká molekula methanu. |
Typy hybridizace orbitalů[editovat | editovat zdroj]
Hybridizace orbitalů je proces energetického sjednocení původně energeticky nerovnocenných atomových orbitalů. Hybridizace tak vysvětluje vznik rovnocenných kovalentních vazeb z energeticky rozdílných orbitalů a umožňuje předpovědět strukturu nově vzniklých molekul, protože každý typ hybridizace charakterizuje určité rozmístění hybridních orbitalů v prostoru. Hybridní orbitaly se označují podle toho, z jakých orbitalů vznikly:
sp3 hybridizace[editovat | editovat zdroj]

Této hybridizace se účastní jeden orbital s a tři orbitaly p. Osy čtyř vzniklých hybridních orbitalů směřují do vrcholů čtyřstěnu (tetraedru, pravidelného trojbokého jehlanu) a svírají navzájem úhel 109,5o. Vznikají tak 4 orbitaly, které jsou všechny stejné, jen jinak orientované v prostoru. Tato hybridizace nastává u sloučenin, kde má uhlík čtyři jednoduché σ-vazby (sigma-vazby).
sp2 hybridizace[editovat | editovat zdroj]

Této hybridizace se účastní jeden orbital s a dva orbitaly p. Osy tří hybridních orbitalů směřují k vrcholům pravidelného rovnostranného trojúhelníku (trigonální tvar) a svírají navzájem úhel 120o. Molekuly s tímto druhem hybridizace jsou rovinné, neboť jejich atomy leží v rovině. Tato hybridizace nastává u sloučenin, kde má uhlík dvě jednoduché σ-vazby a jednu dvojnou vazbu, která je tvořena jednou σ-vazbou a jednou π-vazbou (pí-vazbou).
Dvojnou vazbu tak kromě hybridizovaných orbitalů zajišťují překryvy nehybridizovaných p orbitalů. Vazba σ probíhá přímo mezi středy daných atomů a vazba π prochází mimo spojnici středů atomů.
sp hybridizace[editovat | editovat zdroj]

Této hybridizace se účastní jeden orbital s a jeden orbital p. Osa dvou hybridních orbitalů má tvar úsečky a molekula má tedy lineární tvar s úhlem 180o. Tato hybridizace nastává u sloučenin, kde má uhlík jednu jednoduchou σ-vazbu a jednu trojnou vazbu, která je tvořena jednou σ-vazbou a dvěma π-vazbami.
Trojná vazba je tvořená jednou σ-vazbou přímo mezi středy daných atomů a dvěma π-vazbami, které procházejí mimo spojnici středů. Trojnou vazbu tak kromě hybridizovaných orbitalů zajišťují i překryvy nehybridizovaných p orbitalů. Orbitaly násobných vazeb jsou v prostoru uspořádány tak, aby se co nejméně navzájem ovlivňovaly.
sp3d hybridizace[editovat | editovat zdroj]

Této hybridizace se účastní jeden orbital s, tři orbitaly p a jeden orbital d. V tomto případě vzniká pět hybridních orbitalů, z nichž tři leží v rovině centrálního atomu (jejich osy svírají navzájem úhel) a dva jsou na tuto rovinu kolmé. Molekula má tvar pravidelného trojbokého dvojjehlanu.
sp3d2 hybridizace[editovat | editovat zdroj]
Této hybridizace se účastní jeden orbital s, tři orbitaly p a dva orbitaly d. V tomto případě vzniká šest rovnocenných hybridních orbitalů, jejichž osy směřují do vrcholů pravidelného čtyřbokého dvojjehlanu.
Přehled geometrických tvarů hybridizovaných molekul[editovat | editovat zdroj]
| Typ hybridizace | Geometrie molekuly | Vazebný úhel | Příklad |
|---|---|---|---|
| sp | lineární tvar | 180° | Oxid uhličitý |
| sp2 | rovnostranný trojúhelník | 120° | Fluorid boritý |
| sp3 | tetraedr (pravidelný trojboký jehlan) | 109,5° | Methan |
| sp³d | hexaedr (trojboká dipyramida - rovnostranný trojúhelník a z něj jedna vazba nahoru a jedna dolů) | 90°, 120° | Fluorid fosforečný |
| sp³d² | oktaedr (osmistěn, jehož stěny tvoří 8 stejných rovnostranných trojúhelníků) | 90° | Fluorid sírový |
Chemická vazba[editovat | editovat zdroj]
Atomy vstupují do chemické vazby, pokud tím sníží svoji energii a dosáhnou zaplnění všech valenčních orbitalů elektronovými páry (oktetové pravidlo) . U kovalentních vazeb, které jsou charakteristické sdílením valenčních elektronů, jsou využívány hybridizované orbitaly.
Počet elektronových párů sdílených mezi atomy charakterizuje řád vazby:
- Jednoduchá vazba je tvořena sdílením jednoho elektronového páru (například v alkanech, v molekule ethanu ji tvoří σ-vazby)
- Dvojná vazba je tvořena sdílením dvou elektronových párů (například v alkenech, v molekule ethen ji tvoří jedna σ- a jedna π-vazba).
- Trojná vazba je tvořena sdílením tří elektronových párů (například v alkynech, v molekule ethynu ji tvoří jedna σ- a dvě π-vazby).
Související články[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byly použity překlady textů z článků Hybridorbital na německé Wikipedii a Orbital hybridisation na anglické Wikipedii.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu hybridizace orbitalů na Wikimedia Commons
Obrázky, zvuky či videa k tématu hybridizace orbitalů na Wikimedia Commons












