Volný elektronový pár

Volný elektronový pár je dvojice valenčních elektronů, které nevytvářejí kovalentní vazbu s dalším atomem.[1] Součet počtu elektronů ve volných párech a elektronů vytvářejících vazbu je tak roven počtu valenčních elektronů daného atomu.
Volné páry se využívají v teorii VSEPR k vysvětlení tvarů molekul. Využití mají také v Lewisově teorii kyselin a zásad.
Některé dvojice nevazebných elektronů se neřadí mezi volné páry, například u přechodných kovů neovlivňují nevazebné páry molekulovou geometrii a považují se za stereochemicky nečinné. V teorii molekulových orbitalů se volné páry často neuvažují, protože souvislosti mezi orbitaly a složkami Lewisovské struktury často nejsou zjevné; jako volné elektronové páry se ale často označují obsazené nevazebné orbitaly.
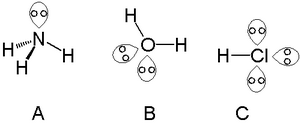
Jeden volný elektronový pár mívají atomy ze skupiny dusíku, například dusík v amoniaku. Dva se vyskytují u chalkogenů, jako je kyslík v molekule vody. Halogeny mohou mít, jako například chlor v chlorovodíku, tři volné páry.
Vliv na vazebné úhly
[editovat | editovat zdroj]
Volné elektronové páry často vykazují zápornou polaritu a nacházejí se blíže k atomovému jádru než vazebné elektrony. Přítomnost volného páru zmenšuje úhel vazby mezi vazebnými elektrony, jejichž náboj způsobuje odpuzování mezi elektrony. Volné páry se také podílejí na tvorbě koordinačně-kovalentních vazeb, například při rozpouštění kyselin ve vodě vznikají hydroniové ionty (H3O+) dodáváním volných elektronových párů kyslíku vodíkovým kationtům.
U oxidu uhličitého (CO2), který nemá volný elektronový pár na centrálním atomu, se atomy kyslíku navazují na opačné strany uhlíkového atomu, zatímco u vody (H2O), obsahující dva volné páry na centrálním atomu, činí úhel mezi atomy vodíku 104,5°, což je způsobeno odpuzováním dvou volných elektronových párů kyslíku, které zvětšuje vzdálenost atomů vodíku až do dosažení rovnováhy.
Dipólové momenty
[editovat | editovat zdroj]Volné elektronové páry mohou ovlivňovat dipólové momenty molekul. Amoniak má dipólový moment 1,42 D. Protože je elektronegativita dusíku (3,04) větší než u vodíku (2,2), tak jsou vazby N-H polární, s částečným záporným nábojem na dusíku a menšími kladnými náboji na atomech vodíku. Dipól vytváří také volný elektronový pár, který tak zesiluje polaritu vazeb N-H a navyšuje dipólový moment molekuly; fluorid dusitý má mnohem menší dipólový moment 0,234 D. Fluor je elektronegativnější než dusík a polarita vazby N-F má tak opačný směr než N-H u amoniaku, a volný pár jej zeslabuje.
Stereogenní volné páry
[editovat | editovat zdroj]
|
⇌ | 
|
| Stereoizomery obecného aminu , s dusíkovým stereocentrem | ||
Volné páry mohou umožňovat chiralitu molekul, ve kterých jsou zbylé tři navázané skupiny navzájem odlišné. Tento jev se vyskytuje u aminů, fosfinů,[2] sulfoniových a oxoniových iontů, sulfoxidů, a karboaniontů.
Rozlišení enantiomerů s aminovým stereocentrem je zpravidla neproveditelné, protože aktivační energie dusíkové inverze bývá nízká, což i za pokojové teploty způsobuje rychlé přechody mezi oběma formami. Rozlišení lze provést u sloučenin s aminovými skupinami zablokovanými v cyklických molekulách (jako je například Trögerova zásada).
Neobvyklé volné páry
[editovat | editovat zdroj]Stereochemicky aktivní volné páry mohou vytvářet také dvouvazné ionty olova a cínu, které disponují elektronovými konfiguracemi ns2; toto uspořádání v pevném skupenství vytváří narušené čtverečné krystalové struktury u PbO i SnO.
Vznik ns2 volných párů u těchto kovů byl původně připisován vnitroatomární hybridizaci orbitalů s a p,[3] ale ukázalo se, že silně závisí na aniontu.[4] Tato závislost vysvětluje, proč některé sloučeniny dvouvazného olova a cínu, například PbS a SnTe nevykazují přítomnost volných elektronových párů a mají symetrickou strukturu odpovídající NaCl.[5][6]
Volné páry v molekulách mohou také narušovat koordinaci ligandů okolo iontů kovů. U olova byla taková narušení pozorována v komplexech dusičnanu olovnatého a v roce 2007 nyla vydána studie přisuzující volným párům vliv na otravy olovem.[7] Olovnaté ionty mohou nahradit ty původní u některých důležitých enzymů, například zinečnaté ionty v dehydratáze kyseliny delta-aminolevulové, zapojené do syntézy hemu, složky hemoglobinu. Tato inhibice syntézy hemu je molekulární podstatou otravy olovem.[8][9][10]
Výpočetními studiemi bylo zjištěno, že koordinační čísla se nahrazením vápenatých iontů v bílkovinách nezmění, a navázání olova tak mění způsob, jakým ligandy uspořádávají vznikající volné elektronové páry, což naruší funkci těchto bílkovin. Tento jev je výrazný u bílkovin navazujících zinek, kde zcela znemožňují navázání obvyklého substrátu a vyvolávají tak inhibici.
U prvků 14. skupiny se může přítomnost volných párů elektronů projevit prodloužením jednoduchých[11] i trojných vazeb.[12][13]
Alkyny obsahují trojné vazby uhlík-uhlík (řád vazby 3) a mají lineární geometrii s vazebnými úhly 180°;[14] odpovídající sloučeniny následujících prvků skupiny (křemíku, germania, a cínu), mají formálně trojné vazby s efektivními řády 2, kde jeden volný pár[14] má trans-ohnutou geometrii. V případě olova je tato vazba efektivně jednoduchá, kde jsou takto vychýlené dva volné páry každého atomu olova[14]. U organogermaniové sloučeniny je efektivní řád vazby také 1.[14][15]

Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Lone pair na anglické Wikipedii.
- ↑ lone (electron) pair
- ↑ Quin, L. D. (2000). A Guide to Organophosphorus Chemistry, ISBN 0471318248
- ↑ Stereochemistry of Ionic Solids; J. D.Dunitz, L. E.Orgel, Advances in inorganic chemistry and radiochemistry 1960, 2, 1–60
- ↑ D. J. Payne. Electronic Origins of Structural Distortions in Post-Transition Metal Oxides: Experimental and Theoretical Evidence for a Revision of the Lone Pair Model. Physical Review Letters. 2006, s. 157403. Dostupné online. DOI 10.1103/PhysRevLett.96.157403. PMID 16712195. Bibcode 2006PhRvL..96o7403P.
- ↑ Aron Walsh. The origin of the stereochemically active Pb(II) lone pair: DFT calculations on PbO and PbS. Journal of Solid State Chemistry. 2005, s. 1422-1428. DOI 10.1016/j.jssc.2005.01.030. Bibcode 2005JSSCh.178.1422W.
- ↑ Aron Walsh. Influence of the Anion on Lone Pair Formation in Sn(II) Monochalcogenides: A DFT Study. The Journal of Physical Chemistry B. 2005, s. 18868-18875. DOI 10.1021/jp051822r. PMID 16853428.
- ↑ Christophe Gourlaouen; Olivier Parisel. Is an Electronic Shield at the Molecular Origin of Lead Poisoning? A Computational Modeling Experiment. Angewandte Chemie International Edition. 2007-01-15, s. 553-556. DOI 10.1002/anie.200603037. PMID 17152108.
- ↑ E. K. Jaffe; J. Martins; J. Li; J. Kervinen; R. L. Dunbrack. The Molecular Mechanism of Lead Inhibition of Human Porphobilinogen Synthase. Journal of Biological Chemistry. 2000-10-13, s. 1531-1537. DOI 10.1074/jbc.M007663200. PMID 11032836.
- ↑ Franco Scinicariello; H. Edward Murray; Daphne B. Moffett; Henry G. Abadin; Mary J. Sexton; Bruce A. Fowler. Lead and δ-Aminolevulinic Acid Dehydratase Polymorphism: Where Does It Lead? A Meta-Analysis. Environmental Health Perspectives. 2006-09-15, s. 35-41. DOI 10.1289/ehp.9448. PMID 17366816.
- ↑ Namrata Chhabra. Effect of Lead poisoning on heme biosynthetic pathway [online]. 2015-11-15 [cit. 2016-10-30]. Dostupné v archivu pořízeném z originálu dne 2016-04-03.
- ↑ Anne F. Richards; Marcin Brynda; Philip P. Power. Effects of the alkali metal counter ions on the germanium–germanium double bond length in a heavier group 14 element ethenide salt. Chemical Communications. S. 1592-1593. DOI 10.1039/B401507J. PMID 15263933.
- ↑ Philip P. Power. π-Bonding and the Lone Pair Effect in Multiple Bonds between Heavier Main Group Elements. Chemical Reviews. 1999, s. 3463-3504. DOI 10.1021/cr9408989. PMID 11849028.
- ↑ Vladimir Ya. Lee; Akira Sekiguchi. Organometallic Compounds of Low-Coordinate Si, Ge, Sn, and Pb: From Phantom Species to Stable Compounds. [s.l.]: John Wiley & Sons, 2011-07-22. ISBN 978-1-119-95626-6. S. 23.
- ↑ a b c d Geoffrey H. Spikes; Philip P. Power. Lewis base induced tuning of the Ge–Ge bond order in a "digermyne". Chemical Communications. 2007, s. 85-87. DOI 10.1039/b612202g. PMID 17279269.
- ↑ Philip P. Power. Silicon, germanium, tin, and lead analogues of acetylenes. Chemical Communications. 2003, s. 2091-2101. DOI 10.1039/B212224C. PMID 13678155.
