Hofmannova–Löfflerova reakce
Hofmannova–Löfflerova reakce (též nazývaná Hofmannova–Löfflerova–Freytagova reakce, Löfflerova–Freytagova reakce, nebo Löfflerova–Hofmannova reakce) je organická reakce vytvářející cyklický amin 2 (většinou pyrrolidin, někdy piperidin) tepelným nebo fotochemickým rozkladem N-halogenovaného aminu 1 za přítomnosti silné kyseliny (koncentrované H2SO4 nebo CF3COOH). Probíhá přes vnitromolekulární přenos vodíku na dusíkatý radikál.[1]

Historie[editovat | editovat zdroj]
V roce 1878, kdy ještě struktura piperidinu nebyla známa, se August Wilhelm von Hofmann[2] pokusil prokázat přítomnost nenasycené vazby v jeho molekule přidáváním chlorovodíku a bromu (tyto reakce se běžně používají na důkaz přítomnosti alkenů). Během této studie získal několik N-halogenaminů a N-halogenamidů a prozkoumal jejich reakce v kyselých i zásaditých prostředích.[3][4] Popsal také reakci 1-brom-2-propylpiperidinu (3) s horkou kyselinou sírovou, kde po následném přidání zásady vznikl terciární amin,[5][6] který byl později identifikován jako δ-konecein (4).[7]

Přestože se Hofmannova–Löfflerova–Freytagova reakce stala často používaným způsobem přípravy pyrrolidinů, tak následujících 25 let nebyl popsán další její příklad. V roce 1909 K. Löffler a C. Freytag rozšířili spektrum substrátů na jednoduché sekundární aminy a dokázali pomocí ní připravit nikotin (6) z N-brom-N-methyl-4-(pyridin-3-yl)butan-1-aminu (5).[8][9][10]

Mechanismus[editovat | editovat zdroj]
Mechanistické studie[editovat | editovat zdroj]
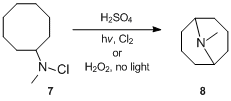
Reakce byla popsána už v roce 1883, ale podrobnosti ohledně mechanismu se podařilo zjistit až koncem 50. let 20. století. Mechanismus Hofmannovy–Löfflerovy reakce poprvé zkoumal S. Wawzonek, který se věnoval výzkumu cyklizací N-halogenovaných aminů.[11][12][13] V roce 1948 zjistil, že roztok N-chlor-N-methylcyklooktylaminu 7 v kyselině sírové za přítomnosti chloru nebo peroxidu vodíku působením ultrafialového záření vytváří N-methylgranatinin 8 s 24% výtěžností, což je mnohem více než za nepřítomnosti ultrafialového záření nebo peroxidu.[11] Na základě tohoto pozorování bylo navrženo, že jde o radikálovou řetězovou reakci. N-chloramin je protonován kyselinou a následně se homolytiky štěpí na amoniové a chloridové radikály. Amonný radikál vnitromolekulárně odštěpí stericky výhodný atom vodíku za vzniku alkylového radikálu, který oddělí chlorid z dalšího N-chloramoného iontu za tvorby alkylchloridu a nového amonného radikálu. Alkylchlorid se nakonec působením zásady cyklizuje a vytvoří cyklický terciární amin.[14]
Elias James Corey provedl podrobnější mechanistickou studii, v které zkoumal stereochemii, izotopový efekt vodíku, iniciaci, inhibici, katalýzu, selektivitu přenosu vodíku a meziprodukty.[15] Výsledky byly v souladu s radikálovým mechanismem zahrnujícím vnitromolekulární přenos vodíku jako součást propagace.
Stereochemie[editovat | editovat zdroj]
Za účelem zjištění, jestli nahrazení vodíku při cyklizaci N-halogenaminů zachovává či obrací konfiguraci, případně vytváří rovnováhu mezi těmito možnostmi, byl připraven deuterovaný amin 9. Chlorací sloučeniny 9 a následným tepelným rozkladem jejího N-chlorovaného derivátu 10 v kyselině sírové při 90 °C vznikal opticky neaktivní 1,2-dimethylpyrrolidin. Tento výsledek byl silným důkazem průběhu přes meziprodukt obsahující sp2-hybridizovaný δ-uhlík.

Izotopový efekt[editovat | editovat zdroj]
Izotopový efekt na δ-H při rozkladu 10 byl zkoumán analýzou směsi 1,2-dimethylpyrrolidinu 11 a 1,2-dimethylpyrrolidin-2-d 12 z hlediska obsahu deuteria. Spálením směsi deuterovaného a nedeuterovaného 1,2-dimethylpyrrolidinu byla získána hodnota 0,78 atomů deuteria na molekulu, čemuž odpovídal izotopový efekt (kH/kD) 3,54; ověřena byla nezávislým průzkumem založeným na srovnání intenzity infračervených absorpcí souvisejících s natahováním vazeb C-D u směsi 1,2-dimethylpyrrolidinů a u čistého 1,2-dimethylpyrrolidinu-2-d 12; touto analýzou byla získána hodnota kH/kD 3,42. Také studie zabývající se určením kH/kD pro cyklizaci na primárním uhlíku poskytovaly kH/kD>>1, v souladu s předpokladem, že v meziproduktu msjí významný podíl vazby C-H.
Iniciace, inhibice, katalýza[editovat | editovat zdroj]
N-chlordi-n-butylamin je za nepřístupu světla stabilní v 85% H2SO4 o teplotě 25 °C, ale po ozáření ultrafialovým zářením mizí. Reakce má indukční periodu trvající asi 12 minut, která se ale v dusíkové atmosféře téměř neobjevuje; za nepřítomnosti kyslíku probíhají fotochemické rozklady N-halogenaminů rychleji. Tato poznání naznačují, že molekulární kyslík reakci inhibuje.
Přidání katalytických množství železnatých solí do roztoku dibutylchloramin v H2SO4 také vedlo k likvidaci chloraminu; posléze byl izolován N-butylpyrrolidin. Tento výsledek ukazuje, že rozklad chloraminu je radikálovou reakcí iniciovanou Fe2+.
Rychlost ultrafialově katalyzovaného rozkladu dibutylchloraminu a výtěžek vytvořeného pyrrolidinu silně závisí na kyselosti reakčního prostředí – při zvýšení koncentrace kyseliny byly pozorovány rychlejší reakce, poskytující vyšší výtěžky.
Významnou otázkou ohledně podílu kyseliny na reakci je, zda N-haloamin reaguje jako volná zásada, nebo jako sůl. Na základě hodnot pKa konjugovaných kyselin sekundárních alkylaminů (obvykle se pohybujících mezi 10 a 11) je zřejmé, že N-chloraminy se při vysokých koncentracích kyseliny sírové vyskytují převážně jako soli, a zdrojem amonného radikálu je tak N-chloramonný kation. Po ozáření ultrafialovým zářením dochází k jeho absorpci, kdy se štěpí vazby N-Cl. Konjugované kyseliny N-chloraminů nemají žádnou významnou absorpci na vlnových délkách převyšujících 225 nm, zatímco volné N-chloraminy dobře absorbují vlnové délky schopné tohoto štěpení (λmax = 263 nm, εmax = 300 nm);[16] E. J. Corey navrhl, že v takovýchto případech je za většinu iniciací zodpovědné malé množství vytvořených N-chloraminů. Nově vytvořené neutrální dusíkaté radikály jsou okamžitě protonovány; pokud je reakce iniciována ultrafialovým zářením, tak může ale probíhat i jinak, kdy N-halogenaminový radikál není zářením rozkládán, ale působí jako fotosenzibilizátor.
Rostoucí koncentrace kyseliny snižuje rychlost iniciace, urychluje propagaci a/nebo zpomaluje terminaci. Byl zkoumán vliv některých kyselých rozpouštědel na fotolytické Hofmannovy–Löfflerovy–Freytagovy reakce.[17]
Meziprodukty[editovat | editovat zdroj]
Izolací 4-chlordibutylaminu vzniklého z dibutylchloraminu v H2SO4 byla potvrzena tvorba δ–chloraminových meziproduktů.[13] Přidání zásady způsobuje cyklizaci δ–chloraminu na cyklický amin a chloridový ion.
Selektivita přenosu vodíku[editovat | editovat zdroj]
K určení vlivu struktury a geometrie na vnitromolekulární přenos vodíku byla prozkoumána řada různých N-chloraminů. Systémy byly vytvořeny na základě relativních náchylností k přenosu u primárních, sekundárních a terciárních vodíků, relativních rychlostí 1,5- a 1,6-přesmyků, a možností přesmyků u cyklických sloučenin s omezenou geometrií.
Zkoumáním radikálového rozkladu N-chlorbutylamylaminu 13 byly určeny relativní rychlosti přenosů u primárních a sekundárních vodíků. Za podmínek reakce se vytvářel pouze 1-n-butyl-2-methylpyrrolidin 14, 1-n-amylpyrrolidin 15 pozorován nebyl; tímto se potvrdilo, že radikál přednostně reaguje se sekundárním vodíkem.

Přenosy terciárních oproti primárním vodíkům byly prozkoumány s využitím n-butylisohexylaminu 16; tato látka se za běžných podmínek rychle spotřebovávala, ale nepodařilo se izolovat žádný pyrrolidin, což naznačuje výraznou selektivitu vůči terciárnímu vodíku, terciární chlorovaný meziprodukt 17 byl rychle solvolyzován.

Podobně nebyl pozorován cyklický amin po reakci n-amylisohexylaminu, čímž byla potvrzena selektivita ve prospěch terciárního vodíku oproti sekundárnímu.
Ke zjištění relativní selektivity 1,5- a 1,6.přesunu byla použita reakce N-chlormethyl-n-hexylaminu 18. Fotolýza 18 s následným přidáním zásady vedla ke směsi 1-methyl-2-ethylpyrrolidinu 19 a 1,2-dimethylpiperidinu 20 v poměru 9:1, což ukázalo na využitelnost Hofmannovy–Löfflerovy reakce k přípravám šestičlenných kruhů.

Za stejných podmínek probíhala reakce methylcyklohexylchloraminu s N-chlorazacykloheptanem mnohem pomaleji než u dibutylchloraminu; tím se zjistilo, že převažující geometrie jsou pro přesmyk nevýhodné a hodnoty úhlu Cδ–H–N nutné pro vnitromolekulární přenos vodíku nejsou snadno dosažitelné.
Obecně přijímaný mechanismus[editovat | editovat zdroj]
Prvním krokem Hofmannovy–Löfflerovy–Freytagovy reakce v kyselém prostředí je protonace N-halogenovaného aminu 21 za vzniku příslušné N-halogenované amonné soli 22. Při tepelné= nebo chemické iniciaci radikálové řetězové reakce se tato sůl homolyzuje na vazbě dusík-halogen a vytváří se dusíkatý radikálový kation 23. Při iniciaci ultrafialovým zářením se utváří volný N-halogenamin a probíhá rychlá porotonace vytvoiřeného neutráálního dusíkatého radikálu. Vnitromolekulární 1,5-přenos vodíkového atomu vytvoří uhlíkatý radikál 24, který následně odštěpí halogen z N-halogenované amonné soli 22, čímž vznikne protonovaný δ-halogenovaný amin 25 a obnoví se dusíkatý radikálový kation 23, který slouží jako přenašeč řetězce. Působením zásady se sloučenina 25 deprotonuje po vnitromolekulární SN2 reakci se přes meziprodukt 27 vytvoří pyrrolidin 28.

Převažující odštěpování δ–vodíku je v souladu s tvorbou šestičlenného přechodného stavu, který může zaujmout židličkovou konformaci 29.

Hofmannova–Löfflerova–Freytagova reakce se podobá Bartonově reakci.
Vlastnosti reakce[editovat | editovat zdroj]
- Výchozími látkami mohou být N-chlorované, N-bromované, nebo N-jodované aminy. Při tepelné iniciaci dávají N-chloraminy lepší výtěžky než N-bromaminy, protože jsou tepelně stabilnější.[18] U fotoiniciovaných reakcí se naopak vyšších výtěžků dosahuje při použití N-bromaminů.[11]
- Hofmannovy–Löfflerovy–Freytagovy reakce se většinou provádějí v kyselých prostředích, ale mohou dobře probíhat i za neutrálního či slabě zásaditého pH.[19][20]
- Původně vytvořený dusíkatý radikál odštěpuje vodík převážně z polohy δ- a tak se většinou tvoří pětičlenné kruhy.
- Tvorba šestičlenných kruhů je vzácná.[11]
- Reakci lze provést za mírnějších podmínek, při kterých je alkylový radikál o něco stabilnější.[20]
- Vznik radikálů lze spustit zahřátím, působením záření, nebo radikálovými iniciátory (peroxidy nebo solemi kovů).
Obměny[editovat | editovat zdroj]
Protože původní silně kyselé podmínky reakce nejsou vhodné pro některé citlivé funkční a chránicí skupiny, tak bylo vyvinuto několik obměn Hofmannovy–Löfflerovy–Freytagovy reakce:
- M. Kimura a Y. Ban zjistili, že sousedící atomy dusíku mohou stabilizovat radikály vytvořené odštěpením vodíkových atomů a umožnit provedení reakce i v mírně zásaditých prostředích.[20][21] Dobrých výsledků lze dosáhnout při ozáření reakční směsi ultrafialovým zářením za přítomnosti triethylaminu, který neutralizuje kyselinu chlorovodíkovou vznikající při cyklizaci. Tato varianta byla použita jako součást syntézy dihydrodeoxyepiallocernuinu 35.[20]

- Fotolýza N-halogenamidů probíhá nejlépe za neutrálního pH. Ozářením N-bromamidu 36 (R=t-Bu) vzniká brommethyl-cyklohexanamid 37, který po přidání zásady vytváří iminolakton 38 s 92% výtěžností.[22]

S. W. Baldwin a T. J. Doll provedli jinou obměnu Hofmannovy–Löfflerovy–Freytagovy reakce při výzkumu syntézy alkaloidu gelsemicinu 41. Tvorba pyrrolidinového kruhu sloučeniny 40 byla zajištěna ozářením N-chloramidu 39.[19]

- Další varianta nahrazuje N-halogenaminy sulfonamidy. Za přítomnosti peroxodisíranů a solí kovů mohou sulfonamidy za neutrálních podmínek projít vnitromolekulárními radikálovými funkcionalizacemi vytvářejícími γ- a δ-chloralkenylsulfonamidy. Při reakci za použití Na2S2O8 a CuCl2 byl butylsulfonamie 42 přeměněn na 4-chlorbutylsulfonamid 43 a 3- chlorbutylsulfonamid 44 bez použití kyseliny.[23]

- Nejvýznamnější obměnou Hofmannovy–Löfflerovy–Freytagovy reakce je Suárezova varianta, která zpracovává N-nitroamidy za neutrálních podmínek.[24] Další výzkum této varianty rozšířil spektrum použitelných substrátů na N-kyanamidy, N-fosforamidáty a karbamáty.[25][26][27][28][29] Tyto sloučeniny reagují se sloučeninami hypervalentního jodu za přítomnosti jodu elementárního (I2), přičemž se homolytickou fragmentací jodoamidového meziproduktu vytváří dusíkaté radikály. Tyto N-radikály poté vstupují do vnitromolekulárních 1,5-odštěpování vodíků z neaktivovaných atomů uhlíku, jejímiž produkty jsou pyrrolidiny.

Výhodou tohoto postupu je možnost použít neutrální a mírné reakční podmínky, při kterých jsou nejčastěji používané chránicí skupiny stálé, a které také dovolují zapojit do reakcí citlivější molekuly. Suárezova varianta se také vyznačuje: (1) in situ tvorbou nestabilních jodoamidových meziproduktů; (2) průběhem homolýzy jodoamidů za nízkých teplot (20–40 °C) nebo při ozáření viditelným světlem, díky čemuž není třeba používat ultrafialovou lampu. Má řadu využití (viz níže)
- Použití trijodidů v Suárezově variantě dovoluje provádění aminací sekundárních vazeb C-H.[30] Elementární jod jako prekurzor radikálů je zde nahrazen jodidem sodným (NaI), který brání rozkladům řízeným I2.
Využití[editovat | editovat zdroj]
Nejčastějším způsobem využití Hofmannovy–Löfflerovy–Freytagovy reakce je vytváření pyrrolidinových kruhů.
Za standardních podmínek[editovat | editovat zdroj]
Hofmannovy–Löfflerovy–Freytagovy reakce obvykle vyžadují silně kyselé prostředí, což omezuje jejich využití; přesto však byly použity na funkcionalizace řady strukturně odlišných molekul.
V roce 1980 použili J. P. Lavergne et al. tento postup k přípravě L-prolinu 49.[31]

P. E. Sonnet a J. E. Oliver Hofmannovými–Löfflerovými–Freytagovými reakcemi připravili prekurzory mravenčích feromonů, jako je oktahydroindolizin 51.[32]

Dalším příkladem tvorby bicyklického aminu Hofmannovou–Löfflerovou–Freytagovou reakcí je Waegellova syntéza derivátu azabicyklo[3.2.1]oktanu 53.[33]

Hofmannovými–Löfflerovými–Freytagovými reakcemi lze vytvářet sloučeniny obsahující dusíkové můstky, jako je například (±)-6,15,16-iminopodokarpan-8,11,13-trien 55, meziprodukt přípravy kobusinových alkaloidů, získávaný z bicyklického chloraminu 54.[34] Požadovaný produkt se vytvořil ozářením sloučeniny 54 v kyselině trifluoroctové pomocí vysokotlaké rtuťové lampy o výkonu 400 W v dusíkové atmosféře za pokojové teploty po dobu 5 hodin.

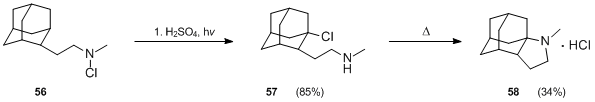
Touto reakcí lze získat také deriváty adamantanu.[35] Reakcí N-chloraminu 56 s kyselinou sírovou za zahřívání reakční směsi se vytváří 2-adamantanon, fotolýzou 56 ve směsi kyseliny sírové a octové při 25 °C po 1 hodinu s využitím nízkotlaké rtuťové lampy vznikal produkt 57 s výtěžností (85 %). Cyklizace 57 byla obtížná, ale s využitím tvrdších podmínek (zahřívání na 290 °C po 10 minut) se ji podařilo provést s 34% výtěžností.
Podobně byly, i když s nižšími výtěžky, získány deriváty diaza-2,6 adamantanu, jako je sloučenina 60.[36]

R. P. Deshpande a U. R. Nayak zjistili, že Hofmannovými–Löfflerovými–Freytagovými reakcemi je možné připravit pyrrolidiny obsahující longifolenová jádra, například 62.[37]

Hofmannovy–Löfflerovy reakce mohou být použity k přípravám steroidních alkaloidů a jejich derivátů. J. Hora[38] a G. van de Woude[39][40][41] je zapojily do syntéz derivátů konesinu.

U sloučenin 64 a 66 se se pětičlenné kruhy vytváří atakem neaktivované C-18 methylové skupiny prekurzoru (63 a 65) C-20 vhodně umístěného dusíkatého radikálu. Snadný průběh této reakce zajišťuje stabilita steroidní struktury β-C-18-methylu a to, že vedlejší řetězec β-C-20 obsahující dusíkatý radikál je orientován tak, aby mohlo proběhnout 1,5-odštepení vodíku vytvářející šestičlenný meziprodukt.

Za mírných podmínek[editovat | editovat zdroj]
Byla popsána řada Hofmannových–Löfflerových–Freytagových reakcí za neutrálních podmínek.
H. Togo et al. zahrnuli Suárezovu variantu do své nové syntetické metody.[42][43] N-alkylsachariny (N-alkyl-1,2-benzisothiazolin-3-on-1,1,-dioxidy) 77 lze snadno připravit se středními až dobrými výtěžky reakcemi N-alkyl(o-methyl)arensulfonamidů 70 s PhI(OAc)2 za přítomnosti jodu a záření z wolframové lampy. V průběhu reakce proběhnou tři cykly 1,5-odštěpení vodíku/jodace o-methylové skupiny; po tomto kroku následuje cyklizace na dijodový meziprodukt 76, jenž je následně hydrolyzován.

Další přeměny se účastní sulfonamidy primárních amidů s aromatickými kruhy v poloze γ s jodany a jodem za působení záření z wolframové lampy.[44] Produkty jsou 1,2,3,4-tetrahydrochinoliny; tento postup je vhodným pro přípravy šestičlenných cyklických aromatických aminů; sulfonamid 78 prochází vnitromolekulární radikálovou cyklizací za vzniku 79 s dobrým výtěžkem.

Stejným způsobem lze získat 3,4-dihydro-2,1-benzothiazin-2,2-dioxidy 81 z N-alkyl-2-(aryl)ethansulfonamidů, přes sulfonamidylové radikály.[45]

E. Suárez et al. zjistili, že amidylové radikály, vznikající jako meziprodukty při fotolýze středně velkých laktamů 82 za přítomnosti PhI(OAc)2 a jodu, prochází transanulárními odštěpováními vodíku za tvorby vnitromolekulárně funkcionalizovaných sloučenin, jako jsou oxoindolizidiny 83.[46]

E. Suárez se svými spolupracovníky použil obdobný postup na přípravu chirálních 8-oxa-6-azabicyklo[3.2.1]-oktanů 85 a 7-oxa-2-azabicyklo[2.2.1]heptanu 87;[27] tuto reakci lze považovat za vnitromolekulární N-glykosidaci, jejíž součástí je vniromolekulární 1,5-odštěoení vodíku zprostředkované N-amidovými radikály, po němž probíhá oxidace uhlíkatého radikálu na oxykarbeniový ion, jenž je zachycen ve vnitromolekulární nukleofilní reakci.[27]

Využitelnost Suárezovy varianty lze ukázat také na přípravách řady steroidů a triterpenů.[25][26][28][29][47] Funkcionalizace iniciované fosforamidáty mívají obecně u N-nitro nebo N-kyanamidů vyšší výtěžnosti.

V roce 2008 byl popsán nový způsob přípravy 1,3-diolů pomocí varianty Hofmannovy–Löfflerovy–Freytagovy reakce.[48]

V roce 2017 byla oznámena příprava 1,2-aminoalkoholů pomocí Hofmannovy–Löfflerovy–Freytagovy reakce[49][50] za účelem β-selektivní C-H aminace alkoholů. Roku 2020 stejný tým objevil její asymetrickou variantu.[51]

Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Hofmann–Löffler reaction na anglické Wikipedii.
- ↑ G. Majetich; K. WHELESS. Remote intramolecular free radical functionalizations: an update. Tetrahedron. 1995, s. 7095–7129. DOI 10.1016/0040-4020(95)00406-X.
- ↑ A. W. Hofmann. Zur Kenntniss des Piperidins und Pyridins. Berichte der Deutschen Chemischen Gesellschaft. 1879, s. 984–990. Dostupné online. DOI 10.1002/cber.187901201254.
- ↑ A. W. Hofmann. Ueber die Einwirkung des Broms in alkalischer Lösung auf Amide. Berichte der Deutschen Chemischen Gesellschaft. 1881, s. 2725–2736. Dostupné online. DOI 10.1002/cber.188101402242.
- ↑ A. W. Hofmann. Ueber die Einwirkung des Broms in alkalischer Lösung auf die Amine. Berichte der Deutschen Chemischen Gesellschaft. 1883, s. 558–560. Dostupné online. DOI 10.1002/cber.188301601120.
- ↑ A. W. Hofmann. Zur Kenntniss der Coniin-Gruppe. Berichte der Deutschen Chemischen Gesellschaft. 1885, s. 5–23. Dostupné online. DOI 10.1002/cber.18850180103.
- ↑ A. W. Hofmann. Zur Kenntniss der Coniin-Gruppe. Berichte der Deutschen Chemischen Gesellschaft. 1885, s. 109–131. Dostupné online. DOI 10.1002/cber.18850180126.
- ↑ E. Lellmann. Ueber die Coniceïne. Berichte der Deutschen Chemischen Gesellschaft. 1890, s. 2141–2142. DOI 10.1002/cber.18900230269.
- ↑ K. Löffler; C. FREYTAG. Über eine neue Bildungsweise von N-alkylierten Pyrrolidinen. Berichte der Deutschen Chemischen Gesellschaft. 1909, s. 3427–3431. Dostupné online. DOI 10.1002/cber.19090420377.
- ↑ K. Löffler; S. KOBER. Über die Bildung des i-Nicotins aus N-Methyl-p-pyridyl-butylamin (Dihydrometanicotin). Berichte der Deutschen Chemischen Gesellschaft. 1909, s. 3431–3438. Dostupné online. DOI 10.1002/cber.19090420378.
- ↑ K. Löffler. Über eine neue Bildungsweise N-alkylierter Pyrrolidine. Berichte der Deutschen Chemischen Gesellschaft. 1910, s. 2035–2048. Dostupné online. DOI 10.1002/cber.191004302146.
- ↑ a b c d S. Wawzonek; P. J. THELAN, P. J. Preparation of N-methylgranatanine. Journal of the American Chemical Society. 1950, s. 2118–2120. DOI 10.1021/ja01161a068.
- ↑ S. Wawzonek; M. F. THELAN; P. J. THELAN. Preparation of quinuclidines. [ Journal of the American Chemical Society. 1951, s. 2806–2808. DOI 10.1021/ja01150a111.
- ↑ a b S. Wawzonek; T. P. CULBERTSON. The formation of 4-chlorodibutylamine from N-chlorodibutylamine. Journal of the American Chemical Society. 1959, s. 3367–3369. DOI 10.1021/ja01522a053.
- ↑ M. E. Wolff. Cyclization of N-Halogenated Amines (The Hofmann–Löffler Reaction). Chemical Reviews. 1963, s. 55–64. DOI 10.1021/cr60221a004.
- ↑ E. J. Corey; W. R. HERTLER. A Study of the formation of haloamines and cyclic amines by the free radical chain decomposition of N-haloammonium ions (Hofmann-Löffler Reaction). Journal of the American Chemical Society. 1960, s. 1657–1668. DOI 10.1021/ja01492a035.
- ↑ W. S. Metcalf. The absorption spectra of mono-, di-, and tri-chloroamines and some aliphatic derivatives. Journal of the Chemical Society. 1942, s. 148–150. DOI 10.1039/JR9420000148.
- ↑ R. S. Neale; M. R. WALSH; N. L. MARCUS. The Influence of Solvent and Chloramine Structure on the Free-Radical Rearrangement Products of N-Chlorodialkylamines. The Journal of Organic Chemistry. 1965, s. 3683. DOI 10.1021/jo01022a022.
- ↑ G. H. Coleman; G. E. GOHEEN. Preparation of Pyrrolidines. Journal of the American Chemical Society. 1938, s. 730. DOI 10.1021/ja01270a512.
- ↑ a b S. W. Baldwin; T. J. DOLL. Synthesis of the 2-aza-7-oxatricyclo[4.3.2.04,8]undecane nucleus of some gelsemium alkaloids. Tetrahedron Letters. 1979, s. 3275–3278. DOI 10.1016/S0040-4039(01)95383-3.
- ↑ a b c d Y. Ban; M. KIMURA; T. OISHI. A Synthesis of (±)-Dihydrodeoxyepiallocernuine by Application of a Facile Hofmann-Loeffler Type of Photocyclization. Chemical and Pharmaceutical Bulletin. 1976, s. 1490–1496. DOI 10.1248/cpb.24.1490.
- ↑ M. Kimura; Y. BAN. A Synthesis of 1,3-Diaza Heterocycles. A Hofmann-Loeffler Type of Photocyclization in the Absence of Strong Acid. Synthesis. 1976, s. 201–202. DOI 10.1055/s-1976-23992.
- ↑ Y. L. Chow; T. W. MOJELSKY; L. J. MAGDZINSKI; M. TICHY. Chemistry of amido radicals: intramolecular hydrogen abstraction as related to amido radical configurations. Canadian Journal of Chemistry. 1985, s. 2197–2202. DOI 10.1139/v85-361.
- ↑ NG. I. ikishin; E. I. TROYANSKY; M. I. LAZAREVA. Regioselective one-step γ-chlorination of alkanesulfonamides. Preponderance of 1,5-H migration from sulfonyl versus amide moiety in sulfonylamidyl radicals. Tetrahedron Letters. 1985, s. 3743–3744. DOI 10.1016/S0040-4039(00)89238-2.
- ↑ R. Hernández; A. RIVERA; J. A. SALAZAR; E. SUÁREZ. Nitroamine radicals as intermediates in the functionalization of non-activated carbon atoms. Journal of the Chemical Society, Chemical Communications. 1980, s. 958–959. DOI 10.1039/C39800000958.
- ↑ a b P. De Armas; C. G. FRANCISCO; R. HERNÁNDEZ; J. A. SALAZAR; E. SUÁREZ. Steroidal N-nitroamines. Part 4. Intramolecular functionalization of N-nitroamine radicals: synthesis of 1,4-nitroimine compounds. Journal of the Chemical Society, Perkin Transactions 1. 1988, s. 3255–3265. DOI 10.1039/P19880003255.
- ↑ a b R. Carrau; R. HERNÁNDEZ; E. SUÁREZ; C. BETANCOR. Intramolecular functionalization of N-cyanamide radicals: synthesis of 1,4-and 1,5-N-cyanoepimino compounds. Journal of the Chemical Society, Perkin Transactions 1. 1987, s. 937–943. DOI 10.1039/P19870000937.
- ↑ a b c C. G. Francisco; A. J. HERRERA; E. SUÁREZ. Intramolecular Hydrogen Abstraction Reaction Promoted by N-Radicals in Carbohydrates. Synthesis of Chiral 7-Oxa-2-azabicyclo[2.2.1]heptane and 8-Oxa-6-azabicyclo[3.2.1]octane Ring Systems. The Journal of Organic Chemistry. 2003, s. 1012–1017. DOI 10.1021/jo026314h. PMID 12558429.
- ↑ a b C. Betancor; J. I. CONCEPCIÓN; R. HERNÁNDEZ; J. A. SALAZAR; E. SUÁREZ. Intramolecular functionalization of nonactivated carbons by amidylphosphate radicals. Synthesis of 1,4-epimine compounds. The Journal of Organic Chemistry year = 1983. S. 4430–4432. DOI 10.1021/jo00171a066.
- ↑ a b P. De Armas; R. CARRAU; J. I. CONCEPCIÓN; C. G. FRANCISCO; R. HERNÁNDEZ; E. SUÁREZ. Synthesis of 1,4-epimine compounds. Iodosobenzene diacetate, an efficient reagent for neutral nitrogen radical generation. Tetrahedron Letters. 1985, s. 2493–2496. DOI 10.1016/S0040-4039(00)94862-7.
- ↑ A., Wappes, Ethan; C., Fosu, Stacy; C., Chopko, Trevor; A., Nagib, David. Triiodide‐Mediated δ‐Amination of Secondary C−H Bonds. Angewandte Chemie International Edition. 2016-08-16, s. 9974–9978. ISSN 1521-3773. DOI 10.1002/anie.201604704. PMID 27384522.
- ↑ S. L. Titouani; J. P. LAVERGNE; P. VIALLEFONT; R. JACQUIER. Nouvelles synthèses de l-amino-acids—I: Synthèse stèréospécifique de l-proline, cis(trans) méthyl-3(4) l-prolines. Tetrahedron. 1980, s. 2961–2965. DOI 10.1016/0040-4020(80)88020-3.
- ↑ P. E. Sonnet; J. E. OLIVER. Synthesis of insect trail pheromones: The isomeric 3-butyl-5-methyloctahydroindolizines. Journal of Heterocyclic Chemistry. 1975, s. 289–294. DOI 10.1002/jhet.5570120215.
- ↑ G. Esposito; R. FURSTOSS; B. WAEGELL. Synthese de la methyl-6, aza-6, bicyclo (3,2,1) octanone-4. Tetrahedron Letters. 1971, s. 899–902. DOI 10.1016/S0040-4039(01)96584-0.
- ↑ Y. Shibanuma; T. OKAMOTO. Synthetic Approach to Diterpene Alkaloids : Construction of the Bridged Azabicyclic Ring System of Kobusine. Chemical and Pharmaceutical Bulletin. 1985, s. 3187–3194. DOI 10.1248/cpb.33.3187.
- ↑ V. L. Narayanan; L. SETESCAK. Synthesis of 1-methyladamantano[1,2-b]pyrrolidine, a novel heterocyclic system. The Journal of Organic Chemistry. 1971, s. 4127–4129. DOI 10.1021/jo00825a026.
- ↑ R. M. Dupeyre; A. RASSAT. Application de la reaction de Hofmann-Löffler-Freytag synthese de derives diaza-2,6 adamantane. Tetrahedron Letters. 1973, s. 2699–2701. DOI 10.1016/S0040-4039(01)96116-7.
- ↑ R. P. Deshpande; U. R. NAYAK. Indian Journal of Chemistry. 1979, s. 310.
- ↑ HORA, J.; SORM, F. On steroids. CXIV. The synthesis of 18-dimethylamino-3β-hydroxy-5α-androstan-17-one and its 5β-isomer. ChemPlusChem. 1968, s. 2059–2065. DOI 10.1135/cccc19682059.
- ↑ G. Van De Woude; L. VAN HOVE. Amino Steroids – Conanine and Heteroconanine Derivatives. Bulletin des Sociétés Chimiques Belges. 1973, s. 49–62. DOI 10.1002/bscb.19730820105.
- ↑ G. Van De Woude; L. VAN HOVE. Amino Steroids – Preparation of 12-Oxygenated Conanine Derivatives (Partial Synthesis of Dihydroholarrhenine). Bulletin des Sociétés Chimiques Belges. 1975, s. 911–922. DOI 10.1002/bscb.19750841001.
- ↑ G. Van De Woude; M. BIESEMANS. Amino steroids – functionalization of position 20 from position 18 in a pregnane system through a Hofmann-Löffler process. predominant formation of 5α-heteroconan-3β-ol. Bulletin des Sociétés Chimiques Belges. 1980, s. 993–1000. DOI 10.1002/bscb.19800891109.
- ↑ H. Togo; M. KATOHGI; M. YOKOYAMA. Direct Preparation of Saccharin Skeletons from N-Methyl(o-methyl)arenesulfonamides with (Diacetoxyiodo)arenes. Synlett. 1998, s. 131–132. DOI 10.1055/s-1998-1615.
- ↑ M. Katohgi; H. TOGO; K. YAMAGUCHI; M. YOKOYAMA. New synthetic method to 1,2-benzisothiazoline-3-one- 1,1-dioxides and 1,2-benzisothiazoline-3-one-1-oxides from N-alkyl(o-methyl) arenesulfonamides. Tetrahedron. 1999, s. 14885–14900. DOI 10.1016/S0040-4020(99)00974-6.
- ↑ H. Togo; Y. HOSHINA; T. MURAKI; H. NAKAYAMA; M. YOKOYAMA. Study on Radical Amidation onto Aromatic Rings with (Diacyloxyiodo)arenes. The Journal of Organic Chemistry. 1998, s. 5193–5200. DOI 10.1021/jo980450y.
- ↑ H. Togo; Y. HARADA; M. YOKOYAMA. Preparation of 3,4-Dihydro-2,1-benzothiazine 2,2-Dioxide Skeleton from N-Methyl 2-(Aryl)ethanesulfonamides with (Diacetoxyiodo)arenes. The Journal of Organic Chemistry. 2000, s. 926–929. DOI 10.1021/jo991419e.
- ↑ R. L. Dorta; C. G. FRANCISCO; E. SUÁREZ. Hypervalent organoiodine reagents in the transannular functionalisation of medium-sized lactams: synthesis of 1-azabicyclo compounds. Chemical Communications. 1989, s. 1168–1169. DOI 10.1039/C39890001168.
- ↑ R. Hernández; M. C. MEDINA; J. A. SALAZAR; E. SUÁREZ; T. PRANGÉ. Intramolecular functionalization of amides leading to lactams. Tetrahedron Letters. 1987, s. 2533–2536. DOI 10.1016/S0040-4039(00)95460-1.
- ↑ P. S. Baran; K. CHEN; J. M. RICHTER. 1,3-Diol Synthesis via Controlled, Radical-Mediated C−H Functionalization. Journal of the American Chemical Society. 2008, s. 7247–7249. DOI 10.1021/ja802491q. PMID 18481847.
- ↑ WAPPES, Ethan A.; NAKAFUKU, Kohki M.; NAGIB, David A. Directed β C–H Amination of Alcohols via Radical Relay Chaperones. Journal of the American Chemical Society. 2017-08-02, s. 10204–10207. ISSN 0002-7863. DOI 10.1021/jacs.7b05214. PMID 28741940.
- ↑ STATEMAN, Leah M.; WAPPES, Ethan A.; NAKAFUKU, Kohki M.; EDWARDS, Kara M.; NAGIB, David A. Catalytic β C–H amination via an imidate radical relay. Chemical Science. 2019-02-27, s. 2693–2699. ISSN 2041-6539. DOI 10.1039/C8SC05685D. PMID 30996986.
- ↑ NAKAFUKU, Kohki M.; ZHANG, Zuxiao; WAPPES, Ethan A.; STATEMAN, Leah M.; CHEN, Andrew D.; NAGIB, David A. Enantioselective radical C–H amination for the synthesis of β-amino alcohols. Nature Chemistry. 2020-06-22, s. 697–704. ISSN 1755-4349. DOI 10.1038/s41557-020-0482-8. PMID 32572164.
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Hofmannova–Löfflerova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hofmannova–Löfflerova reakce na Wikimedia Commons
