Acetanhydrid
| Acetanhydrid | |
|---|---|
 Vzhled | |
 Struktura | |
| Obecné | |
| Systematický název | Anhydrid kyseliny octové |
| Ostatní názvy | Acetanhydrid |
| Sumární vzorec | C4H6O3 |
| Vzhled | Průhledná kapalina |
| Identifikace | |
| Registrační číslo CAS | 108-24-7 |
| Vlastnosti | |
| Molární hmotnost | 102,09 g/mol |
| Teplota tání | −73,1 °C (200,0 K) |
| Teplota varu | 139,8 °C (413 K) |
| Hustota | 1,082 g/cm3 |
| Index lomu | 1,390 1 |
| Rozpustnost ve vodě | 2,6 g/100 ml |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R10 R20/22 R34 |
| S-věty | (S1/2) S26 S36/37/39 S45 |
| NFPA 704 |  2
2
1
|
| Teplota vzplanutí | 49 °C |
| Teplota vznícení | 316 °C |
| Meze výbušnosti | 2,7–10,3 % |
Některá data mohou pocházet z datové položky. | |
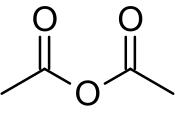
Acetanhydrid (též anhydrid kyseliny octové, systematicky anhydrid kyseliny ethanové) je organická sloučenina se vzorcem (CH3CO)2O, známá také pod zkratkou Ac2O. jedná se o nejjednodušší izolovatelný anhydrid karboxylové kyseliny, s širokým využitím v organických syntézách. Je to čirá kapalina vyznačující se silným zápachem po kyselině octové, kterou tvoří při reakci se vzdušnou vlhkostí.
Struktura a vlastnosti
[editovat | editovat zdroj]Acetanhydrid je flexibilní molekulou, jejíž struktura není planární.[2] Rezonanční posun elektronů pí vazeb přes centrální atom kyslíku má jen malý vliv na stabilitu struktury oproti dipólové interakci mezi dvěma karbonylovými kyslíky. Rozdíly v energiích mezi nejvýhodnějšími možnostmi prostorového uspořádání jsou rovněž nízké.[3]
Jako u většiny anhydridů i zde platí, že karbonylový atom uhlíku má elektrofilní charakter a odstupující skupinou je karboxylát. Na vysokou elektrofilitu má vliv asymetrická prostorová struktura.
Výroba
[editovat | editovat zdroj]Acetanhydrid poprvé syntetizoval v roce 1852 francouzský chemik Charles Frédéric Gerhardt zahříváním octanu draselného s benzoylchloridem.[4] Nukleofilní acylová substituce chloridu kyseliny karboxylátovým aniontem je typický způsob přípravy anhydridů obecně.[5]
Průmyslově se vyrábí reakcí oxidu uhelnatého s methylesterem kyseliny octové,[6] dle rovnice:
Tato reakce probíhá za katalýzy jodidem lithným a jodidem rhoditým.
Lze jej rovněž vyrobit reakcí ketenu s kyselinou octovou při teplotě 45–55 °C a nízkém tlaku (0,05–0,2 bar). Tento způsob byl vyvinut v roce 1922 firmou Wacker Chemie v reakci na rostoucí poptávku acetanhydridu pro výrobu acetátu celulózy.[7]
Díky nízké ceně není acetanhydrid běžně v laboratořích připravován.
Reakce
[editovat | editovat zdroj]Acetanhydrid je vhodným činidlem pro acetylaci, tedy navázání acetylové skupiny na organické substráty. V těchto reakcích figuruje jako zdroj CH3CO+.
Acetylace alkoholů a aminů
[editovat | editovat zdroj]Alkoholy lze acetylovat snadno,[8] reakce probíhá dle obecné rovnice
za vzniku esterů kyseliny octové a kyseliny octové. Katalyzátorem je často báze, např. pyridin, pro specializované aplikace se využívají skandiové soli jakožto Lewisovy kyseliny.[9] Obdobná je reakce s aminy.
Acetylace aromatických kruhů
[editovat | editovat zdroj]Acetanhydrid rovněž acetyluje aromatická jádra, obvykle za katalýzy kyselinami. Mezi názorné reakce patří acetylace benzenu na acetofenon[10] a ferrocenu na acetylferrocen:[11]
- (C5H5)2Fe + (CH3CO)2O → (C5H5)Fe(C5H4COCH3) + CH3CO2H
Příprava dalších anhydridů
[editovat | editovat zdroj]Dikarboxylové kyseliny tvoří po reakci s acetanhydridem příslušné anhydridy.[12] Lze tak připravit i směsné anhydridy, např. acetyl-nitrát reakcí s kyselinou dusičnou.
Hydrolýza
[editovat | editovat zdroj]Acetanhydrid se pouze omezeně rozpouští ve vodě, protože s ní reaguje, a lze tedy dosáhnout maximální koncentrace přibližně 2,6 gramů ve 100 mililitrech vody;[13] stabilita vodných roztoku je omezená, protože sloučenina reaguje na produkt volně mísitelný s vodou:[14]
Aby se předešlo znehodnocení acetanhydridu vzdušnou vlhkostí, je nutné jej skladovat ve vzduchotěsných ampulích a po otevření se musí rychle spotřebovat.
Využití
[editovat | editovat zdroj]
Acetanhydrid se využívá zejména na acetylaci průmyslově významných chemických surovin. Nejrozšířenějším použitím je převádění celulózy na acetát celulózy, který je součástí fotografického filmu, jiných potažených materiálů a cigaretových filtrů. Acetylací kyseliny salicylové vzniká kyselina kyselina acetylsalicylová, známá pod obchodními názvy aspirin či acylpyrin. V autoklávu lze acetanhydrid využít k napuštění a následné acetylaci dřeva za účelem zvýšení jeho odolnosti.[15] V potravinářství je běžným acetylačním činidlem při výrobě modifikovaných škrobů (E1414, E1420, E1422).
Rovněž se používá při výrobě heroinu (diacetylmorfinu) z morfia.
Právní postavení
[editovat | editovat zdroj]Acetanhydrid lze využít k acetylaci morfinu na heroin (diacetylmorfin). Z tohoto důvodu je na seznamu regulovaných látek americké DEA, a v mnoha dalších zemích je jeho prodej omezen.[16][17]
Bezpečnost
[editovat | editovat zdroj]Acetanhydrid je dráždivou a hořlavou kapalinou, způsobuje závažné poleptání kůže a má slzotvorné účinky. Škodlivé jsou i páry.[18] Kvůli reaktivitě s vodou a alkoholem jsou pro hašení požáru preferované pěnové nebo sněhové hasicí přístroje.[19]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Acetic anhydride na anglické Wikipedii.
- ↑ a b Acetic anhydride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ SEIDEL, R. W.; GODDARD, R.; NÖTHLING, N. Acetic anhydride at 100 K: the first crystal structure determination. Acta Crystallographica Section C: Structural Chemistry. 2016-10-01, roč. 72, čís. 10, s. 753–757. Dostupné online [cit. 2023-10-28]. ISSN 2053-2296. DOI 10.1107/S2053229616015047. (anglicky)
- ↑ WU, Guang; VAN ALSENOY, C.; GEISE, H. J. Acetic Anhydride in the Gas Phase, Studied by Electron Diffraction and Infrared Spectroscopy, Supplemented With ab Initio Calculations of Geometries and Force Fields. The Journal of Physical Chemistry A. 2000-02-01, roč. 104, čís. 7, s. 1576–1587. Dostupné online [cit. 2023-10-28]. ISSN 1089-5639. DOI 10.1021/jp993131z. (anglicky)
- ↑ GERHARDT, Charles. Recherches sur les acides organiques anhydres. [s.l.]: [s.n.] 1074 s. Dostupné online. (francouzsky) Google-Books-ID: MXkbAAAAMAAJ.
- ↑ MCMURRY, John. Organic chemistry. Ninth edition. vyd. Boston, MA, USA: Cengage Learning 1054 s. ISBN 978-1-305-08048-5, ISBN 978-1-305-63871-6. S. 701.
- ↑ ZOELLER, Joseph R.; AGREDA, Victor H.; COOK, Steven L. Eastman chemical company acetic anhydride process. Catalysis Today. 1992-03-11, roč. 13, čís. 1, s. 73–91. Dostupné online [cit. 2023-10-27]. ISSN 0920-5861. DOI 10.1016/0920-5861(92)80188-S.
- ↑ History. www.wacker.com [online]. [cit. 2023-10-27]. Dostupné online. (anglicky)
- ↑ Chemical of the Week -- Acetic Acid and Acetic Anhydride. web.archive.org [online]. 2006-03-03 [cit. 2023-10-27]. Dostupné v archivu pořízeném z originálu dne 2006-03-03.
- ↑ Organic Syntheses Procedure. www.orgsyn.org [online]. [cit. 2023-10-27]. Dostupné online. (anglicky)
- ↑ Organic Syntheses Procedure. orgsyn.org [online]. [cit. 2023-10-27]. Dostupné online. (anglicky)
- ↑ TABER, Douglas F. Column chromatography: Preparation of Acetyl Ferrocene. valhalla.chem.udel.edu [online]. Department of Chemistry and Biochemistry, University of Delaware [cit. 2023-10-27]. Dostupné v archivu pořízeném z originálu dne 2009-05-02.
- ↑ Organic Syntheses Procedure. orgsyn.org [online]. [cit. 2023-10-27]. Dostupné online. (anglicky)
- ↑ Acetic Anhydride: Frequently Asked Questions. www.bp.com [online]. British Petroleum [cit. 2023-10-27]. Dostupné v archivu pořízeném z originálu dne 2007-10-11.
- ↑ Acetic Anhydride: Material Safety Data Sheet (PDF). www.celanese.com [online]. Celanese [cit. 2023-10-27]. Dostupné v archivu pořízeném z originálu dne 2007-09-27.
- ↑ Making Wood Last Forever With Acetylation. Chemical & Engineering News [online]. [cit. 2023-10-27]. Dostupné online. (anglicky)
- ↑ Federal Register :: Request Access. unblock.federalregister.gov [online]. [cit. 2023-10-27]. Dostupné online.
- ↑ UN Intercepts Taliban's Heroin Chemical in Rare Afghan Victory - Bloomberg. web.archive.org [online]. 2012-10-22 [cit. 2023-10-27]. Dostupné v archivu pořízeném z originálu dne 2012-10-22.
- ↑ ICSC 0209 - ACETIC ANHYDRIDE. www.inchem.org [online]. [cit. 2023-10-27]. Dostupné online.
- ↑ CDC - NIOSH Pocket Guide to Chemical Hazards - Acetic anhydride. www.cdc.gov [online]. [cit. 2023-10-27]. Dostupné online.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Acetanhydrid na Wikimedia Commons
Obrázky, zvuky či videa k tématu Acetanhydrid na Wikimedia Commons



