Pausonova–Khandova reakce

Pausonova–Khandova reakce je [2+2+1] cykloadiční reakce alkynu, alkenu a oxidu uhelnatého za vzniku α,β-cyklopentenonu.[1][2]
Reakci objevili Ihsan Ullah Khand a Peter Ludwig Pauson v roce 1970.[3][4][5] První takové reakce byly mezimolekulární, ale 10 let po objevu začaly být nalézány i vnitromolekulární.[6]
Při reakci se původně používala stechiometrická množství oktakarbonylu dikobaltu, ale později byly nalezeny varianty vykazující lepší reaktivitu a vyšší výtěžnosti, Tyto obměny využívají chirální pomocníky k dosažení stereoindukce, přechodné kovy (Ti, Mo, W, Fe, Co, Ni, Ru, Rh, Ir a Pd) a různé příměsi.[7][8][9]
Mechanismus[editovat | editovat zdroj]
Mechanismus není popsán zcela, ovšem pro jedno- i dvoujaderné katalyzátoy je široce příjmán ten, který navrhl Philip Magnus v roce 1985,[10][11] jež je i v souladu s výsledky výpočetní studie z roku 2001.[12]
Na začátku se vytvoří hexakarbonylacetylenový komplex dikobaltu. Navázáním alkenu vznikne metalacyklopentanový komplex. Poté se CO naváže na vazbu kov-uhlík. Redukční eliminace vede k cyklopentenonu. Krokem určujícím rychlost je obvykle odštěpení oxidu uhelnatého z organokovového meziproduktu.

- 1:
- Koordinace alkenu, inserce a odštěpení ligandu za tvorby 18elektronového komplexu;
- 2:
- Odštěpení ligandu a vytvoření 16elektronového meziproduktu;
- 3:
- Koordinace alkenu a vznik 18elektronového komplexu;
- 4:
- Inserce alkenu a navázání ligandu, komplex je stále 18elektronový;
- 5:
- Inserce CO;
- 6, 7:
- Redukční eliminace kovu a oddělení [Co2(CO)6];
- 8:
- Navázání CO za obnovy aktivního organokovového komplexu[13]
Selektivita[editovat | editovat zdroj]
Pausonovy–Khandovy reakce využívající nesymetrické alkeny či alkyny nemívají výraznou regioselektivitu; o něco lépe jsou na tom vnitromolekulární varianty.[14]

Reakci lze provést jak u koncových, tak i u vnitřních alkynů, i když v případě vnitřních bývají výtěžky nižší. Reaktivity alkenů klesají podle této řady:

Monosubstituované alkeny reagují v závislosti na sterických vlastnostech použitého alkynu. V mezimolekulárních reakcích stericky mohutnější skupiny na alkynech upřednostňují navazování na C2, zatímco ty, které odtahují elektrony, způsobují převažující navazování na C3.[15]
Monosubstituované alkeny většinou vykazují podobné reaktivity na C4 a C5, výjimkami jsou případy, kdy je na C2 navázána stericky mohutná skupina nebo je na alkenu chelatující heteroatom.[16][17]

Vnitromolekulární Pausonovy-Khandovy reakce byly mnohokrát využity v totálních syntézách, jelikož jsou vhodné na vytváření bicyklických (konkrétně 5,5- a 6,5-spojených), a dalších polycyklických struktur.[8] V blízkosti vodíků navázaných na můstky a substituentů na cyklopentanových kruzích bývají vysoce syn-selektivní.

Katalýza[editovat | editovat zdroj]
Pausonovy-Khandovy reakce lze provést katalyticky.[18] Stephen L. Buchwald při nich použil jako katalyzátory komplexy titanu a niklu.[19][20][21] Eiči Negiši zjistil, že podobně mohou být použity též sloučeniny zirkonia.[22][23] Využít se dají i jiné kovy.[24][8]

Běžné složky katalyzátorů, jako jsou fosfinové ligandy, mohou způsobit přílišnou stabilitu komplexů kobaltu, použitelné jsou ovšem objemné fosfity.[24] Tyto reakce lze provést i enantioselektivně, a to za použití chirálních ligandů, jako je BINAP,[25] nebo chirálních pomocníků.
Úpravy[editovat | editovat zdroj]
Pausonovy–Khandovy reakce se obvykle uskutečňují za vysokých tlaků a teplot v aromatických uhlovodících (benzenu, toluenu) nebo etherátových rozpouštědlech (tetrahydrofuran, 1,2-dichlorethan). I za těchto podmínek je navíc mnohdy potřeba přidávat do reakční směsi další látky. Ke zmírnění reakčních podmínek bylo vyvinuto několik postupů, které umožňují využití dalších funkčních skupin, nevhodných pro původní variantu reakce, vykazují vyšší výtěžky, probíhají rychleji, a často se dá lépe ovládat jejich stereochemie.
K těmto postupům patří adsorbce a přidání amin-N-oxidů nebo Lewisových zásad.
Adsorbce[editovat | editovat zdroj]
Adsorbování kovových komplexů na oxidu křemičitém nebo hlinitém může urychlit dekarbonylační výměnu ligandů.[26][27]
Toto urychlení je vyvolané tím, že se donor nachází na pevném povrchu; ze stejného důvodu je zde také omezena tvorba různých konformací.[28][29][30]

Aminoxidy a hydráty[editovat | editovat zdroj]
Dvěma nejpoužívanějšími aminoxidy jsou N-methylmorfolin-N-oxid (NMO) a trimethylamin-N-oxid (TMANO). Tyto látky odštěpují CO ligandy nukleofilními ataky N-oxidových skupin na CO, který oxidují na CO2, a následnou tvorbou nenasycených organokovových komplexů.[31][32] Tímto způsobují, že první krok mechanismu je nevratný, což umožňuje jeho průběh za mírnějších podmínek.
Použity byly i hydráty výše uvedených aminoxidů.[33][34][35]

Amin-N-oxid byl použit i při totální syntéze epoxydiktymenu.[36]
I když měla reakce s použitím N-oxidu nižší výtěžnost, tak vytvářela požadovaný diastereomer (na následujícím obrázku s červeným vodíkem) v poměru 11:1 oproti druhému; ostatní postupy, využívající například zvýšení teploty nebo ultrazvuk, byly méně účinné.

Lewisovy zásady[editovat | editovat zdroj]
Nejčastějšími Lewisovými zásadami jsou sloučeniny síry, jako například n-BuSMe. Lewisovy zásady pravděpodobně urychlují dekarbonylační výměnu ligandů; podle práce z roku 2005 ale reakci usnadňují tím, že způsobují nevratnost navazování alkenu.[37] Tyto sloučeniny se špatně skladují a zapáchají, a tak byly vyvinuty postupy využívající jiné Lewisovy zásady, jako je n-dodecyl-methylsulfid (DodSMe).[38] Další takto použitelnou sloučeninou je tetramethylthiomočovina.[39]
Lze také použít chirální N-oxidy, ty vyvolávají enantiomerní indukci.[40][41]

Reakce bez použití plynů[editovat | editovat zdroj]
Bylo popsáno několik Pausonových–Khandových reakcí bez použití toxického oxidu uhelnatého, kde byla karbonylová struktura cyklopentenonu vytvářena pomocí aldehydů, karboxylových kyselin a formiátů.[42][43][44]
Jako katalyzátory byly při těchto reakcích použity komplexy rhodia, podobně jako u dekarbonylací. Dekarbonylace a Pausonovy–Khandovy reakce probíhaly v jediné nádobě.
Stabilní komplexy kobaltu[editovat | editovat zdroj]
Původní Pausonovy–Khandovy reakce využívají kobalt v nízkých oxidačních číslech, příslušné komplexy jsou ale obvykle nestálé, takže byly provedeny pokusy o nalezení jejich stálejších obdob. Jednou z nich je acetylacetonát kobaltitý (Co(acac)2), který po vystavení tetrahydridoboritanu sodnému (NaBH4) vytvoří aktivní katalyzátor.[45]
Vícejaderné kobaltové katalyzátory[editovat | editovat zdroj]
Byly použity i vícejaderné kobaltové katalyzátory, jako jsou dodekakarbonyl tetrakobaltu (Co4(CO)12) a Co3(CO)9(μ3-CH), tyto se ale lehce oligomerizují a často vyžadují tvrdší podmínky.[46][47]
Vnitromolekulární Pausonovy–Khandovy reakce lze použít na cyklizaci enynů obsahujících terc-butyldifenylsilylové chránicí skupiny na primárních hydroxylech.[48] Takto byl proveden jeden z kroků asymetrické totální syntézy alkaloidu huperzinu-Q. Tvorby potřebné konformace se dosáhlo díky navázání cyklické siloxanové skupiny na substrát[49] – vznikal tak jediný enantiomer.[48]

Ostatní[editovat | editovat zdroj]
Také Wilkinsonův katalyzátor, sloučenina obsahující rhodium, může dobře katalyzovat Pausonovy-Khandovy reakce. Vyžaduje ale přítomnost trifluormethansulfonátu stříbrného jako kokatalyzátoru.[50]

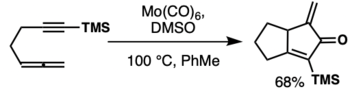
Hexakarbonyl molybdenu lze použít jako zdroj oxidu uhelnatého v reakcích allenů s alkyny a dimethylsulfoxidem v toluenu.[51]
Do těchto reakcí lze zapojit většinu allenů. Katalyzátory mohou být založené i na molybdenu, i když u rhodia se dosahuje lepší regioselektivity. Studie s využitím teorie funkcionálu hustoty ukázala, že rozdílná selektivita je způsobena rozdílnými geometriemi přechodných stavů těchto reakcí.[52]
Při totální syntéze fysostigminu byla použita Pausonova-Khandova reakce karbodiimidu.[52][53]

Také cyklobutadien, obvykle připravovaný z trikarbonylu (cyklobutadien)železa reakcí s dusičnanem amonno-ceričitým, lze [2+2+1] cykloadovat.[54]

K novějším variantám Pausonovy-Khandovy reakce patří využití chlordikarbonylu rhodného, [(CO)2RhCl]2, v přípravě (+)-forbolu. Reakce je vnitromolekulární cyklizací a vytváří se při ní jak pětičlenný α,β-cyklopentenonový kruh, tak i sedmičlenný kruh.[55]
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Pauson–Khand reaction na anglické Wikipedii.
- ↑ Pauson a Khand 1977.
- ↑ Jaime Blanco-Urgoiti; Loreto Añorbe; Leticia Pérez-Serrano; Gema Domínguez; Javier Pérez-Castells. The Pauson–Khand reaction, a powerful synthetic tool for the synthesis of complex molecules. Chemical Sociesty Reviews. 2004, s. 32–42. DOI 10.1039/b300976a. PMID 14737507.
- ↑ Helmut Werner. Obituary: Peter Ludwig Pauson (1925–2013). Angewandte Chemie International Edition. 2014, s. 3309. DOI 10.1002/anie.201400432.
- ↑ Khand et al. 1973a.
- ↑ Khand et al. 1973b.
- ↑ N. E. Schore; M. C. Croudace. Preparation of bicyclo[3.3.0]oct-1-en-3-one and bicyclo[4.3.0]non-1(9)-en-8-one via intramolecular cyclization of .alpha.,.omega.-enynes. The Journal of Organic Chemistry. 1981, s. 5436–5438. Dostupné online. ISSN 0022-3263. DOI 10.1021/jo00339a046.
- ↑ Hartwig 2010.
- ↑ a b c Ríos Torres 2012.
- ↑ Neil E. Schore. The Pauson–Khand Cycloaddition Reaction for Synthesis of Cyclopentenones. Organic Reactions. 1981, s. 1–90. ISBN 0471264180. DOI 10.1002/0471264180.or040.01.
- ↑ Philip Magnus; Lawrence M. Principe. Origins of 1,2- and 1,3-stereoselectivity in dicobaltoctacarbonyl alkene-alkyne cyclizations for the synthesis of substituted bicyclo[3.3.0]octenones. Tetrahedron Letters. 1985, s. 4851–4854. Dostupné online. ISSN 0040-4039. DOI 10.1016/s0040-4039(00)94968-2.
- ↑ Philip Magnus; Christopher Exon; Pamela Albaugh-Robertson. Dicobaltoctacarbonyl-alkyne complexes as intermediates in the synthesis of bicyclo[3.3.0]octenones for the synthesis of coriolin and hirsutic acid. Tetrahedron. 1985, s. 5861–5869. Dostupné online. ISSN 0040-4020. DOI 10.1016/S0040-4020(01)91425-5.
- ↑ Masahiro Yamanaka; Eiichi Nakamura. Density Functional Studies on the Pauson−Khand Reaction. Journal of the American Chemical Society. 2001, s. 1703–1708. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja005565+. PMID 11456770.
- ↑ a b Kürti László; CZAKÓ BARBARA. Strategic Applications of Named Reactions in Organic Synthesis: background and detailed mechanisms. Amsterdam: Elsevier Academic Press, 2005. ISBN 978-0-12-429785-2. OCLC 60792519
- ↑ Nakcheol Jeong; Sung Hee Hwang; Youngshin Lee; Young Keun Chung. Catalytic version of the Intramolecular Pauson-Khand Reaction. Journal of the American Chemical Society. 1994, s. 3159. ISSN 0002-7863. DOI 10.1021/ja00086a070.
- ↑ Frédéric Robert; Anne Milet; Yves Gimbert; Denés Konya; Andrew E. Greene. Regiochemistry in the Pauson−Khand Reaction: Has a Trans Effect Been Overlooked?. Journal of the American Chemical Society. 2001, s. 5396–5400. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja004170n. PMID 11389617.
- ↑ Christopher Exon; Philip Magnus. Stereoselectivity of intramolecular dicobalt octacarbonyl alkene-alkyne cyclizations: short synthesis of dl-coriolin. Journal of the American Chemical Society. 1983, s. 2477–2478. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja00346a0637.
- ↑ Marie E. Krafft. Regiocontrol in the intermolecular cobalt-catalyzed olefin-acetylene cycloaddition. Journal of the American Chemical Society. 1988, s. 968–970. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja00211a048.
- ↑ Jacobsen 1999.
- ↑ HICKS, Frederick A.; BUCHWALD, Stephen L. Highly Enantioselective Catalytic Pauson−Khand Type Formation of Bicyclic Cyclopentenones. Journal of the American Chemical Society. 1996-01-01, s. 11688–11689. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja9630452.
- ↑ HICKS, Frederick A.; KABLAOUI, Natasha M.; BUCHWALD, Stephen L. Titanocene-Catalyzed Cyclocarbonylation of Enynes to Cyclopentenones. Journal of the American Chemical Society. January 1996, s. 9450–9451. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja9621509.
- ↑ ZHANG, Minghui; BUCHWALD, Stephen L. A Nickel(0)-Catalyzed Process for the Transformation of Enynes to Bicyclic Cyclopentenones. The Journal of Organic Chemistry. January 1996, s. 4498–4499. Dostupné online. ISSN 0022-3263. DOI 10.1021/jo960410z. PMID 11667365.
- ↑ NEGISHI, Eiichi; HOLMES, Steven J.; TOUR, James M.; MILLER, Joseph A. Metal promoted cyclization. 7. Zirconium-promoted bicyclization of enynes. Journal of the American Chemical Society. 1985-04-01, s. 2568–2569. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja00294a071.
- ↑ NEGISHI, Eiichi; HOLMES, Steven J.; TOUR, James M.; MILLER, Joseph A.; CEDERBAUM, Fredrik E.; SWANSON, Douglas R.; TAKAHASHI, Tamotsu. Metal-promoted cyclization. 19. Novel bicyclization of enynes and diynes promoted by zirconocene derivatives and conversion of zirconabicycles into bicyclic enones via carbonylation. Journal of the American Chemical Society. April 1989, s. 3336–3346. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja00191a035.
- ↑ a b Nakcheol Jeong; Sung Hee Hwang; Youngshin Lee; Young Keun Chung. Catalytic version of the Intramolecular Pauson-Khand Reaction. Journal of the American Chemical Society. 1994, s. 3159–3160. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja00086a070.
- ↑ Nakcheol Jeong; Byung Kee Sung; Yoon Kyung Choi. Rhodium(I)-Catalyzed Asymmetric Intramolecular Pauson−Khand-Type Reaction. Journal of the American Chemical Society. 2000, s. 6770–6772. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja0007049.
- ↑ David C. Billington; Debra Willison. A simple organocobalt mediated synthesis of substituted 3-oxabicyclo[3.3.0]oct-6-en-7-ones. Tetrahedron Letters. 1984, s. 4041–4044. Dostupné online. ISSN 0040-4039. DOI 10.1016/0040-4039(84)80061-1.
- ↑ Takashi Morimoto; Masao Hirano; Kohki Echigoya; Takafumi Sato. Oxidation by cobalt(III) acetate. Part 10. Effects of ring substituents on the product distributions in the oxidation of β-methylstyrenes by cobalt(III) acetate in acetic acid. Journal of the Chemical Society, Perkin Transactions 2. 1986, s. 1205–1209. Dostupné online. ISSN 0300-9580. DOI 10.1039/p29860001205.
- ↑ Scott W. Brown; Peter L. Pauson. The synthesis of nitrogen heterocycles via the intramolecular Khand reaction: formation of tetra- and hexa-hydrocyclopenta[c]pyrrol-5(1H)-ones and hexahydro-6H-2-pyridin-6-ones. Journal of the Chemical Society, Perkin Transactions 1. 1990. Dostupné online. ISSN 0300-911X. DOI 10.1039/p19900001205.
- ↑ Aleksandr E. Shilov; Georgiy B. Shul'pin. Activation and Catalytic Reactions of Alkanes in Solutions of Metal Complexes. Russian Chemical Reviews. 1987-05-31, s. 442–464. Dostupné online. ISSN 0036-021X. DOI 10.1070/rc1987v056n05abeh003282. Bibcode 1987RuCRv..56..442S.
- ↑ W. A. Smit; S. L. Kireev; O. M. Nefedov; V. A. Tarasov. Methylenecyclopropane as an alkene component in the Khand-Pauson reaction. Tetrahedron Letters. 1989, s. 4021–4024. Dostupné online. ISSN 0040-4039. DOI 10.1016/S0040-4039(00)99313-4.
- ↑ Soroosh Shambayani; William E. Crowe; Stuart L. Schreiber. N-oxide promoted pauson-khand cyclizations at room temperature. Tetrahedron Letters. 1990, s. 5289–5292. Dostupné online. ISSN 0040-4039. DOI 10.1016/S0040-4039(00)98052-3.
- ↑ Howard Alper; J. T. Edward. Reactions of iron pentacarbonyl with compounds containing the N—O linkage. Canadian Journal of Chemistry. 2011-02-03, s. 1543–1549. Dostupné online. DOI 10.1139/v70-251.
- ↑ James J. Crawford; William J. Kerr; Mark McLaughlin; Angus J. Morrison; Peter L. Pauson; Graeme J. Thurston. Use of a highly effective intramolecular Pauson–Khand cyclisation for the formal total synthesis of (±)-α- and β-cedrene by preparation of cedrone. Tetrahedron. 2006-12-04, s. 11360–11370. Dostupné online. ISSN 0040-4020. DOI 10.1016/j.tet.2006.05.044.
- ↑ Marie E. Krafft; Romulo H. Romero; Ian L. Scott. Pauson-Khand reaction with electron-deficient alkynes. The Journal of Organic Chemistry. 1992, s. 5277–5278. Dostupné online. ISSN 0022-3263. DOI 10.1021/jo00046a001.
- ↑ Vania Bernardes; Nina Kann; Antoni Riera; Albert Moyano; Miquel A. Pericas; Andrew E. Greene. Asymmetric Pauson-Khand Cyclization: A Formal Total Synthesis of Natural Brefeldin A. The Journal of Organic Chemistry. 1995, s. 6670–6671. Dostupné online. ISSN 0022-3263. DOI 10.1021/jo00126a010.
- ↑ Timothy F. Jamison; Soroosh Shambayati; William E. Crowe; Stuart L. Schreiber. Tandem Use of Cobalt-Mediated Reactions to Synthesize (+)-Epoxydictymene, a Diterpene Containing a Trans-Fused 5−5 Ring System. Journal of the American Chemical Society. 1997, s. 4353–4363. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja970022u.
- ↑ Carlos Perez del Valle; Anne Milet; Yves Gimbert; Andrew E. Greene. Lewis Base Promoters in the Pauson–Khand Reaction: A Different Scenario. Angewandte Chemie International Edition. 2005, s. 5717–5719. Dostupné online. ISSN 1521-3773. DOI 10.1002/anie.200500955. PMID 16078280.
- ↑ Alison R. Cochrane; William J. Kerr; Laura C. Paterson; Colin M. Pearson; Paul Shaw. Advances in the cobalt-catalysed Pauson-Khand reaction: Development of a sulfide-promoted, microwave-assisted protocol. Tetrahedron. 2021-01-08, s. 131805. Dostupné online. ISSN 0040-4020. DOI 10.1016/j.tet.2020.131805.
- ↑ Carin Reuter; Fritz Vögtle. Rotaxanes via Michael Addition. Organic Letters. 2000, s. 593–595. Dostupné online. ISSN 1523-7060. DOI 10.1021/ol990350u. PMID 10814386.
- ↑ David R. Carbery; William J. Kerr; David M. Lindsay; James S. Scott; Stephen P. Watson. Preparation and reaction of desymmetrised cobalt alkyne complexes. Tetrahedron Letters. 2000-04-22, s. 3235–3239. Dostupné online. ISSN 0040-4039. DOI 10.1016/S0040-4039(00)00356-7.
- ↑ Andrzej Jończyk; Anna Konarska. Generation and Reactions of Ammonium Ylides in Basic Two-Phase Systems: Convenient Synthesis of Cyclopropanes, Oxiranes and Alkenes Substituted with Electron-Withdrawing Groups. Synlett. 1999, s. 1085–1087. Dostupné online. ISSN 0936-5214. DOI 10.1055/s-1999-2757.
- ↑ Tsumoru Morimoto; Koji Fuji; Ken Tsutsumi; Kiyomi Kakiuchi. CO-Transfer Carbonylation Reactions. A Catalytic Pauson−Khand-Type Reaction of Enynes with Aldehydes as a Source of Carbon Monoxide. Journal of the American Chemical Society. 2002, s. 3806–3807. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja0126881. PMID 11942798.
- ↑ Takanori Shibata; Natsuko Toshida; Kentaro Takagi. Catalytic Pauson−Khand-Type Reaction Using Aldehydes as a CO Source. Organic Letters. 2002, s. 1619–1621. Dostupné online. ISSN 1523-7060. DOI 10.1021/ol025836g. PMID 11975643.
- ↑ Chemical Communications. 2007, s. 2545–2546. Dostupné online. ISSN 1359-7345. DOI 10.1039/b708443a.
- ↑ Nam Young Lee; Young Keun Chung. Synthesis of cyclopentenones: The new catalytic cocyclization reaction of alkyne, alkene, and carbon monoxide employing catalytic Co(acac)2 and NaBH4. Tetrahedron Letters. 1996, s. 3145–3148. Dostupné online. ISSN 0040-4039. DOI 10.1016/0040-4039(96)00513-8.
- ↑ Jong Wook Kim; Young Keun Chung. Pauson-Khand Reaction Catalyzed by Co4(CO)12. Synthesis. 1998, s. 142–144. Dostupné online. ISSN 0039-7881. DOI 10.1055/s-1998-2016.
- ↑ Takumichi Sugihara; Masahiko Yamaguchi. The Pauson−Khand Reaction Catalyzed by the Methylidynetricobalt Nonacarbonyl Cluster. Journal of the American Chemical Society. 1998, s. 10782-10783. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja982635s.
- ↑ a b Atsushi Nakayama; Noriyuki Kogure; Mariko Kitajima; Hiromitsu Takayama. Asymmetric Total Synthesis of a Pentacyclic Lycopodium Alkaloid: Huperzine‐Q. Angewandte Chemie International Edition. 2011, s. 8025–8028. DOI 10.1002/anie.201103550. PMID 21751323.
- ↑ Tse-Lok Ho. Fiesers' Reagents for Organic Synthesis. [s.l.]: John Wiley & Sons, 2016. ISBN 9781118942819. Kapitola Dicobalt Octacarbonyl, s. 251–252.
- ↑ Nakcheol Jeong, Byung Ki Sung, Jin Sung Kim, Soon Bong Park,Sung Deok Seo, Jin Young Shin, Kyu Yeol In, Yoon Kyung Choi Pauson–Khand-type reaction mediated by Rh(I) catalysts Pure Appl. Chem., Vol. 74, No. 1, pp. 85–91, 2002 ([1])
- ↑ J. Kent. A new allenic Pauson-Khand cycloaddition for the preparation of α-methylene cyclopentenones. Tetrahedron Letters. 1995, s. 2407–2410. DOI 10.1016/0040-4039(95)00315-4.
- ↑ a b Alexander S. Bayden; Kay M. Brummond; Kenneth D. Jordan. Computational Insight Concerning Catalytic Decision Points of the Transition Metal Catalyzed [2 + 2 + 1] Cyclocarbonylation Reaction of Allenes. Organometallics. 2006, s. 5204–5206. Dostupné online. ISSN 0276-7333. DOI 10.1021/om0607503. PMID 26005240.
- ↑ MUKAI, Chisato; YOSHIDA, Tatsunori; SORIMACHI, Mao; ODANI, Akira. Co2(CO)8-Catalyzed Intramolecular Hetero-Pauson−Khand Reaction of Alkynecarbodiimide: Synthesis of (±)-Physostigmine. Organic Letters. January 2006, s. 83–86. Dostupné online. ISSN 1523-7060. DOI 10.1021/ol052562z. PMID 16381573.
- ↑ Intramolecular [2+2+1] Cycloadditions with (Cyclobutadiene)tricarbonyliron Benjamin A. Seigal, Mi Hyun An, Marc L. Snapper Angewandte Chemie International Edition Volume 44, issue 31 , pages 4929 - 4932 2005 DOI:10.1002/anie.200501100
- ↑ Shuhei Kawamura; Hang Chu; Jakob Felding; Phil S. Baran. Nineteen-step total synthesis of (+)-phorbol. Nature. 2016, s. 90–93. DOI 10.1021/om0607503. PMID 27007853. Bibcode 2016Natur.532...90K.
Literatura[editovat | editovat zdroj]
Khandův a Pausonův výzkum reakce
- KHAND, Ihsan U.; KNOX, Graham R.; PAUSON, Peter L.; WATTS, William E. Organocobalt complexes, Part I: Arene complexes derived from dodecacarbonyltetracobalt. Journal of the Chemical Society, Perkin Transactions. 1973a, s. 975–977. ISSN 0300-922X. DOI 10.1039/p19730000975.
- KHAND, Ihsan U.; KNOX, Graham R.; PAUSON, Peter L.; WATTS, William E.; FOREMAN, Michael I. Organocobalt complexes, Part II: Reaction of acetylenehexacarbonyldicobalt complexes, (R1C2R2)Co2(CO)6, with norbornene and its derivatives. Journal of the Chemical Society, Perkin Transactions. 1973b, s. 977–981. ISSN 0300-922X. DOI 10.1039/p19730000977. (anglicky)
- PAUSON, P. L.; KHAND, I. U. Uses of Cobalt-Carbonyl Acetylene Complexes in Organic Synthesis. Ann. N. Y. Acad. Sci.. 1977, s. 2–14. DOI 10.1111/j.1749-6632.1977.tb41819.x. S2CID 84203764. Bibcode 1977NYASA.295....2P.
Pozdější výzkum:
- HARTWIG, John F. Knovel. Organotransition Metal Chemistry: from bonding to catalysis. Mill Valley, Calif.: University Science Books, 2010. ISBN 978-1-891389-53-5. OCLC 310401036
- RÍOS TORRES, Ramón. The Pauson-Khand reaction : scope, variations, and applications. Redakce Rios Torres Ramon. Hoboken, N.J.: John Wiley & Sons, 2012. ISBN 978-1-118-30863-9. DOI 10.1002/9781119941934. OCLC 774982574
- GIBSON, Susan E.; STEVENAZZI, Andrea. The Pauson–Khand Reaction: The Catalytic Age Is Here!. Angew. Chem. Int. Ed.. 2003, s. 1800–1810. DOI 10.1002/anie.200200547. PMID 12722067.
Výzkum soustředící se na katalytické varianty:
- JACOBSEN, Eric N. Comprehensive Asymmetric Catalysis I–III. Berlin, Heidelberg: Springer Berlin Heidelberg, 1999. ISBN 978-3-642-63651-6. DOI 10.1007/978-3-642-58571-5_24. Kapitola Future Perspectives in Asymmetric Catalysis, s. 1473–1477.
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Pausonova–Khandova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Pausonova–Khandova reakce na Wikimedia Commons

