Karbodiimid

Karbodiimid (systematický název methandiimin[1]) je název funkční skupiny s obecným vzorcem RN=C=NR. Látky obsahující tuto skupinu jsou výhradně umělého původu, v přírodě nebyly nalezeny. Příkladem je dicyklohexylkarbodiimid, používaný při syntéze peptidů.[2] Dialkylkarbodiimidy jsou stabilní. Některé diraylkarbodiimidy vytvářejí za pokojové teploty dimery a polymery, což se nejčastěji děje u karbodiimidů s nízkou teplotou tání, které jsou za běžných podmínek kapalné.[3] Pevné diarylkarbodiimidy jsou stabilnější, ale za přítomnosti vody mohou pomalu podléhat hydrolýze.
Struktura[editovat | editovat zdroj]
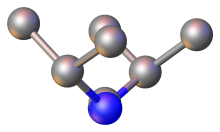
Z hlediska vazeb jsou karbodiimidy isoelektronické s oxidem uhličitým. Vytvářejí celkem třirezonanční struktury:
- RN=C=NR ↔ RN+≡C-N−R ↔ RN−-C≡N+R
N=C=N jádra jsou téměř lineární, úhel vazby N=C=N je 170° a úhly vazeb C-N=C bývají 126±1°.[4] Délky vazeb C=N jsou okolo 120 pm. Karbodiimidy jsou chirální, mají C2-symetrii.[5] V důsledku nízké energetické bariéry pro rotaci molekul dochází k rychlým přeměnám na příslušné izomery, kvůli čemuž je izolace jednoho konkrétního enantiomeru karbodiimidu velmi obtížná; byla popsána příprava jednotlivých izomerů některých karbodiimidů, ovšem o její důvěryhodnosti se pochybuje.[6][7]
Výchozí sloučenina methandiimin (HN=C=NH) je tautomerem kyanamidu.
Příprava[editovat | editovat zdroj]
Z derivátů močoviny a thiomočoviny[editovat | editovat zdroj]
Obvyklým způsobem přípravy karbodiimidů je dehydrosulfurizace derivátů thiomočoviny pomocí oxidu rtuťnatého.[8]
- (R(H)N)2CS + HgO → (RN)2C + HgS + H2O
Karbodiimidy lze také získat dehydratací N,N'-dialkylmočovin:
- (R(H)N)2CO → (RN)2C + H2O
Jako dehydratační činidlo se používá oxid fosforečný[9] nebo p-toluensulfonylchlorid[10][11]
Z izokyanátů[editovat | editovat zdroj]
Izokyanáty mohou být přeměněny na karbodiimidy za odštěpení oxidu uhličitého.[12][3]
- 2 RN=C=O → (RN)2C + CO2
Tato reakce je vratná; katalyzují ji fosfinoxidy.
Reakce[editovat | editovat zdroj]
Ve srovnání s ostatními heteroalleny jsou karbodiimidy slabými elektrofily a s nukleofily reagují pouze za přítomnosti katalyzátorů, jako jsou kyseliny.[13] Tímto způsobem lze například připravit guanidin.[2] Jako slabé zásady se karbodiimidy vážou na Lewisovy kyseliny.
Moffattova oxidace[editovat | editovat zdroj]
Karbodiimidy mohou vstupovat do Moffatových oxidací, při kterých se mění alkoholy na karbonylové sloučeniny za použití dimethylsulfoxidu jako oxidačního činidla.[14]
- (CH3)2SO + (CyN)2C + R2CHOH → (CH3)2S + (CyNH)2CO + R2C=O
Sulfoxid a diimid se obvykle používají v přebytku.[15]
Tvorba amidů[editovat | editovat zdroj]
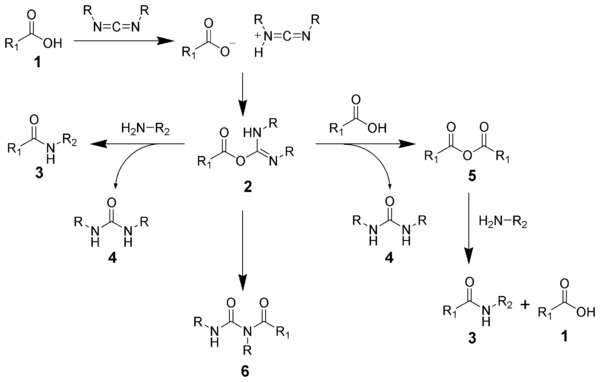
Při přípravě amidů z karbodiimidů dochází k vedlejším reakcím. Kyselina 1 reaguje s karbodiimidem za vzniku O-acylisomočoviny 2, což je v podstatě ester karboxylové kyseliny s aktivovanou odstupující skupinou. O-acylisomočovina následně reaguje s aminy, čímž se vytváří amid 3 a močovina 4.
O-acylisomočovina 2 může reagovat s dalším ekvivalentem karboxylové kyseliny 1 za tvorby acylanhydridu 5, který se může přeměnit na amid 3. Častou vedlejší reakcí je přeměna O-acylisomočoviny na nereaktivní N-acylmočovinu 6. Použitím rozpouštědel s nízkou relativní permitivitou, jako jsou dichlormethan a chloroform, lze tyto vedlejší reakce omezit.[16]
Ostatní reakce[editovat | editovat zdroj]
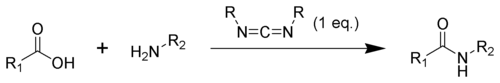
Sloučeniny obsahující karbodiimidové skupiny se používají v organické syntéze jako dehydratační činidla, nejčastěji při přeměně karboxylových kyselin na amidy a estery. Za účelem zvýšení výtěžnosti a omezení vedlejších reakcí se někdy do reakční směsi přidávají další látky, jako jsou například N-hydroxybenzotriazol nebo N-hydroxysukcinimid.
Polykarbodiimidy je nožné použít jako zesíťovací činidla u některých pryskyřic, jako jsou polyuretany a polyakryláty. Polykarbodiimid zde reaguje s karboxylovými skupinami, které jsou v takových pryskyřicích časté, za tvorby N-acylmočoviny. Tato reakce vede ke vzniku kovalentních vazeb mezi molekulami polymeru a vzniku síťovité struktury.[17][18]
Příklady[editovat | editovat zdroj]
Dicyklohexylkarbodiimid[editovat | editovat zdroj]

Dicyklohexylkarbodiimid (DCC) je jedním z prvních karbodiimidů používaných v chemických reakcích. Používá se na přípravů amidů a esterů, například při syntéze peptidů. K jeho výhodám patří vysoké výtěžnosti reakcí sloužících k přípravě amidů. Nevýhodami jsou tvorba N,N'-dicyklohexylmočoviny jako vedlejšího produktu, který lze odstranit filtrací, ovšem stopová množství nečistot se odstraňují obtížně. Navíc je DCC silný alergen.
Diisopropylkarbodiimid[editovat | editovat zdroj]

Isopropylkarbodiimid (DIC) je kapalina, jejíž hydrolýzou vzniká N,N'-diisopropylmočovina, rozpustná v organických rozpouštědlech.
EDC[editovat | editovat zdroj]
1-ethyl-3-(3-dimethylaminopropyl)karbodiimid (EDC) má široké možnosti využití; kromě těch uvedených u DCC a DIC jde například o to, že může být použit jako zesíťovací činidlo v biochemii.
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Carbodiimide na anglické Wikipedii.
- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry, 2014. ISBN 978-0-85404-182-4. DOI 10.1039/9781849733069-00372. S. 375.
- ↑ a b Andrew Williams; Ibrahim T. Ibrahim. Carbodiimide Chemistry: recent Advances. Chemical Reviews. 1981, s. 589–636. DOI 10.1021/cr00046a004.
- ↑ a b T. W. Campbell; J. J. Monagle. Diphenylcarbodiimide. Organic Syntheses. 1963, s. 31. DOI 10.15227/orgsyn.043.0031.
- ↑ a b H. Irngartinger; H.-U. Jäger. Kristall- und Molekularstrukturen von zwei Carbodiimiden: Bis(diphenylmethyl)carbodiimid und Bis(p-methoxyphenyl)-carbodiimid. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 1978, s. 3262–3265. DOI 10.1107/S0567740878010626.
- ↑ A. T. Vincent; P. J. Wheatley. Crystal Structure of Bis-p-nitrophenylcarbodiimide, O2N·C6H4·N:C:N·C6H4·NO2. Journal of the Chemical Society, Perkin Transactions. 1972, s. 1567–1571. DOI 10.1039/P29720001567.
- ↑ Tohru Taniguchi; Takahiro Suzuki; Haruka Satoh; Yukatsu Shichibu; Katsuaki Konishi; Kenji Monde. Preparation of Carbodiimides with One-Handed Axial Chirality. Journal of the American Chemical Society. 2018, s. 15 577 – 15 581. Dostupné online [cit. 2020-08-18]. DOI 10.1021/jacs.8b08969.
- ↑ Robert Damrauer; Hai Lin; Niels H. Damrauer. Computational Studies of Carbodiimide Rings. Journal of Organic Chemistry. 2014, s. 3781–3788. Dostupné online [cit. 2020-08-18]. DOI 10.1021/jo4026435.
- ↑ Frederick Kurzer; K. Douraghi-Zadeh. Advances in the Chemistry of Carbodiimides. Chemical Reviews. 1967, s. 107–152. DOI 10.1021/cr60246a001.
- ↑ Henri Ulrich. Chemistry and Technology of Carbodiimides. [s.l.]: Wiley-VCH, 2008. ISBN 978-0-470-06510-5.
- ↑ John C. Sheehan; Philip A. Cruickshank. 1-Ethyl-3-(3-Dimethylamino)propylcarbodiimide Hydrochloride and Methiodide. Organic Syntheses. 1968, s. 83. DOI 10.15227/orgsyn.048.0083.
- ↑ Arnab K. Maity; Skye Fortier; Leonel Griego; Alejandro J. Metta-Magaña. Synthesis of a "Super Bulky" Guanidinate Possessing an Expandable Coordination Pocket. Inorganic Chemistry. 2014, s. 8155–8164. DOI 10.1021/ic501219q. PMID 25029088.
- ↑ J. J. Monagle. Carbodiimides. III. Conversion of Isocyanates to Carbodiimides. Catalyst Studies. The Journal of Organic Chemistry. 1962, s. 3851–3855. DOI 10.1021/jo01058a022.
- ↑ Zhen Li; Robert J. Mayer; Armin R. Ofial; Herbert Mayr. From Carbodiimides to Carbon Dioxide: Quantification of the Electrophilic Reactivities of Heteroallenes. Journal of the American Chemical Society. 2020-04-27. DOI 10.1021/jacs.0c01960.
- ↑ T. T. Tidwell. Oxidation of Alcohols by Activated Dimethyl Sulfoxide and Related Reactions: An Update. Synthesis. 1990, s. 857–870. DOI 10.1055/s-1990-27036.
- ↑ John G. Moffatt. Cholane-24-al. Organic Syntheses. 1967, s. 25. DOI 10.15227/orgsyn.047.0025.
- ↑ Hotan Mojarradi. Coupling of substances containing a primary amine to hyaluronan via carbodiimide-mediated amidation. [s.l.]: Uppsala Universitet, 2010.
- ↑ L. C. J. Hesselmans; A. J. Derksen; J. A. M. van den Goorbergh. Polycarbodiimide crosslinkers. Progress in Organic Coatings. 2006. ISSN 0300-9440. DOI 10.1016/j.porgcoat.2005.08.011.
- ↑ W. Posthumus; A. J. Derksen; J. A. M. van den Goorbergh; L. C. J. Hesselmans. Crosslinking by polycarbodiimides. Progress in Organic Coatings. 2007. ISSN 0300-9440. DOI 10.1016/j.porgcoat.2006.09.031.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Karbodiimid na Wikimedia Commons
Obrázky, zvuky či videa k tématu Karbodiimid na Wikimedia Commons
