Pravidlo 18 elektronů
Pravidlo 18 elektronů je chemické pravidlo používané pro předpovídání a tvorbu vzorců stabilních komplexů přechodných kovů, většinou se uplatňuje u organokovových sloučenin.[1]
Pravidlo je založeno na té skutečnosti, že valenční orbitaly zahrnují pět (n−1)d orbitalů, jeden ns orbital a tři np orbitaly, kde n je hlavní kvantové číslo. Tyto orbitaly mohou celkem pojmout 18 elektronů jako vazebné i nevazebné elektronové páry. a spojeními těchto devíti atomových orbitalů s orbitaly ligandu vytvořit devět molekulových orbitalů, které se mohou i nemusí podílet na vazbě kov-ligand. Pokud má komplex 18 valenčních elektronů, tak dosáhl stejné elektronové konfigurace jako vzácný plyn v příslušné periodě, což komplexu dodává stabilitu. Zajímavé nebo užitečné bývají komplexy narušující toto pravidlo, protože se vyznačují vyšší reaktivitou. Pravidlo nelze použít u komplexů nepřecxhodných kovů. Navrhl jej americký chemik Irving Langmuir v roce 1921.[1][2]
Využití
[editovat | editovat zdroj]Pravidlo 18 elektronů lze použít pro tvorbu vzorců nízkospinových komplexů skupin Cr, Mn, Fe a Co. Jako příklady lze uvést ferrocen, pentakarbonyl železa, hexakarbonyl chromu a tetrakarbonyl niklu. U těchto sloučenin má všech devět vazebných molekulových orbitalů nízké energie. Protože je umístění elektronů do nich výhodné a každý orbital může pojmout dva elektrony, tak se největší stability dosahuje při zaplnění těchto orbitalů 18 elektrony - tyto elektrony pochází z kovu i z ligandů.
Využitelnost pravidla 18 elektronů ovlivňují ligandy navázané na kov. Komplexy, které mu nevyhovují obsahují alespoň z části π-akceptorové ligandy (také označované jako π-kyseliny). Tyto ligandy vytváří silné ligandové pole, které snižuje energie příslušných molekulových orbitalů, jejichž obsazení elektrony se tak stává výhodným. Tuto vlastnost mají například alkenové, fosfinové a karbonylové ligandy. Kovy v komplexech π-kyselin mají většinou nízká oxidační čísla.
Vliv na reaktivitu
[editovat | editovat zdroj]Sloučeniny porušující pravidlo 18 elektronů, jako jsou chlorid hexamminkobaltitý (Co(NH3)6]Cl3), hexakarbonyl molybdenu (Mo(CO)6) a hexakyanoželeznatanový anion (Fe(CN)6]4−), často vyměňují ligandy, výměny probíhají skrz disociativná substituce, kdy je rychlost reakce určována rychlostí disociace ligandu. 18elektronové sloučeniny oproti tomu mohou být vysoce reaktivní vůči elektrofilům, jako jsou protony.
Sloučeniny s méně než 18 valenčními elektrony, se vyznačují zvýšenou reaktivitou; pravidlo 18 elektronů tak může napovědět, které sloučeniny jsou nereaktivní stechiometricky i katalyticky.
Pravidlo 12 elektronů
[editovat | editovat zdroj]Výpočty bylo zjištěno, že valenční orbitaly p v kovech se na vazbách s ligandy podílejí jen slabě.[3] V rámci přirozených vazebných orbitalů se orbitaly někdy do vazeb kov-ligand nezapočítávají.[4] Tímto vzniká pravidlo 12 elektronů, zahrnující pouze 5 orbitalů d- a 1 orbital s.
Na rozdíl od oktetového pravidla pro prvky hlavní skupiny nemusejí přechodné kovy zcela dodržovat pravidla 12 nebo 18 elektronů, místo toho tato pravidla určují spodní a svrchní mez počtu valenčních elektronů.[5][6] Zatímco se tak do vazeb přechodných kovů často zapojují orbitaly d a s, tak účast energetičtějších orbitalů p na vazbách závisí na centrálním atomu a na koordinačním prostředí.[7][8]
Výjimky
[editovat | editovat zdroj]Pí-donorové a σ-donorové ligandy, které s orbitaly kovů interagují slabě, vytváří slabé ligandové pole, čímž se navyšují energie t2g orbitalů a tyto molekulové orbitaly se stávají nevazebnými nebo slabě protivazebnými (mají malé hodnoty Δoct). Přidání nebo odstranění elektronů tak nemá na stabilitu komplexu větší vliv. Počet d elektronů poté není omezen a mohou se objevovat komplexy s 12 až 22 valenčními elektrony. Malé Δoct umožňují zaplnění eg* (více než 18 e−) a π-donory dovolují, aby t2g byly protivazebné (méně než 18 e−). Takové ligandy se nacházejí ve spodní až střední části spektrochemické řady, jedná se například o [TiF6]2− (Ti4+, d0, 12 e−), [Co(NH3)6]3+ (Co3+, d6, 18 e−) a [Cu(OH2)6]2+ (Cu2+, d9, 21 e−).
Δoct kovových iontů se zvyšují s rostoucími protonovými a oxidačními čísly. Silná ligandová pole vedou k nízkospinovým komplexům, která způsobují výjimky z pravidla 18 elektronů.
16elektronové komplexy
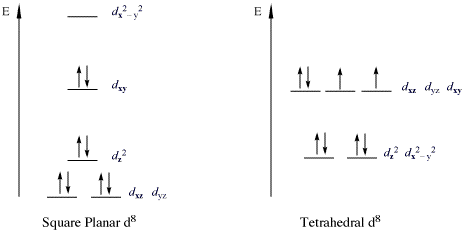
[editovat | editovat zdroj]Důležitými sloučeninami porušujícími pravidlo 18 elektronů jsou 16elektronové komplexy kovů s konfigurací d8. Vysokospinové komplexy d8 iontů mohou být oktaedrické nebo tetraedrické, ale nízkospinové komplexy d8 jsou čtvercově rovinné. K d8 iontům vytvářejícím čtvercově rovinné nízkospinové komplexy patří Rh+, Ir+, Ni2+, Pd2+ a Pt2+. Nejvíce takových sloučenin se vyskytuje u prvků skupin kobaltu a niklu; příklady jsou Vaskův komplex (IrCl(CO)(PPh3)2), tetrachloroplatnatanový anion ([PtCl4]2−) a Zeiseho sůl ([PtCl3(η2-C2H4)]−). Orbitaly dz2 obsahují u těchto sloučenin dva elektrony a jsou nevazebné.
Níže je zobrazeno rozštěpení d podslupek u nízkospinových čtvercově rovinných komplexů:
Mnoho katalytických cyklů, například v izomerizacích, v polymerizacích a hydrogenacích alkenů, a hydroformylacích, je založeno na vzájemných přeměnách mezi 18elektronovými a čtvercovými 16elektronovými komplexy.
Další narušení se dají rozdělit podle druhu ligandů navázaných na kov.
Objemné ligandy
[editovat | editovat zdroj]Objemné ligandy mohou bránit dosažení 18elektronové konfigurace. Jako příklady lze uvést:
- Ti(neopentyl)4 (8 e−)
- Cp*2Ti(C2H4) (16 e−)
- V(CO)6 (17 e−)
- Cp*Cr(CO)3 (17 e−)
- Pt(PtBu3)2 (14 e−)
- Co(norbornyl)4 (13 e−)
- [FeCp2]+ (17 e−)
Některé tyto komplexy vykazují agostické interakce s uhlovodíkovými řetězci ligandů:
- W(CO)3[P(C6H11)3]2 má 16 e−, ale těsné přiblížení jedné z vazeb C–H k atomu W.
- Cp(PMe3)V(CHCMe3) (14 e−, diamagnetický) má krátkou vazbu V–H na alkylidenovém vodíku, takže jej lze popsat jako přechod mezi Cp(PMe3)V(CHCMe3) a Cp(PMe3)V(H)(CCMe3).
Vysokospinové komplexy
[editovat | editovat zdroj]Vysokospinové komplexy mají orbitaly obsazené jedním elektronem a nemají prázdné orbitaly, do kterých by ligandy mohly dodávat elektronovou hustotu. V takovýchto komplexech se buď nevyskytují žádné π-kyselé ligandy, nebo je jejich počet malý. Orbitaly obsazené jediným elektronem se mohou spojit s obdobnými orbitaly radikálových ligandů (jako je kyslík), nebo po přidání ligandů se silným ligandovým polem vyvolávat párování elektronů za vzniku prázdných orbitalů. do kterých lze dodávat elektrony.
Příklady:
- CrCl3(thf)3 (15 e−)
- [Mn(H2O)6]2+ (17 e−)
- [Cu(H2O)6]2+ (21 e−)
Pravidlo 18 elektronů často narušují komplexy se silnými π-donory; takovými ligandy jsou například fluorid (F−), oxidy (O2−), nitrid (N3−), alkoxid (RO−) a imid (RN2−). Jako příklady sloučenin lze uvést:
- [CrO4]2− (16 e−)
- Mo(=NR)2Cl2 (12 e−)
U druhého komplexu se objevuje výrazné dodávání volných párů dusíku na atom Mo, takže lze sloučeninu také označovat za 16elektronovou. Tento jev způsobuje zkrácení délky vazby Mo–N a také ovlivňuje velikost úhlu Mo–N–C(R), která se blíží 180°.
Protipříklady:
- trans-WO2(Me2PCH2CH2PMe2)2 (18 e−)
- Cp*ReO3 (18 e−)
U těchto sloučenin mají vazby M=O povahu „čistých“ dvojných vazeb, kde nedochází k dodávání volných párů kyslíku na kov, což se projevuje delšími vazbami.
π-donorové ligandy
[editovat | editovat zdroj]Ligandy, ve kterých má koordinující atom nevazebné volné páry, mohou stabilizovat nenasycené komplexy. Pravidlo 18 elektronů často narušují amidy a alkoxidy.
Spojení několika efektů
[editovat | editovat zdroj]V některých komplexech se současně projevuje více uvedených jevů; patří sem mimo jiné:
- Cp*VOCl2 (14 e−)
- TiCl4 (8 e−)
Vyšší počty elektronů
[editovat | editovat zdroj]Jsou známy i komplexy s více než 18 elektrony, například:
- Kobaltocen (19 e−)
- Niklocen (20 e−)
- Hexaaquaměďnatý ion [Cu(H2O)6]2+ (21 e−)
- TM(CO)8− (TM = Sc, Y, La) (20 e−)
Přítomnost více než 18 elektronů v komplexech se často připiduje elektrostatickým silám – kovy přitahují ligandy vce asnaze vyrovnat kladný náboj a počet elektronů se stává nevýznamným. U metalocenů chelatační účinky cyklopentadienylového ligandu stabilizují jeho vazbu na kov. Kobaltocen je silným donorem elektronů, který snadno vytvoří 18elektronový kobaltoceniový kation a niklocen vstupuje do reakcí, ve kterých vytváří 18elektronové komplexy, jako jsou CpNiCl(PR3) a CpH.
U niklocenu se dva přebývající elektrony nachází v orbitalech, které jsou vůči vazbám kov-uhlík slabě protivazebné; proto se komplex často účšastní reakcí, ve kterých dochází ke štěpení vazeb M–C a počet elektronů se mění na 18.[9]
20elektronové komplexy TM(CO)8− (TM = Sc, Y, La) mají krychlové (Oh) geometrie a singletové (1A1g) základní stavy. Obsahují jeden zaplněný valenční molekulový orbital s a2u symetrií, vytvářený pouze orbitaly ligandu, bez zapojení atomových orbitalů kovu. Pravidlo 18 elektronů splňují sloučeniny typu TM(CO)8− (TM=Sc, Y, La), pokud se počítají pouze ty valenční elektrony, které obsazují vazebné orbitaly vazby kov–ligand.[10]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku 18-electron rule na anglické Wikipedii.
- ↑ a b I. Langmuir. Types of Valence. Science. 1921, s. 59–67. Dostupné online. DOI 10.1126/science.54.1386.59. Bibcode 1921Sci....54...59L.
- ↑ William B. Jensen. The Origin of the 18-Electron Rule. Journal of Chemical Education. 2005, s. 28. DOI 10.1021/ed082p28. Bibcode 2005JChEd..82...28J.
- ↑ The Chemical Bond: Chemical Bonding Across the Periodic Table. [s.l.]: Wiley-VCH, 2014. ISBN 978-3-527-33315-8. Kapitola Chemical bonding in Transition Metal Compounds.
- ↑ C. R. Landis; F. Weinhold. Valence and extra-valence orbitals in main group and transition metal bonding. Journal of Computational Chemistry. 2007, s. 198–203. DOI 10.1002/jcc.20492. PMID 17063478.
- ↑ Gernot Frenking; Nikolaus Fröhlich. The Nature of the Bonding in Transition-Metal Compounds. Chemical Reviews. 2000, s. 717–774. DOI 10.1021/cr980401l. PMID 11749249.
- ↑ Lili Zhao; Nicole Holzmann; Peter Schwerdtfeger; Gernot Frenking. Chemical Bonding and Bonding Models of Main-Group Compounds. Chemical Reviews. 2019, s. 8781–8845. DOI 10.1021/acs.chemrev.8b00722. PMID 31251603.
- ↑ Craig Bayse; Michael Hall. Prediction of the Geometries of Simple Transition Metal Polyhydride Complexes by Symmetry Analysis. Journal of the American Chemical Society. 1999, s. 1348–1358. DOI 10.1021/ja981965+.
- ↑ R. B. King. Structure and bonding in homoleptic transition metal hydride anions. Coordination Chemistry Reviews. 2000, s. 813–829. DOI 10.1016/S0010-8545(00)00263-0.
- ↑ Gregory Girolami; Thomas Rauchfuss; Robert Angelici. Synthesis and Technique in Inorganic Chemistry. Sausalito, California: University Science Books, 1999. Dostupné online. ISBN 978-0-935702-48-4. Kapitola Experiment 20.
- ↑ Jiaye Jin; Tao Yang; Ke Xin; Guanjun Wang; Xiaoyang Jin; Mingfei Zhou; Gernot Frenking. Octacarbonyl Anion Complexes of Group Three Transition Metals [TM(CO)8]− (TM=Sc, Y, La) and the 18-Electron Rule. Angewandte Chemie International Edition. 2018-04-25. ISSN 1433-7851. DOI 10.1002/anie.201802590. PMID 29578636.
Literatura
[editovat | editovat zdroj]- TOLMAN, C. A. The 16 and 18 electron rule in organometallic chemistry and homogeneous catalysis. Chemical Society Reviews. 1972, s. 337. DOI 10.1039/CS9720100337.