Čtvercově rovinná molekulová geometrie
Čtvercově rovinná molekulová geometrie je druh molekulové geometrie (prostorového uspořádání molekul), kdy se atomy v rámci molekul nacházejí ve vrcholech čtverce
Příklady
[editovat | editovat zdroj]Čtvercově rovinnou geometrii má mnoho molekul, například řada komplexů přechodných kovů; tuto strukturu má také, v souladu s teorií VSEPR, fluorid xenoničitý (XeF4) Vyskytuje se u komplexů s d8 konfigurací, například sloučenin Rh+, Ir+, Pd2+, Pt2+ a Au3+. Jako příklady lze uvést protinádorová léčiva cisplatinu, [PtCl2(NH3)2], a karboplatinu. Čtvercově rovinné jsou základní formy některých homogenních katalyzátorů, například Wilkinsonova a Crabtreeova katalyzátoru. Patří sem též Vaskův komplex a Zeiseho sůl. Čtvercovou geometrii lze stabilizovat určitými ligandy, jako jsou porfyriny.
Rozštěpení d-orbitalů
[editovat | editovat zdroj]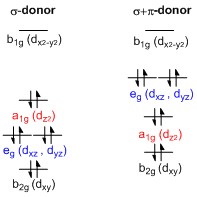
Diagram štěpení d-orbitalů u čtvercově rovinných (D4h) komplexů přechodných kovů lze odvodit z obdobného diagramu pro oktaedrické komplexy, v nichž jsou orbitaly dz2 a dx2−y2 degenerované a mají vyšší energie než seskupení degenerovaných orbitalů dxy, dxz a dyz. Při odejmutí dvou axiálních ligandů a vytvoření čtvercově rovinné geometrie se energie orbitalu dz2 orbital sníží v důsledku odstranění vzájemného odpuzování elektronů na ligandech na ose z; u čistě σ-donorových ligandů má ale orbital dz2stále vyšší energii než dxy, dxz a dyz. Elektronová hustota je u něj rozprostřena na osách x a y, takže tento orbital interaguje se zaplněnými orbitaly. Orbitaly dxy, dxz a dyz se obvykle popisují jako degenerované, ale štěpí se do dvou různých energetických úrovní. Jejich uspořádání zavisí na vlastnostech každého komplexu. Štěpení orbitalů d narušují, na rozdíl od oktaedrických komplexů, π-donorové ligandy. Silné π-donory mohou způsobit, že energie orbitalů dxz a dyz jsou vyšší než u dz2, zatímco u oktaedrických π-donory ovlivňují pouze míru štěpení a vzájemné uspořádání orbitalů se zachovává.[1]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Square planar molecular geometry na anglické Wikipedii.
- ↑ Jonas Börgel; Michael G. Campbell; Tobias Ritter. Transition Metal d-Orbital Splitting Diagrams: An Updated Educational Resource for Square Planar Transition Metal Complexes. Journal of Chemical Education. 2016-01-12, s. 118–121. ISSN 0021-9584. DOI 10.1021/acs.jchemed.5b00542. Bibcode 2016JChEd..93..118B.
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj]- 3D Chem – Struktury a 3D molekuly
- Příklady různých bodových grup
- [1] – Koordinační čísla a komplexní ionty
