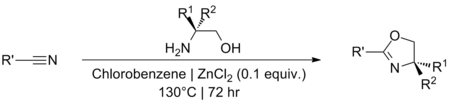Oxazolin
| Oxazolin | |
|---|---|
 Strukturní vzorec | |
 4-Oxazoline 3D Balls.png | |
| Obecné | |
| Systematický název | 4,5-dihydro-1,3-oxazol |
| Ostatní názvy | Δ2-oxazolin |
| Sumární vzorec | C3H5NO |
| Identifikace | |
| Registrační číslo CAS | 504-77-8 |
| EC-no (EINECS/ELINCS/NLP) | 208-000-4 |
| PubChem | 68157 |
| SMILES | C1COC=N1 |
| InChI | InChI=1S/C3H5NO/c1-2-5-3-4-1/h3H,1-2H2 |
| Vlastnosti | |
| Molární hmotnost | 71,078 g/mol |
| Teplota varu | 98 °C (371 K)[1] |
| Hustota | 1,075 g/cm3[1] |
Některá data mohou pocházet z datové položky. | |
Oxazolin je pětičlenný heterocyklus se vzorcem C3H5NO; jako oxazoliny se také označují jeho deriváty, substituované mohou být na uhlících i na dusíku. Oxazoliny jsou nenasycenými analogy oxazolidinů a izomery isoxazolinů, jež obsahují přímé propojení atomů N a O. Samotný oxazolin má dva izomery, lišící se polohou dvojné vazby.
Samotný oxazolin nemá mnoho využití, ale jeho deriváty se zkoumají pro možná využití jako ligandy v asymetrické katalýze, jako chránicí skupiny pro karboxylové kyseliny a jako monomery při výrobě polymerů.
Izomery
[editovat | editovat zdroj] |
Oxazolin může mít v závislosti na poloze dvojné vazby tři různé strukturní izomery, běžné jsou však pouze 2‑oxazoliny. 4‑oxazoliny jsou meziprodukty příprav některých azomethinových ylidů,[2] ale vyskytují se vzácně. Ještě méně časté jsou 3‑oxazoliny, které lze vytvořit fotochemicky[3] nebo otevíráním kruhu azirinů.[4]
Uvedené izomery se nemohou snadno přeměnit jeden v druhý a nejde tak o tautomery. Obdobná sloučenina, ve které je atom kyslíku vedle dusíku, se nazývá isoxazolin. |
Příprava
[editovat | editovat zdroj]2-oxazoliny se zpravidla připravují cyklizacemi 2-aminoalkoholů (obvykle získávaných redukcemi aminokyselin) obsahujících vhodné funkční skupiny.[5][6][7] Tyto reakce často probíhají podle Baldwinových pravidel.
Z karboxylových kyselin
[editovat | editovat zdroj]Oxazoliny lze vytvořit reakcemi acylchloridů a 2-aminoalkoholů; k uvolnění kyseliny se obvykle používá chlorid thionylu, v takovém případě je třeba zachovávat bezvodé prostředí, protože při protonaci iminu by chlorid otevíral kruh oxazolinu.[8] Příprava obvykle probíhá za pokojové teploty.
Pokud je třeba použít mírnější reaktant než SOCl2, tak je možné zapojit do reakce oxalylchlorid.[9]
Často používaným aminoalkoholem je aminomethylpropanol.[10][11]
Oxazoliny je možné připravovat i obměněnou Appelovou reakcí.[12]
Tento druh příprav probíhá za mírných podmínek, ale vzhledem k tvorbě velkých množství trifenylfosfinoxidu není vhodný pro reakce ve větším měřítku.
Z aldehydů
[editovat | editovat zdroj]Cyklizačními reakcemi aminoalkoholů s aldehydy vznikají oxazolidinové meziprodukty, které lze působením halogenovaných oxidačních činidel (například N-bromsukcinimidu[13] nebo jodu[14]) převést na oxazoliny; reakce probíhají přes imidoylhalogenidy. Využít lze mnoho různých aromatických i alifatických aldehydů, aromatické skupiny bohaté na elektrony, jako jsou fenoly, ale nejsou vhodné, protože s oxidačním činidlem vstupují do elektrofilních aromatických halogenací.
Z nitrilů
[editovat | editovat zdroj]Katalytická množství chloridu zinečnatého lze použít na tvorbu oxazolinů z nitrilů.[15][16][17] Reakce se provádějí za vysokých teplot, zpravidla v refluxovaném chlorbenzenu, a za nepřítomnosti vody. Přesný mechanismus nebyl navržen, ale předpokládá se, že je podobný jako u Pinnerovy reakce, kde se tvoří amidinový meziprodukt.[18][19]
Výzkum jiných rozpouštědel nebo katalyzátorů této reakce není příliš pokročilý.[20][21]
Použití
[editovat | editovat zdroj]Ligandy
[editovat | editovat zdroj]Ligandy obsahující chirální 2-oxazolinové kruhy nacházejí využití v asymetrické katalýze, protože se snadno připravují, mohou mít řadu podob a jsou účinné při velkém počtu různých reakcí.[22][23]
2-substituované oxazoliny jsou tvrdými N-donory. Chiralitu lze snadno vytvořit pomocí 2-aminoalkoholů získaných redukcemi aminokyselin. Protože se stereocentra v těchto oxazolinech nachází vedle atomů dusíku, tak mohou ovlivnit selektivitu reakcí probíhajících na kovových centrech. Oxazolinový kruh je tepelně stálý[24] a odolný vůči nukleofilům, zásadám, radikálům, slabým kyselinám,[25] hydrolýze a oxidaci;[5] zůstává tak stálým za nejrůznějších podmínek.
K významným skupinám oxazolinových ligandů patří:
Polymerizace
[editovat | editovat zdroj]Některé 2-oxazoliny, například 2-ethyl-2-oxazolin, se mohou polymerizovat na poly(2-oxazoliny).[26] Tyto sloučeniny patří mezi polyamidy a lze je považovat za analogy peptidů; mají mnoho možných využití,[27] například v biomedicíně.[28][29]
Analýza mastných kyselin
[editovat | editovat zdroj]Dimethyloxazolinové deriváty mastných kyselin lze použít k jejich analýze plynovou chromatografií.
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Oxazoline na anglické Wikipedii.
- ↑ a b WENKER, H. Syntheses from Ethanolamine. V. Synthesis of Δ2-Oxazoline and of 2,2'-Δ2-Dioxazoline. Journal of the American Chemical Society. 1938, s. 2152–2153. DOI 10.1021/ja01276a036.
- ↑ E. Vedejs; J. W. Grissom. 4-Oxazoline route to stabilized azomethine ylides. Controlled reduction of oxazolium salts. Journal of the American Chemical Society. 1988, s. 3238–3246. DOI 10.1021/ja00218a038.
- ↑ Diego Armesto; Maria J. Ortiz; Rafael Pérez-Ossorio; William M. Horspool. A novel photochemical 1,2-acyl migration in an enol ester. The synthesis of 3-oxazoline derivatives. Tetrahedron Letters. 1983, s. 1197–1200. DOI 10.1016/S0040-4039(00)86403-5.
- ↑ Marcus C. M. Sá; Albert Kascheres. Electronically Mediated Selectivity in Ring Opening of 1-Azirines. The 3-X Mode: Convenient Route to 3-Oxazolines. The Journal of Organic Chemistry. 1996, s. 3749–3752. DOI 10.1021/jo9518866. PMID 11667224.
- ↑ a b Richard H. Wiley; Leonard L. Bennett. The Chemistry of the Oxazolines. Chemical Reviews. 1949, s. 447–476. DOI 10.1021/cr60139a002.
- ↑ John A. Frump. Oxazolines. Their preparation, reactions, and applications. Chemical Reviews. 1971, s. 483–505. DOI 10.1021/cr60273a003.
- ↑ Thomas G. Gant; A. I. Meyers. The chemistry of 2-oxazolines (1985–present). Tetrahedron. 1994, s. 2297–2360. DOI 10.1016/S0040-4020(01)86953-2.
- ↑ Marian N. Holerca; Virgil Percec. 1H NMR Spectroscopic Investigation of the Mechanism of 2-Substituted-2-Oxazoline Ring Formation and of the Hydrolysis of the Corresponding Oxazolinium Salts. European Journal of Organic Chemistry. 2000, s. 2257–2263. DOI 10.1002/1099-0690(200006)2000:12<2257::AID-EJOC2257>3.0.CO;2-2.
- ↑ David Evans; Gretchen S. Peterson; Jeffrey S. Johnson; David M. Barnes; Kevin R. Campos; Keith A. Woerpel. n Improved Procedure for the Preparation of 2,2-Bis[2-[4(S)- tert-butyl-1,3-oxazolinylpropane [(S,S)-tert-Butylbis(oxazoline)] and Derived Copper(II) Complexes. The Journal of Organic Chemistry. 1998, s. 4541–4544. DOI 10.1021/jo980296f.
- ↑ Albert I. Meyers; Mark E. Flanagan. 2,2'-Dimethoxy-6-Formylbiphenyl. Organic Syntheses. 1993, s. 107. DOI 10.15227/orgsyn.071.0107.
- ↑ Stephen R. Sardini; Brian M. Stoltz. Discussion Addendum for: Preparation of (S)-tert-ButylPy Ox and Palladium-Catalyzed Asymmetric Conjugate Addition of Arylboronic Acids. Organic Syntheses. 2021, s. 117–130. DOI 10.15227/orgsyn.098.0117. PMID 36247231.
- ↑ Helmut Vorbrüggen; Konrad Krolikiewicz. A simple synthesis of Δ2-oxazines, Δ2-oxazines, Δ2-thiazolines and 2-substituted benzoxazoles. Tetrahedron. 1993, s. 9353–9372. DOI 10.1016/0040-4020(93)80021-K.
- ↑ Kirsten Schwekendiek; Frank Glorius. Efficient Oxidative Synthesis of 2-Oxazolines. Synthesis. 2006, s. 2996–3002. DOI 10.1055/s-2006-950198.
- ↑ Midori Ishihara; Hideo Togo. Direct oxidative conversion of aldehydes and alcohols to 2-imidazolines and 2-oxazolines using molecular iodine. Tetrahedron. 2007, s. 1474–1480. DOI 10.1016/j.tet.2006.11.077.
- ↑ Helmut Witte; Wolfgang Seeliger. Simple Synthesis of 2-Substituted 2-Oxazolines and 5,6-Dihydro-4H-1,3-oxazines. Angewandte Chemie International Edition in English. 1972, s. 287–288. DOI 10.1002/anie.197202871.
- ↑ Helmut Witte; Wolfgang Seeliger. Cyclische Imidsäureester aus Nitrilen und Aminoalkoholen. Justus Liebigs Annalen der Chemie. 1974, s. 996–1009. DOI 10.1002/jlac.197419740615.
- ↑ Carsten Bolm; Konrad Weickhardt; Margareta Zehnder; Tobias Ranf. Synthesis of Optically Active Bis(2-oxazolines): Crystal Structure of a 1,2-Bis(2-oxazolinyl)benzene ZnCl2 Complex. Chemische Berichte. 1991, s. 1173–1180. DOI 10.1002/cber.19911240532.
- ↑ A. V. Makarycheva-Mikhailova, V. Y. Kukushkin, A. A. Nazarov, D. A. Garnovskii, A. J. L. Pombeiro, M. Haukka, B. K. Keppler, M. Galanski. Amidines Derived from Pt(IV)-Mediated Nitrile−Amino Alcohol Coupling and Their Zn(II)-Catalyzed Conversion into Oxazolines. Inorganic Chemistry. 2003, s. 2805–2813. DOI 10.1021/ic034070t. PMID 12691592.
- ↑ A. I. Meyers; M. Ann Hanagan; A. L. Mazzu. 2-Oxazolines from Amides via Imidates. Heterocycles. 1981, s. 361. DOI 10.3987/S-1981-01-0361.
- ↑ A. Cornejo, J. M. Fraile, J. I. García, M. J. Gil, V. Martínez-Merino, J. A. Mayoral, E. Pires, I. Villalba. An Efficient and General One-Pot Method for the Synthesis of Chiral Bis(oxazoline) and Pyridine Bis(oxazoline) Ligands. Synlett. 2005, s. 2321–2324. DOI 10.1055/s-2005-872672.
- ↑ Helen C. Aspinall, John Bacsa, Oliver D. Beckingham, Edward G. B. Eden, Nicholas Greeves, Matthew D. Hobbs, Frances Potjewyd, Marc Schmidtmann, Christopher D. Thomas. Adding the right (or left) twist to tris-chelate complexes – coordination chemistry of chiral oxazolylphenolates with M3+ ions (M = Al or lanthanide). Dalton Transactions. 2014, s. 1434–1442. Dostupné online. DOI 10.1039/C3DT52366G. PMID 24201227.
- ↑ Helen A. McManus; Patrick J. Guiry. Recent Developments in the Application of Oxazoline-Containing Ligands in Asymmetric Catalysis. Chemical Reviews. 2004, s. 4151–4202. DOI 10.1021/cr040642v. PMID 15352789.
- ↑ Gráinne C. Hargaden; Patrick J. Guiry. Recent Applications of Oxazoline-Containing Ligands in Asymmetric Catalysis. Chemical Reviews. 2009, s. 2505–2550. DOI 10.1021/cr800400z. PMID 19378971.
- ↑ Yim Fun Loo, Ruairi O'Kane, Anthony C. Jones, Helen C. Aspinall, Richard J. Potter, Paul R. Chalker, Jamie F. Bickley, Stephen Taylor, Lesley M. Smith. Deposition of HfO2 and ZrO2 films by liquid injection MOCVD using new monomeric alkoxide precursors. Journal of Materials Chemistry. 2005, s. 1896. DOI 10.1039/B417389A.
- ↑ T. W. Greene. Protective groups in organic synthesis, 2nd ed.. New York: [s.n.], 1991. Dostupné online. DOI 10.1039/B417389A. S. 265–266, 433–436.
- ↑ Shiro Kobayashi; Hiroshi Uyama. Polymerization of cyclic imino ethers: From its discovery to the present state of the art. Journal of Polymer Science Part A: Polymer Chemistry. 2002-01-15, s. 192–209. DOI 10.1002/pola.10090. Bibcode 2002JPoSA..40..192K.
- ↑ Richard Hoogenboom. Poly(2-oxazoline)s: A Polymer Class with Numerous Potential Applications. Angewandte Chemie International Edition. 2009-10-12, s. 7978–7994. DOI 10.1002/anie.200901607. PMID 19768817.
- ↑ Nico Adams; Ulrich S. Schubert. Poly(2-oxazolines) in biological and biomedical application contexts. Advanced Drug Delivery Reviews. 2007, s. 1504–1520. Dostupné online. DOI 10.1016/j.addr.2007.08.018. PMID 17904246.
- ↑ Andrew M. Kelly; Frank Wiesbrock. Strategies for the Synthesis of Poly(2-Oxazoline)-Based Hydrogels. Macromolecular Rapid Communications. 2012-10-15, s. 1632–1647. DOI 10.1002/marc.201200333. PMID 22811405.
Související články
[editovat | editovat zdroj]- Benzoxazol: oxazolinový kruh spojený s benzenovým
- Oxazol: obdobná sloučenina obsahující dvě dvojné vazby
- Oxazolidin: neobsahuje násobné vazby
- Thiazolin: sloučenina odvozená od oxazolinu náhradou kyslíkového atomu sírou
- Aminorex: léčivo, jehož molekula obsahuje oxazolinový kruh
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Oxazolin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Oxazolin na Wikimedia Commons