Halogenace
Halogenace je chemická reakce, kterou se zavádí halogen do molekuly organických sloučenin za vzniku halogenderivátů. Obecně to jsou všechny reakce, při kterých se vytváří vazba uhlík-halogen. Podle halogenu (fluor F2, chlor Cl2, brom Br2, jod I2) vstupujícího do reakce se halogenace detailněji nazývá fluorace, chlorace, bromace a jodace. Opačnou reakcí je dehalogenace, kdy je atom halogenu z molekuly odstraněn.
Halogenace probíhá především reakcí elementárních halogenů, solí halogenidů nebo halogenových kyselin s organickými sloučeninami. Nejvhodnějšími sloučeninami pro halogenaci jsou alkoholy, neboť jsou ze všech substrátů nejdostupnější.
Halogenderiváty
[editovat | editovat zdroj]Výsledkem halogenace jsou halogenderiváty. Ty hrají významnou úlohu jako alkylační a arylační činidla při zavádění uhlíkatých řetězců do organických molekul, neboť halogenidové ionty se snadno oddělují. Z těchto důvodů obvykle halogenderiváty nepředstavují koncové produkty, ale meziprodukty pro další reakce. Například při reakci halogenu s alkenem dochází k rozštěpení π-vazby a vzniku halogenalkanu, který je reaktivnější než původní uhlovodík. Halogeny jsou pak dobrou odstupující skupinou v dalších reakcích, například nukleofilních alifatických substitucích a eliminačních reakcích.
Z technického hlediska je pro výrobu halogenderivátů důležitá dostupnost substrátu, jeho struktura nebo přítomnost dalších funkčních skupin, které by mohly reakci pozitivně ovlivnit. Řada halogenderivátů je v dnešní době vyráběna průmyslově, například nejrůznější polymery nebo léčiva.
Metody halogenace
[editovat | editovat zdroj]Metody halogenace nebo také syntézy halogenderivátů jsou velmi rozmanité, nejdůležitější jsou dva typy reakcí:
- adiční reakce (AE, AR)
- substituční reakce (SN, SE, SR)
Adiční reakce
[editovat | editovat zdroj]Adice halogenů na alkyny a alkeny
[editovat | editovat zdroj]Adice halogenů na alkyny a alkeny je reakce, při níž vznikají halogenalkeny nebo halogenalkany. Například reakce alkynů s bromem probíhá ve dvou krocích:
V prvním kroku z bromu a ethynu vzniká dibromethen:

Ve druhém kroku z dibromethenu vzniká tetrabromethan:

Adice halogenovodíků na alkeny nebo alkyny
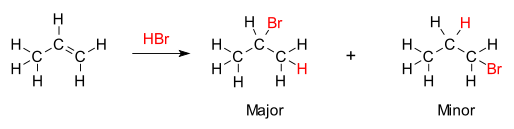
[editovat | editovat zdroj]Adice halogenovodíků na alkeny nebo alkyny je reakcí, při které vznikají halogenalkeny nebo halogenalkany. Příkladem je adiční reakce kyseliny chlorovodíkové s butenem za vzniku chlorbutanu:
Adice halogenovodíků HX (X= F, Cl, Br, I) na alkyny a alkeny je jednou z nejstarších metod pro snadnost adice halogenovodíků na jednoduché alkeny. Její význam je však limitován nežádoucími vedlejšími reakcemi. Pro adiční reakci halogenovodíků s alkeny platí Markovnikovovo pravidlo:
Substituční reakce
[editovat | editovat zdroj]Substituční halogenace alkanů
[editovat | editovat zdroj]Halogenace alkanů probíhá jako radikálová substituce nebo přesněji radikálová halogenace. K tvorbě radikálů se nejčastěji využívá ultrafialové záření. Reakce obvykle probíhá u alkanů a alkylovaných arenů. Radikálovou halogenací se vyrábí například chloroform, dichlormethan a hexachlorbutadien. Příkladem radikálové halogenace je reakce chloru s methanem:
Substituční halogenace ketonů a aldehydů
[editovat | editovat zdroj]Halogenace ketonů a aldehydů probíhá jako elektrofilní substituční reakce. Příkladem může být reakce obecného ketonu s bromem:
Substituční halogenace aromatických látek
[editovat | editovat zdroj]Halogenace aromatických sloučenin probíhá jako elektrofilní aromatická substituce. Příkladem je chlorace benzenu. Chlor reaguje s benzenem za přítomnosti Lewisovy kyseliny a vzniká chlorbenzen a chlorovodík. Jako Lewisova kyselina se používá chlorid železitý nebo chlorid hlinitý. Tyto sloučeniny aktivují chlor, který by jinak s benzenem nereagoval. Reakce s bromem je analogická.
Další substituční halogenace
[editovat | editovat zdroj]Pro zavedení halogenu do řetězce derivátů uhlovodíků se využívají například tyto reakce:
- nukleofilní substituce kyslíkaté skupiny v alkoholech, etherech a karboxylových kyselinách
- elektrofilní substituce v karbonylových sloučeninách a karboxylových kyselinách
Příklady halogenací
[editovat | editovat zdroj]Jednoduchou halogenací je například příprava chloridu zlatitého chlorací zlata. Mezi specifičtější halogenační metody patří Hunsdieckerových reakce (z karboxylových kyselin) a Sandmeyerova reakce (arylhalogenidy).
Syntéza halothanu
[editovat | editovat zdroj]Příkladem halogenace je organická syntéza anestetika halotanu z trichlorethylenu, která jako druhý krok zahrnuje bromaci při vysoké teplotě:[1]

Chlorace methanu
[editovat | editovat zdroj]Chlorace methanu nebo také obecněji radikálová halogenace probíhá ve třech krocích:
1. Iniciace (zahájení, vznik radikálů)
- Cl2 → 2 Cl*
2. Propagace (šíření reakce)
- Cl* + CH4 → HCl + H3C*
- H3C* + Cl2 → CH3Cl + Cl*
3. Terminace (ukončení)
- 2 Cl* → Cl2
- Cl* + H3C* → CH3Cl
- H3C* + H3C* → CH3CH3
Reference
[editovat | editovat zdroj]V tomto článku byly použity překlady textů z článků Halogenation na anglické Wikipedii a Halogenierung na německé Wikipedii.
- ↑ Synthesis of essential drugs, Ruben Vardanyan, Victor Hruby; Elsevier 2005 ISBN 0-444-52166-6
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu halogenace na Wikimedia Commons
Obrázky, zvuky či videa k tématu halogenace na Wikimedia Commons