Chirální pomocník
Chirální pomocník (chirální pomocná skupina) je funkční skupina nebo molekula, která může vytvořit chirální centrum, které je následně zabudováno do sloučeniny za účelem dosažení požadované stereoselektivity.[1][2] Chiralita obsažená v molekule, která je jako pomocník použita, ovlivňuje stereoselektivitu jedné nebo několika dalších reakcí. Chirální pomocníky je obvykle možné obnovit a poté použít znovu.

Většina biomolekul a léčiv se vyskytuje jako jeden ze dvou možných enantiomerů, a tak je důležité připravovat tyto látky v enantiomerně čisté podobě.[3] Jedním ze způsobů, jak získat čisté enantiomery, jsou právě chirální pomocníci.[4]
Používání chirálních pomocníků zavedli v roce 1975 Elias James Corey[5] (šlo o chirální 8-fenylmenthol) a v roce 1980 Barry Trost (který použil chirální kyselinu mandlovou). Derivát mentholu se obtížně připravuje; roku 1985 objevil J. K. Whitesell trans-2-fenyl-1-cyklohexanol, který je jeho možnou náhradou.
Využití v asymetrické syntéze
[editovat | editovat zdroj]Chirální pomocníci se používají jako součásti procesů, při kterých má být regulována stereochemie produktů. Při syntéze makrolidu cytovaricinu, kterou navrhl David A. Evans, považované za klasickou reakci s využitím chirálního pomocníka, se využívá chirální derivát oxazolidinonu při jedné asymetrické alkylaci a čtyřech asymetrických aldolových reakcích, čímž se nastaví absolutní stereochemie na devíti stereocentrech.[6]

Stereoselektivní syntéza s využitím chirálních pomocníků se obvykle skládá ze tří částí. V první se chirální pomocník kovalentně naváže na substrát, v druhé u takto vytvořené sloučeniny proběhne jedna nebo více stereoselektivních reakcí a ve třetí je chirální pomocník odstraněn za podmínek, při kterých nedochází k racemizaci produktu.[4] Kvůli nákladům na použití stechiometrických množství chirálních pomocníků, provádění několika mezireakcí a následnému odstraňování chirálních pomocníků je celý proces zdánlivě neefektivní, ovšem v mnoha případech jde o jediný možný způsob stereoselektivní přípravy dané látky. Procesy se zapojením chirálních pomocníků jsou podrobně prozkoumané a lze je použít v mnoha případech, a tak jsou často časově nejméně náročnými způsoby přípravy enantiomerně čistých produktů.[2]
Produkty takovýchto procesů jsou navíc diastereomery,[7] díky čemuž je možné je poměrně snadno oddělit například sloupcovou chromatografií nebo krystalizací.
8-fenylmenthol
[editovat | editovat zdroj]Jedním z prvních využití chirálních pomocníků byla asymetrická Dielsova–Alderova reakce akrylátového esteru (−)-8-fenylmentholu s 5-benzyloxymethylcyklopemtadienem.[5] Produkt této reakce byl přeměněn na jodlakton, meziprodukt Coreyovy symtézy prostaglandinů. Zadní strana molekuly akrylátu je blokována chirálním pomocníkem, díky čemuž cykloadice probíhá na přední straně.

8-fenylmenthol lze připravit z některého z enantiomerů pulegonu,[8] ovšem tento postup není příliš účinný. Vzhledem k širokým možnostem využití tohoto postupu byly vyvinuty i jiné látky využitelné tímto způsobem, například trans-2-fenyl-1-cyklohexanol.[9]
1,1’-Binaftyl-2,2’-diol (BINOL)
[editovat | editovat zdroj]1,1’-Binaftyl-2,2’-diol (zkráceně BINOL) se používá jako chirální pomocník od roku 1983.[10][11]

Hisaši Jamamoto použil (R)-BINOL jako chirálního pomocníka při asymetrické syntéze limonenu, jednoho z cyklických monoterpenů. (R)-BINOLmonoerylether byl připravem monosilylací a alkylací (R)-BINOLu. Následně byla provedena redukce organohlinitým činidlem a vznikl limonen, výtěžnost reakce činila 29 % a enantiomerní přebytek měl hodnotu 64 %.[11]

Enantiomerně čisté R-aminokyseliny lze připravit alkylací chirálních derivátů glycinu s využitím axiálně chirálního BINOLu. V závislosti na použitém elektrofilu se diastereomerní přebytek pohybuje od 69 do 86 %.[12]

Navázání BINOLu jakožto chránicí skupiny na aldehyd umožňuje diastereoselektivní reakce arylglyoxalů s Grignardovými činidly za vzniku chráněného atrolaktaldehydu se středním až vysokým diastereomerním přebytkem a dobrou výtěžností.[13]

Trans-2-fenylcyklohexanol
[editovat | editovat zdroj]
Dalšími látkami, které mohou být použity jako chirální pomocníci, jsou trans-2-fenylcyklohexanol a jeho deriváty. Lze je použít při enových reakcích esterů kyseliny glyoxalové.[14]

Při totální syntéze (−)-heptemeronu B a (−)-guanakastepenu E reaguje kyselina glyoxalová, na kterou je navázán trans-2-fenylcyklohexanol, s 2,4-dimethyl-pent-2-enem za přítomnosti chloridu cíničitého a vytváří jako hlavní produkt anti-adukt, který je požadovaným hlavním produktem, a syn-adukt v molárním poměru 10:1.[15]
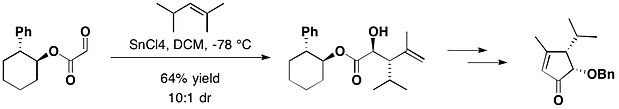
Při nahrazení fenylové skupiny tritylovou (tedy použití trans-2-tritylcyklohexanolu) je diastereoselektivita reakce ještě vyšší. Pomocí této látky lze provést oxidační cyklizaci řízenou chirálním manganistanem.[16]

Oxazolidinony
[editovat | editovat zdroj]Chirální pomocníky odvozené od oxazolidinonu, které zavedl David A. Evans, lze použít při mnoha různých stereoselektivních syntézách, jako jsou aldolové reakce,[17] alkylace[18] a Dielsovy–Alderovy reakce.[19][20] Oxazolidinony zde bývají substituovány na pozicích 4 nebo 5. I přes vliv sterických efektů se dají použít při substitucích mnoha různých skupin. Snadno se odstraňují, například hydrolýzou.
Příprava
[editovat | editovat zdroj]Oxazolidinony se připravují z aminokyselin nebo aminoalkoholů.

Acylace oxazolidinonů se provádí deprotonací pomocí n-butyllithia a následnou reakcí s acylchloridem.

Využití při alkylacích
[editovat | editovat zdroj]Deprotonací oxazolidinonimidů na α uhlíku pomocí silných zásad, jako je diisopropylamid lithný, selektivně vznikají Z-enoláty, u kterých lze poté provést stereoselektivní alkylaci.

Velmi vhodnými substráty pro takovéto reakce jsou aktivované elektrofily, jako například allyl- a benzylhalogenidy.
Využití při aldolových reakcích
[editovat | editovat zdroj]Chirální oxazolidinony se nejčastěji používají při stereoselektivních aldolových reakcích.
Mírnou enolizací Lewisovou kyselinou dibutylbortriflátem a zásadou diisopropylethylaminem se vytváří Z-enolát, u něhož posléze dojde k diastereoselektivní aldolové reakci s aldehydem.

Kamforsultam
[editovat | editovat zdroj]Kamforsultam, také nazývaný Oppolzerův sultam, se také používá jako chirální pomocník.

Při totální syntéze manzacidinu B se používá k asymetrické tvorbě oxazolinového cyklu. Na rozdíl od oxazolidinonových chirálních pomocníků má kamforsultam výraznou (2S,3R)-selektivitu.[21]

Také se používá při Michaelových reakcích. Stereoselektivní Michaelovou adicí thiolů na N-methakryloylkamforsultam za přítomnosti organolithné zásady vznikají produkty s vysokou diastereoselektivitou.[22]

Kamforsultam může být chirálním pomocníkem i u asymetrických Claisenových přesmyků. Za přítomnosti butylhydroxytoluenu zachytávajícího volné radikály se toluenový roztok aduktu geraniolu s kamforsultamem zahřívá v uzavřené nádobě při 140 °C, přičemž je hlavním produktem (2R,3S)-izomer se 72% výtěžností, přičemž jsou zachována obě stereocentra.[23]

Pseudoefedrin
[editovat | editovat zdroj](R,R)-, i (S,S)-pseudoefedrin lze použít jako chirální pomocníky.[24] Pseudoefedrin reaguje s karboxylovými kyselinami, jejich anhydridy a halogenidy za vzniku pseudoefedrinamidu.
Z karbonylových sloučenin lze snadno odštěpit α protony pomocí nenukleofilních zásad za tvorby enolátů, které se mohou účastnit dalších reakcí. Stereochemie vzniklé adiční sloučeniny (například s halogenalkanem) je řízena methylovou skupinou. Jakýkoliv adukt vytvořený tímto způsobem tak bude v poloze syn- vůči methylové a anti- vůči hydroxylové skupině. Pseudoefedrin se následně odstraní rozštěpením amidové vazby vhodným nukleofilem.
Příprava
[editovat | editovat zdroj]Lze zakoupit oba enantiomery pseudoefedrinu. Racemát se prodává jako dekongesční léčivo Sudafed. Protože jej lze použít na výrobu metamfetaminu, tak je jeho prodej pro výzkumné účely regulován; alternativou může být při alkylačních reakcích použití pseudoefenaminových chirálních pomocníků.[25] Pseudoefenamin není snadno komerčně dostupný, ale dá se připravit z benzilu a nelze z něj získat amfetaminy.[26]
Pseudoefedrinamidy se obvykle připravují acylací pomocí acylhalogenidů nebo acylanhydridů.[27]
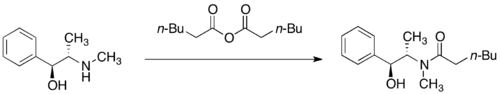
Alkylační reakce
[editovat | editovat zdroj]Pseudoefedriamidy jaou deprotonovány silnými zásadami, jako je například diisopropylamid lithný, na příslušné (Z)-enoláty. Alkylace těchto lithných enolátů je vysoce stereoselektivní.

Diastereoselektivita je důsledkem toho, že molekuly lithných alkoxidů jsou zde z jedné strany blokovány sekundárními alkoxidy a molekulami rozpouštědla spojenými s lithnými kationty. Diastereoselektivita reakce závisí na množství chloridu lithného a na druhu rozpouštědla (tím nejčastěji bývá tetrahydrofuran). Obvykle stačí k nasycení roztoku enolátu 4 až 6 ekvivalentů chloridu lithného.
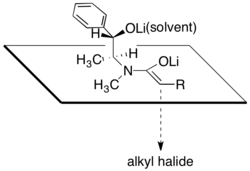
Jedna z výhod provádění asymetrických alkylací pomocí pseudoefedrinamidů spočívá v tom, že amidy enolátů jsou většinou dostatečně silnými nukleofily, aby reagovaly s primárními a sekundárními halogenidy při teplotách od 78 °C do 0 °C. Kvartérních uhlíková centra lze také vytvářet také alkylací α rozvětvených amidenolátů, i když při použití méně reaktivních elektrofilů je potřeba přidat do reakční směsi N,N′-dimethylpropylenmočovinu.[28]
Odstranění
[editovat | editovat zdroj]Za vhodných podmínek mohou být pseudoefedrinamidy přeměněny na enantiomerně čistší karboxylové kyseliny, alkoholy, aldehydy a ketony.
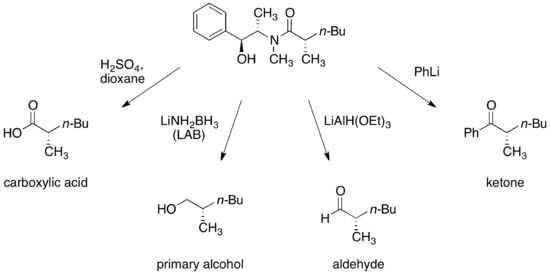
Následně může být chirální pomocník obnoven a znovu použit.
Terc-butansulfinamid
[editovat | editovat zdroj]Terc-butansulfinamid je sulfinamid, jehož možné využití při asymetrické syntéze objevil a významně rozvinul Jonathan A. Ellman.[29][30] Tato látka tak bývá často nazývána Ellmanův chirální pomocník nebo Ellmanův sulfinamid.

Příprava
[editovat | editovat zdroj]Z terc-butyldisulfidu lze připravit oba enantiomery terc-butansulfinamidu, a to ve dvou krocích: nejprve katalytickou asymetrickou oxidací vznikne, s vysokou výtěžností i velkým enantiomerním přebytkem, disulfid, jenž následně reaguje s amidem lithným v amoniaku za vzniku enantiomerně čistého produktu s opačnou konfigurací.

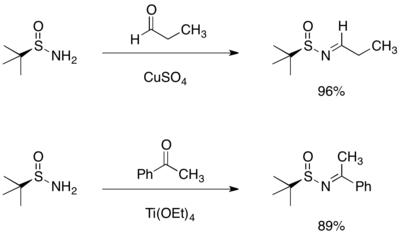
Kondenzace terc-butansulfinamidu s aldehydy a ketony mívají vysokou výtěžnost a vytvářejí pouze (E)-izomer příslušného N-sulfinyliminu.
SAMP/RAMP
[editovat | editovat zdroj]Dieter Enders a Elias James Corey objevili a rozvinuli alkylační reakce chirálních látek (S)-1-amino-2-methoxymethylpyrrolidinu (SAMP) a (R)-1-amino-2-methoxymethylpyrrolidinu (RAMP).[31][32]
Příprava
[editovat | editovat zdroj]SAMP se připravuje v šesti krocích z (S)-prolinu a RAMP z kyseliny (R)-glutamové.

Alkylace
[editovat | editovat zdroj]Kondenzací SAMPu nebo RAMPu s aldehydy a ketony vznikají (E)-hydraziny. Následná deprotonace diisopropylamidem lithným a přidání alkylhalogenidu vedou k tvorbě alkylovaného produktu; chirální pomocník může být odstraněn hydrolýzou nebo ozonolýzou.

Využití v průmyslu
[editovat | editovat zdroj]Chirální pomocníky lze obvykle použít při velkém počtu různých asymetrických syntéz. Používají se například při výrobě léčiv.[2]
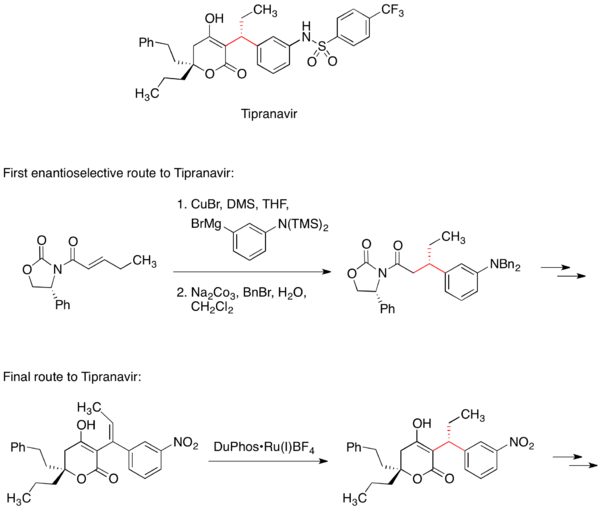
Tipranavir
[editovat | editovat zdroj]Tipranavir je inhibitor proteázy HIV používaný na léčbu AIDS. První enantioselektivní metoda výroby této látky zahrnovala konjugovanou adici Gilmanova činidla na chirální Michaelův akceptor.[33] Chirální oxazolidinon v Michaelově akceptoru určuje stereochemii jednoho či dvou stereocenter molekuly.
Později vyvinutý postup výroby Tipranaviru neobsahuje reakci s chirálním pomocníkem, místo toho se stereocentrum vytvoří asymetrickou hydrogenací.[34]
Atorvastatin
[editovat | editovat zdroj]Vápenatá sůl atorvastatinu se, prodávaná pod obchodním názvem Lipitor, používá ke snížení koncentrace cholesterolu v krvi. Při první známé metodě asymetrické syntézy atorvastatinu byla využita diastereoselektivní aldolová reakce chirálního esteru při tvorbě jednoho ze dvou alkoholových stereocenter.[35] Při průmyslové výrobě vzniká toto stereocentrum pomocí kyseliny isoaskorbové.[36]

Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Chiral auxiliary na anglické Wikipedii.
- ↑ Key Chiral Auxiliary Applications (Second Edition)(ed.: Roos, G.), Academic Press, Boston, 2014. ISBN 978-0-12-417034-6
- ↑ a b c F. Glorius; Y. Gnas. Chiral Auxiliaries — Principles and Recent Applications. Synthesis. 2006, s. 1899–1930.
- ↑ Fakhreddin Jamali. Drug Stereochemistry: Analytical Methods and Pharmacology. Příprava vydání Irving W. Wainer. [s.l.]: Marcel Dekker, Inc., 1993. Dostupné online. ISBN 978-0-8247-8819-3. Kapitola Chapter 14: Stereochemically Pure Drugs: An Overview, s. 375–382.
- ↑ a b D. A. Evans; G. Helmchen; M. Rüping. Asymmetric Synthesis — The Essentials. Příprava vydání M. Christmann. [s.l.]: Wiley-VCH Verlag GmbH & Co., 2007. Dostupné online. ISBN 978-3-527-31399-0. Kapitola Chiral Auxiliaries in Asymmetric Synthesis, s. 3–9.
- ↑ a b E. J. Corey; H. E. Ensley. Preparation of an Optically Active Prostaglandin Intermediate via Asymmetric Induction. Journal of the American Chemical Society. 1975, s. 6908–6909. PMID 1184891.
- ↑ K. C. Nicolau. Classics in Total Synthesis. New York, New York: Wiley-VCH, 2008. ISBN 978-3-527-29231-8. S. 485–508.
- ↑ J. P. Miller. ChemInform Abstract: Recent Advances in Asymmetric Diels-Alder Reactions. Synthesis. 2013.
- ↑ E. J. Corey; H. E. Ensley; C. A. Parnell. Convenient Synthesis of a Highly Efficient and Recyclable Chiral Director for Asymmetric Induction. The Journal of Organic Chemistry. 1978, s. 1610–1611.
- ↑ D. L. Comins; J. D. Salvador. Efficient Synthesis and Resolution of trans-2-(1-Aryl-1-methylethyl)cyclohexanols: Practical Alternatives to 8-P henylmenthol. The Journal of Organic Chemistry. 1993, s. 4656–4661.
- ↑ Jean Michel Brunel. BINOL: A Versatile Chiral Reagent. Chemical Reviews. 2005, s. 857–898. PMID 15755079.
- ↑ a b Soichi Sakane; Junya Fujiwara; Keiji Maruoka; Hisashi Yamamoto. Chiral leaving group. Biogenetic-type asymmetric synthesis of limonene and bisabolenes. Journal of the American Chemical Society. 1983, s. 6154–6155.
- ↑ Kiyoshi Tanaka; Mija Ahn; Yukari Watanabe; Kaoru Fuji. Asymmetric synthesis of uncommon α-amino acids by diastereoselective alkylations of a chiral glycine equivalent. Tetrahedron: Asymmetry. 1996-06-01, s. 1771–1782.
- ↑ Paola Maglioli; Ottorino De Lucchi; Giovanna Delogu; Giovanni Valle. Highly diastereoselective reduction and addition of nucleophiles to binaphthol-protected arylglyoxals. Tetrahedron: Asymmetry. 1992-01-01, s. 365–366.
- ↑ George Buchi; Dennis E. Vogel. A new method for the preparation of γ,δ-unsaturated ketones via Claisen rearrangement. The Journal of Organic Chemistry. 1985, s. 4664–4665.
- ↑ Aubry K. Miller; Chambers C. Hughes; Joshua J. Kennedy-Smith; Stefan N. Gradl; Dirk Trauner. Total Synthesis of (−)-Heptemerone B and (−)-Guanacastepene E. Journal of the American Chemical Society. 2006, s. 17057–17062. PMID 17177458.
- ↑ trans-2-Tritylcyclohexanol as a Chiral Auxiliary in Permanganate-Mediated Oxidative Cyclization of 2-Methylenehept-5-enoates: Application to the Synthesis of trans-(+)-Linalool Oxide. Organic Letters. 2014, s. 5104–5107. PMID 25225741.
- ↑ D. A. Evans; J. Bartroli; T. L. Shih. Enantioselective aldol condensations. 2. Erythro-selective chiral aldol condensations via boron enolates. Journal of the American Chemical Society. 1981, s. 2127–2129.
- ↑ D. A. Evans; M. D. Ennis; D. J. Mathre. Asymmetric Alkylation Reactions of Chiral Imide Enolates. A Practical Approach to the Enantioselective Synthesis of a-Substituted Carboxylic Acid Derivatives. Journal of the American Chemical Society. 1982, s. 1737–1739.
- ↑ D. A. Evans; K. T. Chapman; J. Bisaha. New Asymmetric Diels-Alder Cycloaddition Reactions. Chiral α,β-Unsaturated Carboximides as Practical Chiral Acrylate and Crotonate Dienophile Synthons. Journal of the American Chemical Society. 1984, s. 4261–4263.
- ↑ D. A. Evans; K. T. Chapman; D. T. Hung; A. T. Kawaguchi. Transition State π-Solvation by Aromatic Rings: An Electronic Contribution to Diels-Alder Reaction Diastereoselectivity. Angewandte Chemie International Edition. 1987, s. 1184–1186.
- ↑ Tetsuro Shinada; Kentaro Oe; Yasufumi Ohfune. Efficient total synthesis of manzacidin B. Tetrahedron Letters. 2012-06-27, s. 3250–3253.
- ↑ Wen-Jiuan Tsai; Yi-Tsong Lin; Biing-Jiun Uang. Asymmetric Michael addition of thiols to (1R,2R,4R)-(−)-2,10-N-enoylcamphorsultam. Tetrahedron: Asymmetry. 1994-07-01, s. 1195–1198.
- ↑ Ken-ichi Takao; Shu Sakamoto; Marianne Ayaka Touati; Yusuke Kusakawa; Kin-ichi Tadano. Asymmetric Construction of All-Carbon Quaternary Stereocenters by Chiral-Auxiliary-Mediated Claisen Rearrangement and Total Synthesis of (+)-Bakuchiol. Molecules. 2012-11-08, s. 13330–13344. PMID 23138536.
- ↑ Pseudoephedrine as a Practical Chiral Auxiliary for the Synthesis of Highly Enantiomerically Enriched Carboxylic Acids, Alcohols, Aldehydes, and Ketones. Journal of the American Chemical Society. 1997, s. 6496–6511.
- ↑ A. G. Myers; M. R. Morales; K. T. Mellem. Pseudoephenamine: A Practical Chiral Auxiliary for Asymmetric Synthesis. Angewandte Chemie. 2012, s. 4646–4649. Dostupné online. PMID 22461381.
- ↑ Kevin T. Mellem; A. G. Myers. A Simple, Scalable Synthetic Route to (+)- and (−)-Pseudoephenamine. Organic Letters. 2013, s. 5594–5597. ISSN 1523-7060. PMID 24138164.
- ↑ A. G. Myers; B. H. Yang; L. McKinstry; D. J. Kopecky; J. L. Gleason. Pseudoephedrine as a Practical Chiral Auxiliary for the Synthesis of Highly Enantiomerically Enriched Carboxylic Acids, Alcohols, Aldehydes, and Ketones. Journal of the American Chemical Society. 1997, s. 6496–6511.
- ↑ D. A. Kummer; W. J. Chain; M. R. Morales; O. Quiroga; A. G. Myers. Stereocontrolled Alkylative Construction of Quaternary Carbon Centers. Journal of the American Chemical Society. 2008, s. 13231–13233. PMID 18788739.
- ↑ Guangcheng Liu; Derek A. Cogan; Jonathan A. Ellman. Catalytic Asymmetric Synthesis of tert -Butanesulfinamide. Application to the Asymmetric Synthesis of Amines. Journal of the American Chemical Society. 1997, s. 9913–9914. ISSN 0002-7863.
- ↑ Jonathan A. Ellman; T. D. Owens; T. P. Tang. N-tert-Butanesulfinyl Imines: Versatile Intermediates for the Asymmetric Synthesis of Amines. Accounts of Chemical Research. 2002, s. 984–995. PMID 12437323.
- ↑ Elias James Corey; Dieter Enders. Applications of N,N-dimethylhydrazones to synthesis. Use in efficient, positionally and stereochemically selective C-C bond formation; oxidative hydrolysis to carbonyl compounds. Tetrahedron Letters. 1976, s. 3–6.
- ↑ L. Kurti; B. Czako. Strategic Applications of Named Reactions in Organic Synthesis. Burlington, MA: Elsevier Academic Press, 2005. ISBN 978-0-12-369483-6. S. 150–151.
- ↑ Tipranavir (PNU-140690): A Potent, Orally Bioavailable Nonpeptidic HIV Protease Inhibitor of the 5,6-Dihydro-4-hydroxy-2-pyrone Sulfonamide Class. Journal of Medicinal Chemistry. 1998, s. 3467–3476. PMID 9719600.
- ↑ Stéphane Caron. Practical Synthetic Organic Chemistry. [s.l.]: John Wiley & Sons, Inc., 2011. Dostupné online. ISBN 978-0-470-03733-1. Kapitola Chapter 15: Synthetic Route Development of Selected Contemporary Pharmaceutical Drugs, s. 666–670.
- ↑ Inhibitors of Cholesterol Biosynthesis. 3. Tetrahydro-4-hydroxy-6-[2-(lH-pyrrol-l-yl)ethyl]-2H-pyran-2-one Inhibitors of HMG-CoA Reductase. 2. Effects of Introducing Substituents at Positions Three and Four of the Pyrrole Nucleus. Journal of Medicinal Chemistry. 1991, s. 357–366. PMID 1992137.
- ↑ Jie Jack Li; Douglas S. Johnson; Drago R. Sliskovic; Bruce D. Roth. Contemporary Drug Synthesis. [s.l.]: John Wiley & Sons, Inc., 2004. Dostupné online. ISBN 978-0-471-21480-9. Kapitola Chapter 9. Atorvastatin Calcium (Lipitor), s. 113–125.
