Polyyny

Polyyny (též polyacetyleny, i když tento název přesněji odpovídá polymerům acetylenu) jsou organické sloučeniny obsahující více než jednu trojnou vazbu mezi atomy uhlíku;[1] někdy se také používají pojmy oligoyny,[2] nebo karbinoidy podle molekuly karbynu, (-C≡)n, jež je hypotetickým alotropem uhlíku[3][4] a jehož příprava byla oznámena několikrát od 60. let 20. století, ovšem všechny tyto přípravy jsou sporné.[5] Látky identifikované jako krátké řetězce „karbynu“, vzniklé při některých organických syntézách[6] se dnes považují za polyyny.
Nejjednodušším polyynem je butadiyn neboli diacetylen, HC≡C-C≡CH . Podobně jako kumuleny se polyyny vyznačují stálostí a vysokou vodivostí,[7] což je činí využitelnými jako materiály na dráty v molekulárních nanotechnologiích. Polyyny byly nalezeny v mezihvězdných molekulárních mračnech s malým zastoupením vodíku.[zdroj?]
Příprava[editovat | editovat zdroj]
První přípravu polyynu popsal Carl Andreas Glaser v roce 1869, když zjistil, že fenylacetylid měďný (CuC≡C-C6H5) se na vzduchu oxidačně dimerizuje za vzniku difenylbutadiynu (C6H5-C≡C-C≡C-C6H5).[4]
Později bylo objeveno několik dalších způsobů přípravy polyynů. Nejčastěji využívaná jsou homopárování acetylenů, například Glaserovo, Elintonovo, nebo Hayovo.[8][4] Součástí řady z těchto postupů je Cadiotovo–Chodkiewiczovo párování nebo podobná reakce, kde se spojují dvě molekuly alkynů nebo se alkylují již vytvořené polyyny.[9] Při syntéze polyynu s nejdelším známým řetězcem, obsahujícím 44 atomů uhlíku, byl použit Fritschův–Buttenbergův–Wiechellův přesmyk.[10] Posledním krokem v syntézách nejdelších známých polyynů zakončených fenylovými skupinami jsou eliminace chlorvinylsilanů.[11]
Organické a organokřemíkové polyyny[editovat | editovat zdroj]
V 50. letech 20. století byly několika postupy získány různé polyyny typu H(-C≡C-)nH pro n až 4-5.[12] V roce 1971 [byly vyvinuty molekuly zakončené skupinami –SiR3, kde R byla obvykle ethylová skupina, které chránily polyynové řetězce před zdvojováním řetězce. Přípravy probíhaly za přítomnosti Hayova katalyzátoru (komplexu Cu+–TMEDA).[12][13] Takto lze vytvořit polyyny typu (CH3CH2)3Si(-C≡C-)nSi(CH2CH3)3 s n až 8 v pevné podobě a až 16 v roztoku. Později se podařilo připravit ((CH3)2CH)3Si(-C≡C-)nSi(CH(CH3)2)3 obsahující i 20uhlíkové řetězce.[14]
V roce 2002 byl izolován polyyn obsahující 10 acetylenových jednotek (20 uhlíků), na jehož konce byly navázány molekuly Fréchetova aromatického polyetherového dendrimeru.[2] Byla rovněž popsána příprava dikyanopolyynů obsahujících až 8 acetylenových jednotek.[15] Roku 2007 se podařilo vytvořit nový nejdelší polyyn zakončení fenylovými skupinami.[11] Nejdelší polyyn izolovaný do roku 2010 obsahoval 22 acetylenů (44 uhlíků), na jeho konce byly navázány tris(3,5-di-t-butylfenyl)methyly.[10]
Alkyny odpovídající vzorcům H(-C≡C-)nH (n = 2 až 6) lze nalézt ve směsi produktů rozkladu acetylidu měďného částečně oxidovaného kyselinou chlorovodíkovou. Strukturu typu (-C≡C-)n naznačuje i spektrum uhlíkatého produktu.[16]

Organokovové polyyny[editovat | editovat zdroj]
Jsou známy organokovové polyyny s navázanými komplexy kovů. Nejvíce zkoumané jsou příslušné komplexy rhenia (Re(-C≡C-)nRe, n = 3–10),[17] ruthenia (RuRu(-C≡C-)nRuRu, n = 4–10),[18] železa (Fe(-C≡C-)6Fe),[19] platiny (Pt(-C≡C-)nPt, n = 8–14),[20] palladia (Ar(-C≡C-)nPd, n = 3–5, Ar = aryl),[21] a kobaltu (Co3C(-C≡C-)nCCo3, n = 7–13)[22].

Stabilita[editovat | editovat zdroj]
Dlouhé polyynové řetězce jsou nestálé, protože u nich dochází k exotermickému překřižovávání.[5] Tyto reakce mohou končit i výbuchy.[23] Stabilnější, a to i vůči vlhkosti a kyslíku, mohou být, jestliže se koncové vodíky nahradí vhodnými funkčními skupinami, jako je terc-butyl nebo trifluormethyl.[24] Objemné koncové skupiny mohou jednotlivé řetězce držet od sebe, což polyyny stabilizuje;[2] v roce 1995 bylo oznámeno, že se takto podařilo vytvořit karbynové řetězce obsahující i 300 atomů uhlíku,[24] ovšem objevily se námitky, že mělo ve skutečnosti jít o molekuly podobné fullerenům.[5]
Polyyny lze stabilizovat vůči teplu, pokud jsou deponovány spolu s nanočásticemi stříbra[25] a komplexovány s tridentátními ligandy obsahujícími rtuť, jež fungují jako Lewisovy kyseliny.[26] Dlouhé polyyny uzavřené v dvoustěnných uhlíkových nanotrubicích, nebo vytvářející rotaxany[27] jsou rovněž stálé.[28] Přestože bývají dlouhé polyyny nestálé, tak bylo popsáno využití některých z nich v organické a organokovové syntéze.[29]
Struktura[editovat | editovat zdroj]
Syntetické polyyny typu R(-C≡C-)nR (n = 8 nebo více) mají v krystalické podobě často zakřivené uhlíkové řetězce.[30] Pokud je skupinou R triisopropylsilyl a n je rovno 8, tak se v rentgenové krystalografii (oranžovo-žluté pevné látky) ukazuje oblouk o velikosti 25–30°, takže každý úhel C−C≡C je od přímého odchýlen o 3,1°. Vzdálenosti řetězců sousedních molekul jsou tak sníženy na 0,35 až 0,5 nm, což téměř dosahuje hodnot , u kterých lze očekávat samovolné překřižování. Za nízkých teplot je sloučenina neomezeně stálá, sle při zahřívání se rozkládá ještě před dosažením teploty tání; obdobné molekuly s n = 4 nebo 5 mají téměř rovné uhlíkové řetězce, vzdálené 0,5 až 0,7 nm a zahřívání u nich nevyvolává rozklad.[14]
Výskyt[editovat | editovat zdroj]
Biosyntéza a použití[editovat | editovat zdroj]
Polyyny vznikají v mnoha různých organismech.[1][31] Mohou sloužit k řadě účelů, například jako vůně, barviva, chemické odpuzovače a toxiny; nacházejí též možné využití v biomedicínském výzkumu a při výrobě léčiv. Z rostlin je obsahují zejména slunečnice, mrkev, ženšen a zvonek, nalézt se dají ale též v rajčatech, olaxovitých a santalovníku.[32] Prvním izolovaným polyynem byl v roce 1826 dehydromatrikariaester (DME); jeho struktura byla ale zjištěna až později.[1][33]

Z rostliny Paramacrolobium caeruleum (podčeleď Caesalpiniaceae) byla získána kyselina oktadeka-8,10-diynová, u níž bylo zjištěno, že může být fotopolymerizovatelnou jednotkou syntetických fosfolipidů.[9]

Thiarubrin B je nejrozšířenějším z několika pigmentů citlivých na světlo, které byly izolovány z Ambrosia trifida, rostliny využívané v medicíně. Thiarubriny mají antibiotické, antivirotické a nematocidní vlastnosti, a účinnost proti HIV-1, spouštěné při vystavení světlu.[34]
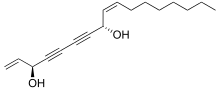

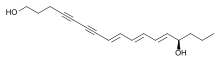
Falkarindiol se vyskytuje v mrkvi, celeru, fenyklu, petrželi a pastináku, kde mají cytotoxické účinky.[35] Alifatické 17uhlíkaté polyyny podobné falkarinolu mohou působit jako modulátory metabolismu.[36][37][38] Falkarindiol je hlavní látkou zprostředkující hořkou chuť mrkve a je nejaktivnějším z několika polyynů s možnými protinádorovými účinky nalezenými v oplopanaxu hrozivém (Oplopanax horridus). K dalším rostlinným polyynům patří enanthotoxin a cicutoxin, jedy nalezené u haluch (Oenanthe spp.) a rozpuků (Cicuta spp.).

Rostliny rodu Ichthyothere vytvářejí polyyn nazývaný ichthyothereol, který je vysoce toxický pro ryby a savce.[39] Listy Ichthyothere terminalis jsou domorodci z dolní Amazonie používány na výrobu otrávených nástrah.[39]

Kyselina Z-dihydromatrikariová je polyyn vylučovaný páteříčkovitými brouky jako chemická obrana.[40]
Ve vesmíru[editovat | editovat zdroj]
Oktatetraynylový a hexatriynylový radikál byly, společně s odpovídajícími ionty, nalezeny v molekulárních mračnech, kde je vodík vzácný.[41] Bylo navrženo[42] že by se polyyny mohly vyskytovat na Zemi na místech dopadu meteoritů, jako součást minerálu chaoitu.[43]
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Polyyne na anglické Wikipedii.
- ↑ a b c R. E. Minto; B. J. BLACKLOCK. Biosynthesis and function of polyacetylenes and allied natural products. Prog Lipid Res. July 2008, s. 233–306. DOI 10.1016/j.plipres.2008.02.002. PMID 18387369.
- ↑ a b c GIBTNER, Thomas; HAMPEL, Frank; GISSELBRECHT, Jean-Paul; HIRSCH, Andreas. End-cap stabilized oligoynes: Model compounds for the linear sp carbon allotrope carbyne. Chemistry: A European Journal. 2002, s. 408–432. DOI 10.1002/1521-3765(20020118)8:2<408::AID-CHEM408>3.0.CO;2-L. PMID 11843154.
- ↑ Carbyne and carbynoid structures. Redakce Heimann R. B.. [s.l.]: [s.n.], 1999. (Physics and Chemistry of Materials with Low-Dimensional Structures; sv. 21). ISBN 978-0-7923-5323-2. S. 452.
- ↑ a b c CHALIFOUX, Wesley A.; TYKWINSKI, Rik R. Synthesis of extended polyynes: Toward carbyne. Comptes Rendus Chimie. 2009, s. 341–358. DOI 10.1016/j.crci.2008.10.004. Avancés récentes en chimie des acétylènes
- ↑ a b c KROTO, H. Carbyne and other myths about carbon [online]. November 2010. Dostupné online.
- ↑ AKAGI, K.; NISHIGUCHI, M.; SHIRAKAWA, H.; FURUKAWA, Y.; HARADA, I. One-dimensional conjugated carbyne — synthesis and properties. Synthetic Metals. 1987, s. 557–562. DOI 10.1016/0379-6779(87)90798-3.
- ↑ BRYCE, Martin R. A review of functional linear carbon chains (oligoynes, polyynes, cumulenes) and their applications as molecular wires in molecular electronics and optoelectronics. Journal of Materials Chemistry C. 2021, s. 10524–10546. ISSN 2050-7526. DOI 10.1039/d1tc01406d. S2CID 235456429.
- ↑ JEVRIC, Martyn; NIELSEN, Mogens Brøndsted. Synthetic Strategies for Oligoynes. Asian Journal of Organic Chemistry. April 2015, s. 286–295. DOI 10.1002/ajoc.201402261.
- ↑ a b XU, Zhenchun; BYUN, Hoe Sup; BITTMAN, Robert. Synthesis of photopolymerizable long-chain conjugated diacetylenic acids and alcohols from butadiyne synthons. J. Org. Chem.. 1991, s. 7183–7186. DOI 10.1021/jo00025a045.
- ↑ a b CHALIFOUX, Wesley A.; TYKWINSKI, Rik R. Synthesis of polyynes to model the sp-carbon allotrope carbyne. Nature Chemistry. 2010, s. 967–971. DOI 10.1038/nchem.828. PMID 20966954. S2CID 24123099. Bibcode 2010NatCh...2..967C.
- ↑ a b SIMPKINS, Simon M. E.; WELLER, Michael D.; COX, Liam R. β-Chlorovinylsilanes as masked alkynes in oligoyne assembly: synthesis of the first aryl-end-capped dodecayne. Chemical Communications. 2007, s. 4035–7. DOI 10.1039/B707681A. PMID 17912407.
- ↑ a b EASTMOND, R.; JOHNSON, T. R.; WALTON, D. R. M. Silylation as a protective method for terminal alkynes in oxidative couplings: A general synthesis of the parent polyynes H(C≡C)nH (n = 4–10, 12). Tetrahedron. 1972, s. 4601–16. DOI 10.1016/0040-4020(72)80041-3.
- ↑ JOHNSON, T. R.; WALTON, D. R. M. Silylation as a protective method in acetylene chemistry: Polyyne chain extensions using the reagents, Et3Si(C≡C)mH (m = 1, 2, 4) in mixed oxidative couplings. Tetrahedron. 1972, s. 5221–36. DOI 10.1016/S0040-4020(01)88941-9.
- ↑ a b EISLER, Sara; SLEPKOV, Aaron D.; ELLIOTT, Erin; THANH LUU; MCDONALD, Robert; HEGMANN, Frank A.; TYKWINSKI, Rik R. Polyynes as a model for carbyne: Synthesis, physical properties, and nonlinear optical response. Journal of the American Chemical Society. 2005, s. 2666–76. DOI 10.1021/ja044526l. PMID 15725024.
- ↑ SCHERMANN, Günther; GRÖSSER, Thomas; HAMPEL, Frank; HIRSCH, Andreas. Dicyanopolyynes: A Homologous Series of End-Capped Linear sp Carbon. Chemistry – A European Journal. 1997, s. 1105–1112. ISSN 1521-3765. DOI 10.1002/chem.19970030718.
- ↑ CATALDO, Franco. From dicopper acetylide to carbyne. Polymer International. 1999, s. 15–22. DOI 10.1002/(SICI)1097-0126(199901)48:1<15::AID-PI85>3.0.CO;2-#.
- ↑ DEMBINSKI, Roman; BARTIK, Tamás; BARTIK, Berit; JAEGER, Monika; GLADYSZ, J. A. Toward Metal-Capped One-Dimensional Carbon Allotropes: Wirelike C6−C20 Polyynediyl Chains That Span Two Redox-Active (η5-C5Me5)Re(NO)(PPh3) Endgroups. Journal of the American Chemical Society. 2000-02-01, s. 810–822. ISSN 0002-7863. DOI 10.1021/ja992747z.
- ↑ CAO, Zhi; XI, Bin; JODOIN, Diane S.; ZHANG, Lei; CUMMINGS, Steven P.; GAO, Yang; TYLER, Sarah F. Diruthenium–Polyyn-diyl–Diruthenium Wires: Electronic Coupling in the Long Distance Regime. Journal of the American Chemical Society. 2014-08-27, s. 12174–12183. ISSN 0002-7863. DOI 10.1021/ja507107t. PMID 25116468.
- ↑ SAKURAI, Aizoh; AKITA, Munetaka; MORO-OKA, Yoshihiko. Synthesis and Characterization of the Dodecahexaynediyldiiron Complex, Fp*−(C≡C)6−Fp* [Fp*= Fe(η5-C5Me5)(CO)2], the Longest Structurally Characterized Polyynediyl Complex. Organometallics. 1999-08-01, s. 3241–3244. ISSN 0276-7333. DOI 10.1021/om990266i.
- ↑ ZHENG, Qinglin; GLADYSZ, J. A. A Synthetic Breakthrough into an Unanticipated Stability Regime: Readily Isolable Complexes in which C16−C28 Polyynediyl Chains Span Two Platinum Atoms. Journal of the American Chemical Society. 2005-08-01, s. 10508–10509. ISSN 0002-7863. DOI 10.1021/ja0534598. PMID 16045336.
- ↑ PIGULSKI, Bartłomiej; GULIA, Nurbey; SZAFERT, Sławomir. Synthesis of Long, Palladium End-Capped Polyynes through the Use of Asymmetric 1-Iodopolyynes. Chemistry: A European Journal. 2015-10-22, s. 17769–17778. ISSN 1521-3765. DOI 10.1002/chem.201502737. PMID 26490174.
- ↑ BRUCE, Michael I.; ZAITSEVA, Natasha N.; NICHOLSON, Brian K.; SKELTON, Brian W.; WHITE, Allan H. Syntheses and molecular structures of some compounds containing many-atom chains end-capped by tricobalt carbonyl clusters. Journal of Organometallic Chemistry. 2008-08-15, s. 2887–2897. DOI 10.1016/j.jorganchem.2008.06.007.
- ↑ BAUGHMAN, R. H. Dangerously Seeking Linear Carbon. Science. 2006, s. 1009–1110. DOI 10.1126/science.1125999. PMID 16709775. S2CID 93868586.
- ↑ a b Lagow, R. J.; KAMPA, J. J.; HAN-CHAO WEI; BATTLE, SCOTT L.; GENGE, JOHN W.; LAUDE, D. A.; HARPER, C. J. Synthesis of linear acetylenic carbon: The "sp" carbon allotrope. Science. 1995, s. 362–7. DOI 10.1126/science.267.5196.362. PMID 17837484. S2CID 12939062. Bibcode 1995Sci...267..362L.
- ↑ CASARI, C. S.; CATALDO, F. Stabilization of linear carbon structures in a solid Ag nanoparticle assembly. Applied Physics Letters. 2007, s. 013111. DOI 10.1063/1.2430676. S2CID 119095451. Bibcode 2007ApPhL..90a3111C. arXiv cond-mat/0610073.
- ↑ GABBAI, F. P.; TAYLOR, T. J. Supramolecular Stabilization of α,ω-Diphenylpolyynes by Complexation to the Tridentate Lewis Acid [o-C6F4Hg]3. Organometallics. March 24, 2006, s. 2143–2147. DOI 10.1021/om060186w.
- ↑ MOVSISYAN, Levon D.; FRANZ, Michael; HAMPEL, Frank; THOMPSON, Amber L.; TYKWINSKI, Rik R.; ANDERSON, Harry L. Polyyne Rotaxanes: Stabilization by Encapsulation. Journal of the American Chemical Society. 2016, s. 1366–1376. DOI 10.1021/jacs.5b12049. PMID 26752712.
- ↑ ZHAO, C.; SHINOHARA, H. Growth of Linear Carbon Chains inside Thin Double-Wall Carbon Nanotubes. Journal of Physical Chemistry C. 2011, s. 13166–13170. DOI 10.1021/jp201647m.
- ↑ PIGULSKI, Bartłomiej; GULIA, Nurbey; SZAFERT, Sławomir. Reactivity of Polyynes: Complex Molecules from Simple Carbon Rods. European Journal of Organic Chemistry. 2019, s. 1420–1445. ISSN 1099-0690. DOI 10.1002/ejoc.201801350. S2CID 104400081. (anglicky)
- ↑ SZAFERT, Slawomir; GLADYSZ, J. A. Update 1 of: Carbon in One Dimension: Structural Analysis of the Higher Conjugated Polyynes. Chemical Reviews. 2006-11-01, s. PR1–PR33. ISSN 0009-2665. DOI 10.1021/cr068016g. PMID 17100401.
- ↑ ANNABELLE, L.K.; SHI SHUN; TYKWINSKI, Rik R. Synthesis of Naturally Occurring Polyynes. Angewandte Chemie International Edition. 2006, s. 1034–57. DOI 10.1002/anie.200502071. PMID 16447152.
- ↑ KONOVALOV, D. A. Polyacetylene Compounds of Plants of the Asteraceae Family (Review). Pharmaceutical Chemistry Journal. December 2014, s. 613–631. Dostupné online [cit. 2020-01-07]. ISSN 0091-150X. DOI 10.1007/s11094-014-1159-7. S2CID 41555718.
- ↑ Stavholt, K., N. A. Sorensen. 1950 Studies relating to naturally-occurring Acetylene Compounds: V. Dehydro Matricaria Ester (Methyl n-decene-triynoate) from the Essential Oil of Artemisia vulgaris L. Acta Chemica Scandinavia 4
- ↑ BLOCK, Eric; GUO, Chuangxing; THIRUVAZHI, Mohan; TOSCANO, Paul J. Total Synthesis of Thiarubrine B [3-(3-Buten-1-ynyl)-6-(1,3-pentadiynyl)-1,2-dithiin], the Antibiotic Principle of Giant Ragweed (Ambrosia trifida). Journal of the American Chemical Society. 1994, s. 9403–9404. DOI 10.1021/ja00099a097.
- ↑ Zidorn, C.; JÖHRER, K.; GANZERA, M.; SCHUBERT, B.; SIGMUND, E.M.; MADER, J.; GREIL, R. Polyacetylenes from the Apiaceae Vegetables Carrot, Celery, Fennel, Parsley, and Parsnip and Their Cytotoxic Activities. J. Agric. Food Chem.. 2005, s. 2518–23. DOI 10.1021/jf048041s. PMID 15796588.
- ↑ ATANASOV, A. G.; BLUNDER, M.; FAKHRUDIN, N.; LIU, X.; NOHA, S. M.; MALAINER, C.; KRAMER, M. P. Polyacetylenes from Notopterygium incisum–new selective partial agonists of peroxisome proliferator-activated receptor-gamma. PLOS ONE. Apr 2013, s. e61755. DOI 10.1371/journal.pone.0061755. PMID 23630612. Bibcode 2013PLoSO...861755A.
- ↑ OHNUMA, T.; ANAN, E.; HOASHI, R.; TAKEDA, Y.; NISHIYAMA, T.; OGURA, K.; HIRATSUKA, A. Dietary diacetylene falcarindiol induces phase 2 drug-metabolizing enzymes andblocks carbon tetrachloride-induced hepatotoxicity in mice through suppression of lipid peroxidation. Biological and Pharmaceutical Bulletin. 2011, s. 371–378. DOI 10.1248/bpb.34.371. PMID 21372387.
- ↑ CHRISTENSEN, L. P. Aliphatic C17-polyacetylenes of the falcarinol type as potential health promoting compounds in food plants of the Apiaceae family. Recent Patents on Food, Nutrition & Agriculture. 2011, s. 64–77. DOI 10.2174/2212798411103010064. PMID 21114468.
- ↑ a b CASCON, Seiva C.; MORS, Walter B.; TURSCH, Bernard M.; APLIN, Robin T.; DURHAM, Lois J. Ichthyothereol and Its Acetate, the Active Polyacetylene Constituents of Ichthyothere terminalis (Spreng.) Malme, a Fish Poison from the Lower Amazon. Journal of the American Chemical Society. 1965, s. 5237–5241. ISSN 0002-7863. DOI 10.1021/ja00950a044. PMID 5844817.
- ↑ EISNER, Thomas; EISNER, Maria; SIEGLER, Melody. Secret Weapons: Defenses of Insects, Spiders, Scorpions, and Other Many-legged Creatures. [s.l.]: Harvard University Press, 2005. ISBN 9780674018822. Kapitola 40. Chauliognathus lecontei (a soldier beetle), s. 185–188.
- ↑ DULEY, W. W.; HU, A. Polyynes and interstellar carbon nanoparticles. The Astrophysical Journal. 2009, s. 808–811. DOI 10.1088/0004-637X/698/1/808. S2CID 119811921. Bibcode 2009ApJ...698..808D.
- ↑ EL GORESY, A.; DONNAY, G. A New Allotropic Form of Carbon from the Ries Crater. Science. 1968, s. 363–364. DOI 10.1126/science.161.3839.363. PMID 17776738. S2CID 43744113. Bibcode 1968Sci...161..363E.
- ↑ SMITH, P. P. K.; BUSEK, P. R. Carbyne Forms of Carbon: Do They Exist?. Science. 1982, s. 984–986. DOI 10.1126/science.216.4549.984. PMID 17809068. S2CID 13290442. Bibcode 1982Sci...216..984S.
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu polyyny na Wikimedia Commons
Obrázky, zvuky či videa k tématu polyyny na Wikimedia Commons
