Neutrofilní granulocyt: Porovnání verzí
přidání textu a citací, doplnění obrázků značky: nevhodná syntaxe v nadpisu editace z Vizuálního editoru |
doplnění odstavce o neutrofilních granulách + citace značka: editace z Vizuálního editoru |
||
| Řádek 481: | Řádek 481: | ||
| datum přístupu = 2018-02-18 |
| datum přístupu = 2018-02-18 |
||
}}</ref>. |
}}</ref>. |
||
=== Neutrofilní granula === |
|||
Typické neutrální zbarvení '''granul''' neutrofilů při barvení hematoxylinem-exosinem dalo neutrofilním granulocytům jejich jméno. Po maturaci neutrofilu dochází ke snížení transkripce a syntézy proteinů a proto je Golgiho aparát výrazně zmenšen a zralé neutrofily také obsahují menší množství mitochondrií. Granula obsahující antimikrobiální proteinu nutné pro efektorové funkce neutrofilů tedy zabírají podstatnou část intracelulárního cytoplazmatického prostoru. Neutrofilní granula se rozdělují do (minimálně) 4 skupin na základě jejich obsahu a rychlosti uvolňování v případě aktivace neutrofilu.<ref>{{Citace periodika |
|||
| příjmení = Sheshachalam |
|||
| jméno = Avinash |
|||
| příjmení2 = Srivastava |
|||
| jméno2 = Nutan |
|||
| příjmení3 = Mitchell |
|||
| jméno3 = Troy |
|||
| titul = Granule Protein Processing and Regulated Secretion in Neutrophils |
|||
| periodikum = Frontiers in Immunology |
|||
| datum vydání = 2014-09-19 |
|||
| ročník = 5 |
|||
| issn = 1664-3224 |
|||
| pmid = 25285096 |
|||
| doi = 10.3389/fimmu.2014.00448 |
|||
| poznámka = PMID: 25285096 |
|||
PMCID: PMC4168738 |
|||
| url = https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4168738/ |
|||
| datum přístupu = 2020-05-25 |
|||
}}</ref> Granula '''azurofilní''' (primární), '''specifická''' (sekundární), '''obsahující želatinázu''' (terciální), '''sekreční vezikuly''' a nově popsaná granula bohatá na ficolin (člen rodiny lektinů, aktivujících lektinovou dráhu komplementu<ref>{{Citace elektronického periodika |
|||
| titul = FCN1 ficolin 1 [Homo sapiens (human)] - Gene - NCBI |
|||
| periodikum = www.ncbi.nlm.nih.gov |
|||
| url = https://www.ncbi.nlm.nih.gov/gene/2219 |
|||
| datum přístupu = 2020-05-25 |
|||
}}</ref>). Granula se kromě obsahu liší také signály potřebnými pro jejich sekreci a umístěním místa sekrece.<ref name=":0">{{Citace periodika |
|||
| příjmení = Yin |
|||
| jméno = Charles |
|||
| příjmení2 = Heit |
|||
| jméno2 = Bryan |
|||
| titul = Armed for destruction: formation, function and trafficking of neutrophil granules |
|||
| periodikum = Cell and Tissue Research |
|||
| datum vydání = 2018-03-01 |
|||
| ročník = 371 |
|||
| číslo = 3 |
|||
| strany = 455–471 |
|||
| issn = 1432-0878 |
|||
| doi = 10.1007/s00441-017-2731-8 |
|||
| jazyk = en |
|||
| url = https://doi.org/10.1007/s00441-017-2731-8 |
|||
| datum přístupu = 2020-05-25 |
|||
}}</ref> |
|||
'''Azurofilní granula''' jsou typická přítomnosti [[Myeloperoxidáza|myeloperoxidázy]] (až 69% z celkového obsahu MPO v buňce), dále obsahují například α‐defensin, neutrofilní elastázu, [[lysozym]] nebo katepsin G.<ref name=":1">{{Citace periodika |
|||
| příjmení = Rørvig |
|||
| jméno = Sara |
|||
| příjmení2 = Østergaard |
|||
| jméno2 = Ole |
|||
| příjmení3 = Heegaard |
|||
| jméno3 = Niels H. H. |
|||
| titul = Proteome profiling of human neutrophil granule subsets, secretory vesicles, and cell membrane: correlation with transcriptome profiling of neutrophil precursors |
|||
| periodikum = Journal of Leukocyte Biology |
|||
| datum vydání = 2013 |
|||
| ročník = 94 |
|||
| číslo = 4 |
|||
| strany = 711–721 |
|||
| issn = 1938-3673 |
|||
| doi = 10.1189/jlb.1212619 |
|||
| jazyk = en |
|||
| url = https://jlb.onlinelibrary.wiley.com/doi/abs/10.1189/jlb.1212619 |
|||
| datum přístupu = 2020-05-25 |
|||
}}</ref> Jejich hlavní role je antimikrobicidní, což koreluje s jejich obsahem. Azurofilní granula mohou být jak sekretována do extracelulárního prostoru (degranulována) nebo mohou být fúzována s fagocytickými váčky, kde jejich obsah zajišťuje eliminaci pohlcených patogenů.<ref name=":0" /> |
|||
'''Specifická granula a granula terciální''' jsou často uváděny společně, neboť jejich syntéza a proteinový obsah se částečně překrývají. Specifická granula obsahují z velké části lipokalin asociovaný s želatinázou neutrofilů (z angl. neutrophil gelatinase-associated lipocalin, NGAL), laktoferin nebo pentraxin 3. Hlavním proteinem tvořícím obsah terciálních granul,jak už jejich název napovídá, je neutrofilní želatináza (z angl. gelatinase).<ref name=":1" /> Proteiny obsažené v sekundárních a terciálních granulách zastávají funkci hlavně v extravazaci a migraci neutrofilů do místa zánětu a dále znesnadňují růst mikroorganismů v zasažené tkáni.<ref name=":0" /> |
|||
'''Sekreční vezikuly''' obsahují [[Mitochondrie|mitochondriální]] a [[Ribozom|ribosomální]] proteiny, strukturální proteiny jako β-[[aktin]] a α-aktin nebo receptory pro rozpoznání molekulárních struktur asociovaných s patogeny ([[PAMP (imunologie)|PAMP]]) [[Toll-like receptor|TLR]]2 a [[TLR6]].<ref name=":1" /> Sekreční vezikuly jsou narozdíl od ostatních neutrofilních granul tvořeny [[Endocytóza|endocytózou]]. Jejich obsah ale není degradován a je zachován pro případné využití.<ref name=":0" /> |
|||
=== Povrchové molekuly === |
=== Povrchové molekuly === |
||
Verze z 25. 5. 2020, 12:10

Neutrofilní granulocyt (zkráceně neutrofil) je zástupcem buněčné části přirozené imunity a také nejpočetnějším leukocytem cirkulujícím v krvi člověka nebo myší. Alternativní název tohoto typu buněk jsou polymorfonukleární neutrofily (z angl. polymorphonuclear neutrophils, PMN), název odvozený od typické segmentované morfologie jádra neutrofilů.[1] Neutrofily představují jedny z hlavních efektorových buněk podílejících se na akutní fázi zánětu a eliminaci patogenů v případě bakteriální infekce. Hlavní chemotaktickou molekulou pro neutrofily je chemokin interleukin 8 (IL-8).[2]
Název je odvozen od zbarvení granul, které jsou v jeho cytoplasmě. Společně s eosinofily a basofily tvoří rodinu polymorfonukleárních leukocytů. Zatímco při barvení hematoxylin-eosinem se eozinofilní granulocyt barví do červena a bazofilní granulocyt naopak do tmavě modra, cytoplasmatické granule neutrofilních granulocytů se barví neutrálně do růžového odstínu.
V krevní cirkulaci jsou neutrofily schopné přežití až 5 dnů, při vycestování do tkáně pak dochází k rapidní aktivaci neutrofilů a jejich rychlému odumírání. Pohlcení apoptotických neutrofilů makrofágy vede k jejich utlumení a postupné rezoluci zánětlivé odpovědi.[3]
Vývoj
K vývoji neutrofilů dochází v kostní dřeni, kde vycházejí z prekurzorů myeloidní linie procesem zvaným granulopoéza. Vývoj neutrofilů probíhá přibližně 14 dní, při kterých postupně procházející jednotlivými vývojovými stádii nazvanými myeloblast, promyelocyt, myelocyt, metamyelocyt a tyčka. Krev opouštějí jako plně zralé segmentované neutrofily. V průběhu vývoje dochází k postupné expresi rozličných povrchových molekul mezi něž patří například CD33, CD15, CD11b a zvyšuje se exprese CXCR2 (receptoru pro chemokin CXCL2) a snižuje se exprese CXCR4 (receptoru pro CXCL12, chemokinu díky jehož přítomnosti jsou neutrofily během vývoje zadržovány v kostní dřeni).[4]

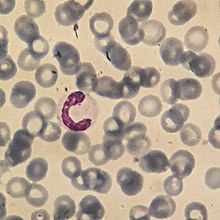
Nezralé neutrofily mají jádro protáhlé, různě zakřivené. Tyto buňky označujeme jako tyčky. Zralé neutrofily obsahují jádra laločnatá a segmentovaná. Nazývají se proto segmenty. Tyto dvě subpopulace neutrofilů se liší mimo jiné i permeabilitou membrány, schopností adherovat nebo i tím, v jakém množství produkují kyslikové radikály.[5][6]
Neutrofily se řadí mezi polymorfonukleáry, které jsou typické segmentací jádra. Ta se stupňuje postupem času - zdravý neutrofil by měl mít 3-5 laloků, nedostatek vitaminu B12 a jiné poruchy mohou způsobit hypersegmentaci. Během dospívání neutrofilu postupně mizí jadérko. Dalším typickým znakem neutrofilů jsou azurofilní granula obsahující antimikrobiální molekuly.
Neutrofily přítomné v krevním oběhu tvoří asi 10% celkového množství v organismu, při zánětu se pod vlivem prozánětlivých cytokinů jejich počet zvyšuje vyplavováním zásob z kostní dřeni. Zvýšená tvorba neutrofilů a jejich zvýšené vyplavování z kostní dřeně se nazývá nouzová granulopoéza (z angl. emergency granulopoiesis).[7]
Tvoří 60–70 % leukocytů periferní krve. 6–12 hodin se vyskytují v krevním oběhu a 4–5 dní ve tkáni. Pouze 7 % z celkového počtu se nachází v periferní krvi, 93 % nalezneme v kostní dřeni (mění se vlivem zánětlivých cytokinů a bakteriálních produktů).
Funkce
Neutrofily jsou atrahovány do poškozených nebo infikovaných tkání na základě gradientu chemotaktických molekul produkovaných stresovanými epiteliálními nebo endoteliálními buňkami a buňkami přirozené imunity přítomnými v dané tkáni, jako jsou například makrofágy.[8] Mezi molekuly schopné navodit migraci neutrofilů a jejich prostup do tkáně patří chemokin CXCL8 (IL-8), faktor stimulující kolonie granulocytů (G-CSF), leukotrien B4 (LTB4, eikosanoid, produkt metabolismu kyseliny arachidonové) nebo formyl-methionin-leucil-phenylalanin (fMLP) nebo například chemotaktické fragmenty komplementu C5a a C3a. Neutrofily žijí relativně krátce a po odumření v místě zánětu tvoří dominantní část hnisu, kterému dodávají typické zbarvení.
Neutrofily se vyskytují jak v krevním řečišti tak přímo ve tkáních, kde se podílí na opsonizaci a fagocytóze antigenů (proto se dříve označovaly též jako mikrofágy) proniklých do organismu. Neutrofily se jako jedny z prvních buněk infiltrující postižené místo účastní akutní fáze zánětu[9]. Podílejí se na likvidaci především bakteriálních infekcí, ale jsou mobilizované i v případě některých rakovin[10][11] nebo při nespecifickém zánětu způsobeném vnějšímy faktory, například znečištěním ovzduší[12].
Přestup do tkáně
K přestupu do tkáně dochází hlavně v nejmenších kapilárách (venulách), kde mají buňky větší možnost se navázat na receptory na povrchu endoteliálních buněk a snadněji procházejí skrz cévní stěnu. Endoteliální buňky při poranění nebo v blízkosti infekce začínají na svém povrchu zvyšovat počet adhezivních molekul (selektiny, interginy). Neutrofily atrahované do infikovaného místa na základě chemotatických molekul se pomocí receptorů naváží na tyto adhezivní molekuly. Nejprve dochází k navázání selektinů a pouze k lehké vazbě na stěnu cévy a procesu zvanému rolování, kdy se neutrofily "koulejí" po cévní stěně. Následně dochází k navázání na integriny a pevné adhezi na cévní stěnu. Když je neutrofil pevně zachycen dochází k prostupu mezi endoteliálními buňkami procesem zvaným diapedéza.
Efektorové mechanismy
Fagocytóza
Neutrofily jsou velice účinné fagocyty schopné pohltit extracelulární bakterie a buněčný odpad (např. části mrtvých buňek). Neutrofily, podobně jako další fagocyty, jsou schopné rozpoznat a pohltit patogenní částici v nativní formě[13] nebo opsonizovanou (protilátkami, fragmenty komplementu).[14] Pro rozpoznání opsonizované částice mají neutrofily na povrchu specializované receptory. Mezi receptory rozpoznávající částice opsonizované protilátkami patří Fc receptory (např. FcγRIIA/CD32 nebo FcγRIIIb/CD16), pro částice opsonizované prvky komplementu jsou neutrofily vybaveny komplementovými receptory (např. MAC1/CD11b).[15] Po pohlcení částice dochází ke "zrání" fagosomu. Na povrchu fagosomu se skládá komplex NADHP oxidázy, jejíž funkcí dochází ke snižování pH ve veziklu nebo dochází ke splynutí fagosomu s granuly obsahujícími antimikrobiální peptidy (defensiny, lysozym) a tvorbě fagolysozomu.
Degranulace
V procesu degranulace, dochází u neutrofilů k fúzi cytoplazmatických granul s membránou buňky a tím vylití jejich obsahu do extracelulárního prostoru. Zde působí jednak antimikrobiálně, ale mohou poškodit i okolní tkáň a amplifikovat tak zánětlivou odpověď. Granula se dělí na různé skupiny podle jejich obsahu. Azurofilní granula, která v neutrofilech převažují, obsahují hlavně defensiny (krátké antimikrobiální peptidy), myeloperoxidázu (enzym podílející se na respiračním vzplanutí), serinové proteázy, elastázy a kathepsin. Specifická granula, přítomná pouze u granulocytů, obsahují lysozym, NADPH oxidázu, alkalickou fosfatázu, kolagenázu, kathelicidin a další antimikrobiálně působící látky.[16]
Produkce cytokinů
Neutrofily stejně jako jiné buňky imunitního systému produkují řadu molekul, které slouží v rámci mezibuněčné signalizace a regulace zánětu. [17] Mezi molekuly produkované po aktivaci neutrofilů mohou patřit cytokiny (např. TNF-α, IL-1β, IL-1Ra, IL-6), chemokiny (např. CXCL1, CXCL8/IL-8, CXCL10), hematopoetické a angiogení faktory (G-CSF a VEGF).[18]
NETóza
NETóza, neboli produkce neutrofilních extracelulárních pastí (z angl. neutrophil extracellular traps, NETs), je proces při kterém dochází k uvolnění chromatinu z neutrofilu do mezibuněčného prostoru. Rozvolněná DNA vytváří komplexní sítě na které adherují antimikrobiální peptidy (defensiny, myeloperoxidáza, neutrofilní elastáza). Tato síť slouží primárně k zachycení většího množství bakterií, které mohou další fagocytující buňky pohltit.[19] Asociované antimikrobiální peptidy a samotná DNA také působí antomikrobicidně, což přispívá k likvidaci bakterií nebo jiných zachycených patogenů.Takto vytvořené sítě mohou ale zvyšovat riziko trombóz, pokud jsou vytvořené v krevním řečišti a zachytí tak i krevní elementy.[20][21]
Charakteristika
Fyziologie
Neutrofily jsou nejpočetnější populací bílých krvinek v lidském těle, tvoří asi 50-70% všech leukocytů. Tato hodnota může být podstatně nižší u některých etnických skupin, kdy se označuje za benigní neutropenii a může mít vliv na účinnost léčby[22][23]. Neutropenie, tedy nízký počet neutrofilů, může být způsobena více faktory. Může být vrozená (kongenitální)[24], způsobená nemocí (aplastická anemie [25], některé druhy leukemií), nebo následkem chemoterapie[26].
Neutrofilní granula
Typické neutrální zbarvení granul neutrofilů při barvení hematoxylinem-exosinem dalo neutrofilním granulocytům jejich jméno. Po maturaci neutrofilu dochází ke snížení transkripce a syntézy proteinů a proto je Golgiho aparát výrazně zmenšen a zralé neutrofily také obsahují menší množství mitochondrií. Granula obsahující antimikrobiální proteinu nutné pro efektorové funkce neutrofilů tedy zabírají podstatnou část intracelulárního cytoplazmatického prostoru. Neutrofilní granula se rozdělují do (minimálně) 4 skupin na základě jejich obsahu a rychlosti uvolňování v případě aktivace neutrofilu.[27] Granula azurofilní (primární), specifická (sekundární), obsahující želatinázu (terciální), sekreční vezikuly a nově popsaná granula bohatá na ficolin (člen rodiny lektinů, aktivujících lektinovou dráhu komplementu[28]). Granula se kromě obsahu liší také signály potřebnými pro jejich sekreci a umístěním místa sekrece.[29]
Azurofilní granula jsou typická přítomnosti myeloperoxidázy (až 69% z celkového obsahu MPO v buňce), dále obsahují například α‐defensin, neutrofilní elastázu, lysozym nebo katepsin G.[30] Jejich hlavní role je antimikrobicidní, což koreluje s jejich obsahem. Azurofilní granula mohou být jak sekretována do extracelulárního prostoru (degranulována) nebo mohou být fúzována s fagocytickými váčky, kde jejich obsah zajišťuje eliminaci pohlcených patogenů.[29]
Specifická granula a granula terciální jsou často uváděny společně, neboť jejich syntéza a proteinový obsah se částečně překrývají. Specifická granula obsahují z velké části lipokalin asociovaný s želatinázou neutrofilů (z angl. neutrophil gelatinase-associated lipocalin, NGAL), laktoferin nebo pentraxin 3. Hlavním proteinem tvořícím obsah terciálních granul,jak už jejich název napovídá, je neutrofilní želatináza (z angl. gelatinase).[30] Proteiny obsažené v sekundárních a terciálních granulách zastávají funkci hlavně v extravazaci a migraci neutrofilů do místa zánětu a dále znesnadňují růst mikroorganismů v zasažené tkáni.[29]
Sekreční vezikuly obsahují mitochondriální a ribosomální proteiny, strukturální proteiny jako β-aktin a α-aktin nebo receptory pro rozpoznání molekulárních struktur asociovaných s patogeny (PAMP) TLR2 a TLR6.[30] Sekreční vezikuly jsou narozdíl od ostatních neutrofilních granul tvořeny endocytózou. Jejich obsah ale není degradován a je zachován pro případné využití.[29]
Povrchové molekuly
Jednotlivé buněčné populace imunitních buněk přítomných v krvi nebo v tkáních jsme schopni rozlišovat na základě exprese povrchových molekul. Povrchové molekuly přítomné na neutrofilech také definují v jakém stádiu vývoje nebo aktivace se buňky nachází. Lidské a myší neutrofily mohou být charakterizovány na základě řady povrchových molekul a jejich kombinací. Základní charakterizací lidských neutrofilů je exprese CD11b, CD15, CD16 a CD33.[31] Neutrofily u myší definujeme jako CD11b+ a Ly6G+ buňky.[32]
Povrchové molekuly na lidských neutrofilech
CD11b
CD11b je molekula z rodiny integrinů, která je přítomna na povrchu širokého spektra bílých krvinek (monocyty, neutrofily, makrofágy, NK buňky atd.). CD11b napomáhá adhezi leukocytů na aktivovaný endotel a společně s CD18 (se kterým tvoří heterodimer CR3) zprostředkuje vycestování leukocytů do tkáně. CD11b se také podílí na fagocytóze částic opsonizovaných fragmenty komplementu.[33]
CD15
Molekula CD15 neboli Lewis x antigen je zodpovědná za adhezi neutrofilů na dendritické buňky.[34] Dále může CD15 regulovat fagocytózu, degranulaci a oxidativní vzplanutí.[35] Protilátky proti této skupině se využívají v diagnostice některých onemocnění, zejména v případě Hodgkinova lymfomu.[36]
CD16
CD16 neboli FcγRIIIb se podílí hlavně v procesech spojených se sekrecí toxických molekul a méně na procesech spojených s fagocytózou a následnou eliminací patogenů.[37]
CD33
CD33 (Siglec) zprostředkuje mezibuněčný kontakt a udržuje imunitní buňky v klidovém stavu.[38] CD33 byl považován za marker vyskytující se pouze na myeloidní linii leukocytů, ale bylo ukázáno, že se může vyskytovat i na T lymfocytech a NK buňkách.[39] Společně s CD11b je CD33 také markerem lidských myeloidních supresorových buněk (MDSC).[40]
CD62L
CD62L (L-selectin) náleží do rodiny povrchových lektinů a podílí se na vazbě neutrofilů na cévní stěnu a následné "rolování" po endotelu. Dále napomáhá se spouštěním zánětlivé reakce. CD62L je odvrhován z povrchu neutrofilů po kontaktu se svým přirozeným ligandem (bakterie atd.).[41]
CXCR2
CXCR2 (CXC chemokinový receptor typu 2) je alternativně označovaný jako receptor pro IL-8. CXCR2 váže s IL-8 s vysokou afinitou a způsobuje aktivaci neutrofilů.[42]
CD87
CD87 je povrchový glykoprotein navázaný na membránu pomocí GPI kotvy. Účastní se aktivace plasminogenu, který hraje roli mimo jiné v hojení poškozené tkáně, ale často se vyskytuje u nádorů a zvyšuje jejich malignitu [43].
Povrchové molekuly na myších neutrofilech
Ly6G
Ly6G (ze superrodiny Ly6 proteinů) je charakteristický povrchový marker myších neutrofilů, ale dosud nebyla přesně charakterizována jeho funkce. Ligand pro Ly6G také zůstává neznámý. Přesto se Ly6G užívá běžně k identifikaci neutrofilů a také jejich depleci v rozličných experimentech prováděných na myších. Ly6G a jeho strukturně příbuzná molekula Ly6C (často užívána jako marker myších monocytů) jsou souhrnně označovány jako Gr-1.[44]
Reference
- ↑ Neutrophils | British Society for Immunology. www.immunology.org [online]. [cit. 2020-05-12]. Dostupné online.
- ↑ KOBAYASHI, Yoshiro. The role of chemokines in neutrophil biology. Frontiers in Bioscience: A Journal and Virtual Library. 2008-01-01, roč. 13, s. 2400–2407. PMID: 17981721. Dostupné online [cit. 2020-05-12]. ISSN 1093-9946. DOI 10.2741/2853. PMID 17981721.
- ↑ SILVA, Manuel T. Macrophage phagocytosis of neutrophils at inflammatory/infectious foci: a cooperative mechanism in the control of infection and infectious inflammation. Journal of Leukocyte Biology. 2011-05, roč. 89, čís. 5, s. 675–683. PMID: 21169518. Dostupné online [cit. 2020-05-12]. ISSN 1938-3673. DOI 10.1189/jlb.0910536. PMID 21169518.
- ↑ LAWRENCE, Shelley M.; CORRIDEN, Ross; NIZET, Victor. The Ontogeny of a Neutrophil: Mechanisms of Granulopoiesis and Homeostasis. Microbiology and Molecular Biology Reviews : MMBR. 2018-02-07, roč. 82, čís. 1. PMID: 29436479 PMCID: PMC5813886. Dostupné online [cit. 2020-05-12]. ISSN 1092-2172. DOI 10.1128/MMBR.00057-17. PMID 29436479.
- ↑ GERASIMOV, I. G.; IGNATOV, D. Iu. [Functional heterogenicity of human blood neutrophils: generation of oxygen active species]. Tsitologiia. 2001, roč. 43, čís. 5, s. 432–436. PMID: 11517658. Dostupné online [cit. 2018-02-18]. ISSN 0041-3771. PMID 11517658.
- ↑ IGNATOV, Dmitry. Functional heterogeneity of human neutrophils and their role in peripheral blood leukocyte quantity regulation. [s.l.]: [s.n.] Dostupné online. DOI 10.13140/rg.2.2.35542.34884. DOI: 10.13140/RG.2.2.35542.34884.
- ↑ MANZ, Markus G.; BOETTCHER, Steffen. Emergency granulopoiesis. Nature Reviews Immunology. 2014-05, roč. 14, čís. 5, s. 302–314. Dostupné online [cit. 2020-05-18]. ISSN 1474-1741. DOI 10.1038/nri3660. (anglicky)
- ↑ NUZZI, Paul A.; LOKUTA, Mary A.; HUTTENLOCHER, Anna. Analysis of neutrophil chemotaxis. Methods in Molecular Biology (Clifton, N.J.). 2007, roč. 370, s. 23–36. PMID: 17416985. Dostupné online [cit. 2018-02-17]. ISSN 1064-3745. DOI 10.1007/978-1-59745-353-0_3. PMID 17416985.
- ↑ SELDERS, Gretchen S.; FETZ, Allison E.; RADIC, Marko Z. An overview of the role of neutrophils in innate immunity, inflammation and host-biomaterial integration. Regenerative Biomaterials. 2017-2, roč. 4, čís. 1, s. 55–68. PMID: 28149530 PMCID: PMC5274707. Dostupné online [cit. 2018-02-17]. ISSN 2056-3418. DOI 10.1093/rb/rbw041. PMID 28149530.
- ↑ OCANA, Alberto; NIETO-JIMÉNEZ, Cristina; PANDIELLA, Atanasio. Neutrophils in cancer: prognostic role and therapeutic strategies. Molecular Cancer. 2017-08-15, roč. 16. PMID: 28810877 PMCID: PMC5558711. Dostupné online [cit. 2018-02-17]. ISSN 1476-4598. DOI 10.1186/s12943-017-0707-7. PMID 28810877.
- ↑ TREFFERS, Louise W.; HIEMSTRA, Ida H.; KUIJPERS, Taco W. Neutrophils in cancer. Immunological Reviews. 09 2016, roč. 273, čís. 1, s. 312–328. PMID: 27558343. Dostupné online [cit. 2018-02-17]. ISSN 1600-065X. DOI 10.1111/imr.12444. PMID 27558343.
- ↑ JACOBS, Lotte; NAWROT, Tim S.; DE GEUS, Bas. Subclinical responses in healthy cyclists briefly exposed to traffic-related air pollution: an intervention study. Environmental Health: A Global Access Science Source. 2010-10-25, roč. 9, s. 64. PMID: 20973949 PMCID: PMC2984475. Dostupné online [cit. 2018-02-17]. ISSN 1476-069X. DOI 10.1186/1476-069X-9-64. PMID 20973949.
- ↑ THOMAS, Christina J.; SCHRODER, Kate. Pattern recognition receptor function in neutrophils. Trends in Immunology. July 2013, roč. 34, čís. 7, s. 317–328. PMID: 23540649. Dostupné online [cit. 2018-02-18]. ISSN 1471-4981. DOI 10.1016/j.it.2013.02.008. PMID 23540649.
- ↑ VAN KESSEL, Kok P. M.; BESTEBROER, Jovanka; VAN STRIJP, Jos A. G. Neutrophil-Mediated Phagocytosis of Staphylococcus aureus. Frontiers in Immunology. 2014-09-26, roč. 5. PMID: 25309547 PMCID: PMC4176147. Dostupné online [cit. 2018-02-18]. ISSN 1664-3224. DOI 10.3389/fimmu.2014.00467. PMID 25309547.
- ↑ LEE, Warren L.; HARRISON, Rene E.; GRINSTEIN, Sergio. Phagocytosis by neutrophils. Microbes and Infection. 2003-11-01, roč. 5, čís. 14, s. 1299–1306. Dostupné online [cit. 2020-05-12]. ISSN 1286-4579. DOI 10.1016/j.micinf.2003.09.014. (anglicky)
- ↑ LACY, Paige. Mechanisms of Degranulation in Neutrophils. Allergy, Asthma, and Clinical Immunology : Official Journal of the Canadian Society of Allergy and Clinical Immunology. 2006-09-15, roč. 2, čís. 3, s. 98–108. PMID: 20525154 PMCID: PMC2876182. Dostupné online [cit. 2020-05-12]. ISSN 1710-1484. DOI 10.1186/1710-1492-2-3-98. PMID 20525154.
- ↑ TECCHIO, Cristina; MICHELETTI, Alessandra; CASSATELLA, Marco A. Neutrophil-Derived Cytokines: Facts Beyond Expression. Frontiers in Immunology. 2014-10-21, roč. 5. PMID: 25374568 PMCID: PMC4204637. Dostupné online [cit. 2018-02-17]. ISSN 1664-3224. DOI 10.3389/fimmu.2014.00508. PMID 25374568.
- ↑ TAMASSIA, Nicola; BIANCHETTO‐AGUILERA, Francisco; ARRUDA‐SILVA, Fabio. Cytokine production by human neutrophils: Revisiting the “dark side of the moon”. European Journal of Clinical Investigation. 2018, roč. 48, čís. S2, s. e12952. Dostupné online [cit. 2020-05-12]. ISSN 1365-2362. DOI 10.1111/eci.12952. (anglicky)
- ↑ BRINKMANN, Volker; REICHARD, Ulrike; GOOSMANN, Christian. Neutrophil extracellular traps kill bacteria. Science (New York, N.Y.). 2004-03-05, roč. 303, čís. 5663, s. 1532–1535. PMID: 15001782. Dostupné online [cit. 2020-05-12]. ISSN 1095-9203. DOI 10.1126/science.1092385. PMID 15001782.
- ↑ LARIDAN, Elodie; MARTINOD, Kimberly; DE MEYER, Simon F. Neutrophil Extracellular Traps in Arterial and Venous Thrombosis. Seminars in Thrombosis and Hemostasis. 2019-02, roč. 45, čís. 1, s. 86–93. PMID: 30634198. Dostupné online [cit. 2020-05-12]. ISSN 1098-9064. DOI 10.1055/s-0038-1677040. PMID 30634198.
- ↑ FUCHS, Tobias A.; BRILL, Alexander; DUERSCHMIED, Daniel. Extracellular DNA traps promote thrombosis. Proceedings of the National Academy of Sciences of the United States of America. 2010-09-07, roč. 107, čís. 36, s. 15880–15885. PMID: 20798043 PMCID: PMC2936604. Dostupné online [cit. 2018-02-18]. ISSN 1091-6490. DOI 10.1073/pnas.1005743107. PMID 20798043.
- ↑ HADDY, T. B.; RANA, S. R.; CASTRO, O. Benign ethnic neutropenia: what is a normal absolute neutrophil count?. The Journal of Laboratory and Clinical Medicine. January 1999, roč. 133, čís. 1, s. 15–22. PMID: 10385477. Dostupné online [cit. 2018-02-17]. ISSN 0022-2143. DOI 10.1053/lc.1999.v133.a94931. PMID 10385477.
- ↑ GRANN, Victor R.; BOWMAN, Natalie; JOSEPH, Cecil. Neutropenia in 6 ethnic groups from the Caribbean and the U.S.. Cancer. 2008-08-15, roč. 113, čís. 4, s. 854–860. Dostupné online [cit. 2018-02-17]. ISSN 1097-0142. DOI 10.1002/cncr.23614. (anglicky)
- ↑ DONADIEU, Jean; FENNETEAU, Odile; BEAUPAIN, Blandine. Congenital neutropenia: diagnosis, molecular bases and patient management. Orphanet Journal of Rare Diseases. 2011-05-19, roč. 6, s. 26. PMID: 21595885 PMCID: PMC3127744. Dostupné online [cit. 2018-02-18]. ISSN 1750-1172. DOI 10.1186/1750-1172-6-26. PMID 21595885.
- ↑ MULHOLLAND, M W; DELANEY, J P. Neutropenic colitis and aplastic anemia: a new association.. Annals of Surgery. January 1983, roč. 197, čís. 1, s. 84–90. PMID: 6848059 PMCID: PMC1352859. Dostupné online [cit. 2018-02-18]. ISSN 0003-4932. PMID 6848059.
- ↑ LUSTBERG, Maryam B. Management of Neutropenia in Cancer Patients. Clinical advances in hematology & oncology : H&O. 2012-12, roč. 10, čís. 12, s. 825–826. PMID: 23271355 PMCID: PMC4059501. Dostupné online [cit. 2018-02-18]. ISSN 1543-0790. PMID 23271355.
- ↑ SHESHACHALAM, Avinash; SRIVASTAVA, Nutan; MITCHELL, Troy. Granule Protein Processing and Regulated Secretion in Neutrophils. Frontiers in Immunology. 2014-09-19, roč. 5. PMID: 25285096 PMCID: PMC4168738. Dostupné online [cit. 2020-05-25]. ISSN 1664-3224. DOI 10.3389/fimmu.2014.00448. PMID 25285096.
- ↑ FCN1 ficolin 1 [Homo sapiens (human)] - Gene - NCBI. www.ncbi.nlm.nih.gov [online]. [cit. 2020-05-25]. Dostupné online.
- ↑ a b c d YIN, Charles; HEIT, Bryan. Armed for destruction: formation, function and trafficking of neutrophil granules. Cell and Tissue Research. 2018-03-01, roč. 371, čís. 3, s. 455–471. Dostupné online [cit. 2020-05-25]. ISSN 1432-0878. DOI 10.1007/s00441-017-2731-8. (anglicky)
- ↑ a b c RØRVIG, Sara; ØSTERGAARD, Ole; HEEGAARD, Niels H. H. Proteome profiling of human neutrophil granule subsets, secretory vesicles, and cell membrane: correlation with transcriptome profiling of neutrophil precursors. Journal of Leukocyte Biology. 2013, roč. 94, čís. 4, s. 711–721. Dostupné online [cit. 2020-05-25]. ISSN 1938-3673. DOI 10.1189/jlb.1212619. (anglicky)
- ↑ LAKSCHEVITZ, Flavia S.; HASSANPOUR, Siavash; RUBIN, Ayala. Identification of neutrophil surface marker changes in health and inflammation using high-throughput screening flow cytometry. Experimental Cell Research. 2016-03-15, roč. 342, čís. 2, s. 200–209. PMID: 26970376. Dostupné online [cit. 2020-05-15]. ISSN 1090-2422. DOI 10.1016/j.yexcr.2016.03.007. PMID 26970376.
- ↑ COTTER, Matthew J.; MURUVE, Daniel A. Isolation of neutrophils from mouse liver: A novel method to study effector leukocytes during inflammation. Journal of Immunological Methods. 2006-05-30, roč. 312, čís. 1, s. 68–78. Dostupné online [cit. 2020-05-15]. ISSN 0022-1759. DOI 10.1016/j.jim.2006.02.019. (anglicky)
- ↑ ITGAM integrin subunit alpha M [Homo sapiens (human)] - Gene - NCBI. www.ncbi.nlm.nih.gov [online]. [cit. 2020-05-15]. Dostupné online.
- ↑ GADHOUM, Samah Zeineb; SACKSTEIN, Robert. Lewis x/CD15 expression in human myeloid cell differentiation is regulated by sialidase activity. Nature chemical biology. 2008-12, roč. 4, čís. 12, s. 751–757. PMID: 18953356 PMCID: PMC2597094. Dostupné online [cit. 2020-05-15]. ISSN 1552-4450. DOI 10.1038/nchembio.116. PMID 18953356.
- ↑ NAKAYAMA, Fumiaki; NISHIHARA, Shoko; IWASAKI, Hiroko. CD15 Expression in Mature Granulocytes Is Determined by α1,3-Fucosyltransferase IX, but in Promyelocytes and Monocytes by α1,3-Fucosyltransferase IV. Journal of Biological Chemistry. 2001-05-11, roč. 276, čís. 19, s. 16100–16106. PMID: 11278338. Dostupné online [cit. 2020-05-15]. ISSN 0021-9258. DOI 10.1074/jbc.M007272200. PMID 11278338. (anglicky)
- ↑ KERR, M. A.; STOCKS, S. C. The role of CD15-(Le(X))-related carbohydrates in neutrophil adhesion. The Histochemical Journal. November 1992, roč. 24, čís. 11, s. 811–826. PMID: 1362195. Dostupné online [cit. 2018-02-17]. ISSN 0018-2214. PMID 1362195.
- ↑ FOSSATI, Gianluca; MOOTS, Robert J.; BUCKNALL, Roger C. Differential role of neutrophil Fcgamma receptor IIIB (CD16) in phagocytosis, bacterial killing, and responses to immune complexes. Arthritis and Rheumatism. 2002-05, roč. 46, čís. 5, s. 1351–1361. PMID: 12115243. Dostupné online [cit. 2020-05-15]. ISSN 0004-3591. DOI 10.1002/art.10230. PMID 12115243.
- ↑ CD33 - Myeloid cell surface antigen CD33 precursor - Homo sapiens (Human) - CD33 gene & protein. www.uniprot.org [online]. [cit. 2020-05-15]. Dostupné online.
- ↑ HERNÁNDEZ-CASELLES, Trinidad; MARTÍNEZ-ESPARZA, María; PÉREZ-OLIVA, Ana B. A study of CD33 (SIGLEC-3) antigen expression and function on activated human T and NK cells: two isoforms of CD33 are generated by alternative splicing. Journal of Leukocyte Biology. 2006-01, roč. 79, čís. 1, s. 46–58. PMID: 16380601. Dostupné online [cit. 2020-05-18]. ISSN 0741-5400. DOI 10.1189/jlb.0205096. PMID 16380601.
- ↑ PILLAY, Janesh; TAK, Tamar; KAMP, Vera M. Immune suppression by neutrophils and granulocytic myeloid-derived suppressor cells: similarities and differences. Cellular and Molecular Life Sciences. 2013, roč. 70, čís. 20, s. 3813–3827. PMID: 23423530 PMCID: PMC3781313. Dostupné online [cit. 2020-05-18]. ISSN 1420-682X. DOI 10.1007/s00018-013-1286-4. PMID 23423530.
- ↑ BOER, Klas; VOGELSANG, Heinz; DEUFEL, Thomas. CD62L on neutrophil granulocytes, a useful, complementary marker for the prediction of ventriculitis in blood-containing CSF. Clinical Biochemistry. 2010-11-01, roč. 43, čís. 16, s. 1351–1355. Dostupné online [cit. 2020-05-18]. ISSN 0009-9120. DOI 10.1016/j.clinbiochem.2010.07.003. (anglicky)
- ↑ CXCR2 - C-X-C chemokine receptor type 2 - Homo sapiens (Human) - CXCR2 gene & protein. www.uniprot.org [online]. [cit. 2020-05-18]. Dostupné online.
- ↑ BÉNÉ, M. C.; CASTOLDI, G.; KNAPP, W. CD87 (urokinase-type plasminogen activator receptor), function and pathology in hematological disorders: a review. Leukemia. March 2004, roč. 18, čís. 3, s. 394–400. PMID: 14671631. Dostupné online [cit. 2018-02-17]. ISSN 0887-6924. DOI 10.1038/sj.leu.2403250. PMID 14671631.
- ↑ WANG, Jun-Xia; BAIR, Angela M.; KING, Sandra L. Ly6G ligation blocks recruitment of neutrophils via a β2-integrin–dependent mechanism. Blood. 2012-08-16, roč. 120, čís. 7, s. 1489–1498. PMID: 22661700 PMCID: PMC3423786. Dostupné online [cit. 2020-05-18]. ISSN 0006-4971. DOI 10.1182/blood-2012-01-404046. PMID 22661700.

